Coronaires
Publié le 09 oct 2007Lecture 22 min
Le suivi en ville du coronarien
A. HAGÈGE, hôpital européen Georges Pompidou, Paris
Dans les 6 ans suivant un syndrome coronaire aigu, 18 % des hommes et 35 % des femmes auront un nouvel accident coronaire tandis que la plupart des arrêts cardiaques surviennent dans les 18 mois après la sortie de l’hôpital suite à un infarctus(1-4). Les patients ayant fait un infarctus ont un taux de mort subite 4 à 6 fois plus élevé que celui de la population générale. De plus, 70 % des décès coronaires et 50 % des infarctus surviennent chez des sujets ayant des antécédents de coronaropathie et la probabilité d’infarctus mortel est 4 à 7 fois plus élevée chez les coronariens avérés(3). On comprend alors l’importance majeure d’une prise en charge optimale en ville du patient en postinfarctus : elle doit inclure un bilan initial permettant de fixer le pronostic et une optimisation thérapeutique (médicaments, contrôle des facteurs de risque et éducation).
Bilan complémentaire après la sortie de l’hôpital
Lors de la prise en charge initiale en ville d’un patient en postinfarctus, il faut disposer de plusieurs examens(1-4).
Échocardiographie Doppler
Elle doit notamment évaluer la dilatation du ventricule gauche et l’altération de la fraction d’éjection ventriculaire gauche (FEVG).
En postinfarctus, une FEVG < 30 % et/ou un volume télésystolique > 130 ml sont des facteurs prédictifs indépendants de morbi-mortalité à long terme.
ECG d’effort
Il permet d’apprécier la capacité fonctionnelle, l’efficacité du traitement médical et le risque d’événements cardiaques. En l’absence de coronarographie, un test d’effort doit être réalisé précocement afin d’évaluer la présence et l’étendue d’une ischémie inductible. Différentes alternatives à l’ECG d’effort ont été proposées.
L’ECG d’effort peut être remplacé par une scintigraphie myocardique d’effort lorsque les anomalies ECG empêchent l’interprétation à l’effort (bloc de branche gauche ou pace-maker) ou par une échographie sous dobutamine lorsque l’ECG d’effort est impossible ou ininterprétable. La supériorité de l’échographie d’effort sur l’ECG d’effort classique après infarctus n’a pas été établie. Les tests d’effort doivent idéalement être réalisés après arrêt des bêtabloquants, le traitement devant être interrompu la veille de l’examen et repris juste au décours. Un test d’effort maximal et démaquillé négatif a une excellente valeur prédictive négative (taux d’événements cardiaques de 10 % à 1 an et de décès de 2 % à 6 mois) (tableau).
Échocardiographie de stress(5)
L’échographie de stress est utile pour le suivi du coronarien. Elle vient en complément de l’ECG d’effort, permettant une évaluation des patients incapables de réaliser un effort (échographie sous dobutamine) ou présentant un ECG non interprétable (bloc de branche gauche complet par exemple). Elle permet de préciser la topographie et l’extension de l’ischémie myocardique chez les patients revascularisés ou ayant fait un infarctus du myocarde. Enfin, il n’est probablement pas illicite de réaliser à titre systématique ce type de test chez le diabétique, ou de rechercher une aggravation à l’effort d’une fuite mitrale ischémique, marqueur de mortalité indépendant des paramètres classiques comme la FEVG.
Holter-ECG(6)
Il est utile chez les patients à risque élevé (FEVG < 40 %), l’existence de troubles du rythme ventriculaire complexes étant un marqueur du risque de mort subite. Le risque d’arythmie ventriculaire maligne est plus élevé durant la première année en postinfarctus.
Arythmies ventriculaires
La détection d’une arythmie ventriculaire fréquente ou complexe au Holter ECG en postinfarctus constitue un marqueur du risque de survenue d’arythmies ou de mort subite. La réduction significative de ces anomalies sous traitement médical a une valeur plus discutée. De nombreuses études menées en postinfarctus confirment que les extrasystoles ventriculaires fréquentes (> 10/h), répétitives ou complexes, ou les TV non soutenues, majorent de 2 à 3 fois le risque de mortalité globale et de 3 à 4 fois le risque de mort subite. Il s’agit d’un facteur de risque indépendant surajouté au risque lié à la baisse de la FEVG. Mais, lorsque la FEVG est conservée, il n’y a pas intérêt à faire disparaître significativement au Holter les arythmies ventriculaires par un traitement antiarythmique de classe IC, avec une surmortalité démontrée par l’étude CAST. Dès lors, la réalisation d’un Holter en postinfarctus n’est pas recommandée en routine en l’absence de dysfonction ventriculaire gauche.
Ischémie myocardique silencieuse
Il s’agit d’une manifestation très fréquente de la maladie coronaire représentant 70 à 80 % de la totalité des épisodes ischémiques sur le Holter-ECG. Elle constitue un facteur de mauvais pronostic aussi bien dans l’angor stable ou instable qu’en postinfarctus : en sa présence sur un Holter réalisé 8 jours après infarctus, la mortalité à 1 an est de 30 % (contre 11 % en l’absence d’ischémie silencieuse).
Variabilité sinusale
La variabilité sinusale (VRS) reflète l’équilibre du système nerveux autonome et peut être étudiée par Holter. Une analyse globale est réalisée par mesure de la déviation standard de l’ensemble des intervalles RR entre deux QRS normaux (SDNN). De plus, la déviation standard des intervalles RR en comparant des périodes moyennes de 5 min témoigne de l’état du tonus sympathique. L’analyse temporelle permet aussi d’apprécier l’état du tonus vagal par l’étude des cycles RR adjacents. En postinfarctus, une valeur de SDNN < 50 à 70 ms est un facteur indépendant de mortalité cardiovasculaire. La valeur prédictive positive de ce paramètre est comparable à celle de la FEVG pour prédire la mortalité globale et supérieure à celle-ci pour prédire la survenue de tachycardies ventriculaires (TV) et la mort subite.
Dynamique de la repolarisation
Si l’allongement de l’intervalle QT est un facteur de risque de mort subite, il est moins bien corrélé au risque rythmique en postinfarctus. Par contre, la dispersion de l’intervalle QT, qui témoigne des différences régionales des périodes réfractaires, est un bon facteur prédictif d’arythmies ventriculaires. Les sensibilité et spécificité d’une dispersion de 80 ms sont d’environ 65 et 85 % respectivement. La dispersion du QT augmente avec la taille de l’infarctus et avec l’altération de la FEVG en dessous de 40 %.
L’alternance de l’onde T peut permettre d’identifier des pa-tients à haut risque d’arythmies ventriculaires. Il s’agit de variations morphologiques dans la forme, l’amplitude ou la polarité de T, analysables par numérisation du signal ECG en activité normale ou lors d’un test d’effort. L’amplitude de l’alternance de l’onde T est définie par le produit de la durée et des épisodes d’alternance par l’amplitude de ses alternances ; la valeur prédictive positive la plus utilisée est > 550 µV.
Autres examens
Rechercher une arythmie
Le risque d’arythmies ventriculaires peut être évalué après infarctus par des tests incluant, outre le Holter, la recherche de potentiels tardifs, l’étude de la variabilité de la fréquence cardiaque, de l’alternance et/ou de la variabilité de l’onde T. Bien que la valeur prédictive négative de la plupart de ces tests pris isolément soit élevée (> 90 %), leur valeur prédictive positive est très faible (< 30 %) et, en raison de leur coût, ces tests ne sont pas actuellement recommandés en routine.
Potentiels tardifs ventriculaires(6)
La présence de potentiels tardifs ventriculaires (PT) témoigne de l’existence d’une zone de conduction lente à potentiel arythmique au niveau de la cicatrice de l’infarctus. La prévalence des PT après infarctus est de 25 à 35 %. Leur présence est influencée par la perméabilité de l’artère coronaire responsable de l’infarctus (6 à13 % si l’artère est perméable vs 26 à 40 % si elle est occluse).
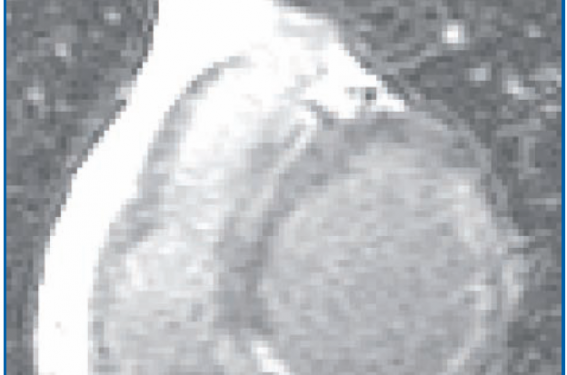
La période la plus appropriée d’enregistrement des PT se situe à la 2e semaine après infarctus. En présence de PTV, l’incidence des événements cardiaques (TV ou mort subite) est multiplié par 8 (1 vs 2 %). Si leur valeur prédictive négative est excellente, autour de 95 %, leur valeur prédictive positive est médiocre, de l’ordre de 20 %, mais peut être augmentée par l’association à d’autres marqueurs du risque, notamment la FEVG (figure 1).
Figure 1. Potentiels tardifs ventriculaires.
Viabilité
Environ un tiers des patients coronarien avec FEVG < 40 % peuvent améliorer leur fonction après revascularisation(7-9), témoignant de la présence de myocarde hibernant (non revascularisé en hypoperfusion chronique avec hypocontractilité). Cet état est défini a posteriori par la récupération de fonction contractile après revascularisation et sa détection a des conséquences pronostiques et thérapeutiques importantes.
Si l’on divise le ventricule gauche en 17 segments, 25 % des patients ont plus de 5 segments hibernants (soit environ 20 % de la masse ventriculaire), et 25 % moins de 4 segments. Dans le premier cas, la revascularisation a un impact favorable sur le pronostic vital, et, dans le second, un impact fonctionnel (amélioration de la FEVG et des symptômes)(10).
L’amélioration de FEVG après revascularisation des segments myocardiques hypo- ou akinétiques mais viables est notée dans près de 40 % des cas, parfois au-delà de la première année, d’amplitude moyenne de 8 %(10).
Plusieurs techniques d’imagerie sont utilisées pour la détection de la viabilité : tomographie à émission de positrons (TEP), tomoscintigraphie (SPECT), échocardiographie dobutamine, imagerie par résonance magnétique (IRM). Chacune explore des paramètres différents, reflets de la perfusion myocardique ou du métabolisme cellulaire. De manière générale, le TEP s’avère extrêmement sensible, tandis que les examens isotopiques paraissent moins spécifiques d’une récupération après revascularisation (figure 2).
Figure 2. Sensibilités (en bleu) et spécificités (en jaune) des examens d’imagerie pour prédire une récupération de fonction contractile après revascularisation (viabilité myocardique)(8).
Échocardiographie sous dobutamine
L’échocardiographie sous dobutamine à faible dose (10 à 15 g/ kg/min en IV) est actuellement la technique la plus utilisée (figure 3). La mise en évidence d’une réserve contractile prédit la récupération de fonction après revascularisation avec des sensibilité et spécificité de l’ordre de 80 %. La réponse biphasique – akinésie s’améliorant sous faible dose, puis qui voit sa contraction à nouveau se détériorer à forte dose – est la plus fiable pour prédire la récupération après revascularisation(7).
Figure 3. Échocardiographie dobutamine : réponses possibles du territoire infarci.
Échocardiographie de contraste myocardique(5,11)
L’échocardiographie de contraste émerge comme une technique non invasive prometteuse pour l’analyse de la perfusion myocardique. Elle permet l’étude de la viabilité myocardique : l’absence d’opacification d’un segment dysynergique est associée à une probabilité très faible de récupération fonctionnelle et, inversement, une opacification myocardique normale est en faveur d’une intégrité microvasculaire et d’une viabilité. L’association du contraste à un stress pharmacologique permet une analyse visuelle du contraste myocardique, l’ischémie correspondant à un défaut de perfusion locorégionale avec une bonne concordance diagnostique par rapport à la scintigraphie myocardique. Une approche quantitative de la perfusion est également possible en utilisant la technique de flash (impulsion de haute énergie détruisant des microbulles au sein du myocarde) suivie de l’étude de la réascension du signal myocardique permettant une approche du débit sanguin locorégional. En pratique, à l’heure actuelle, il n’y a pas de place en routine pour ce type d’examen en postinfarctus.
IRM
Les études évaluant l’IRM devraient s’imposer dans les années à venir. En IRM, une épaisseur pariétale < 6 mm est un indice assez sensible de l’existence d’une nécrose transmurale non susceptible de récupérer après revascularisation(10). L’IRM doit être couplée à une injection de gadolinium-DTPA avec clichés précoces (permettant l’accès à la perfusion myocardique) et suivie de l’étude du rehaussement tissulaire tardif (le gadolinium s’accumulant dans le tissu cicatriciel fibreux, permettant la visualisation de l’infarctus sous la forme d’une zone blanche). Enfin, l’extension transmurale de la fixation du gadolinium est importante, avec deux seuils à retenir(12) :
– < 25 % : infarctus peu transmural, myocarde viable ;
– > 75 % : peu de myocarde viable, revascularisation sans effet.
Une approche pragmatique de l’évaluation de la viabilité a été proposée par la filiale d’échocardiographie de la Société française de cardiologie (figure 4).
Figure 4. Schéma d’évaluation de la viabilité.
IRM de stress(13)
L’IRM de stress est réalisée en 30 à 40 mn en une seule séance dans les mêmes conditions de sécurité que l’ECG d’effort. L’IRM cardiaque peut permettre de mettre en évidence une ischémie myocardique lors d’un test de provocation. Elle permet dans un premier temps l’étude de la perfusion myocardique sous drogue (adénosine ou dipyridamole)(13 [p. 503]), en se basant sur la distribution myocardique d’un produit non iodé, le gadolinium, injecté par voie veineuse. L’existence d’un défaut de perfusion (hyposignal) a une sensibilité et une spécificité équivalente à la tomographie par émission de positons pour le diagnostic de l’insuffisance coronaire.
Les clichés tardifs (10 min après injection de gadolinium) permettent de détecter l’accumulation de gadolinium dans les zones de fibrose postinfarctus et ainsi de quantifier l’extension transmurale de l’infarctus (figure 5). Une faible extension transmurale d’un territoire akinétique est corrélée à la présence d’une viabilité myocardique avec forte probabilité de récupération de contractilité après revascularisation coronaire.
Figure 5. Rehaussement tardif en IRM gadolinium (la zone infarcie sous endocardique apparaît en blanc).
L’étude de la fonction contractile segmentaire ventriculaire gauche par ciné-IRM sous dobutamine est validée pour la détection d’une ischémie myocardique par comparaison à la scintigraphie de stress. Le protocole complet est réalisable dans des conditions de sécurité équivalente à celle de l’échographie (dobutamine 40-50 g/ kg/min, avec injection éventuelle d’atropine pour atteindre plus de 85 % de la fréquence maximale théorique). La supériorité de l’IRM tient essentiellement à la meilleure détection des contours endocardiques et à la meilleure reproductibilité de l’analyse de la fonction ventriculaire. La valeur pronostique d’une IRM de stress négative est établie avec un taux d’événements cardiovasculaires faible au cours du suivi ou pour la stratification du risque opératoire en cas de chirurgie non cardiaque. Les performances peuvent être encore améliorées par quantification de l’épaississement myocardique segmentaire ou en utilisant le marquage myocardique (tagging).
Le flux dans les artères coronaires peut être mesuré par la technique de contraste de phase à l’état de base et sous adénosine pour calculer la réserve coronaire. Ces techniques de contraste de phase peuvent identifier les sténoses serrées de l’IVA proximale avec une sensibilité de 100 % et une spécificité de 83 %.
Évaluer le pronostic à moyen terme
Les patients doivent être classés en 3 catégories de risque(1):
- risque élevé : mortalité > 10 % à 1 an ;
- risque intermédiaire : mortalité 5 à 10 % à 1 an (patient > 55 ans, insuffisance cardiaque en phase hospitalière, facteurs de risque multiples) ;
- risque faible : mortalité < 5 % à 1 an (patient < 55 ans, premier infarctus, FEVG normale ou peu altérée, absence d’ischémie résiduelle et de co-morbidités, correction des facteurs de risque).
Facteurs pronostiques péjoratifs en postinfarctus(1)
– Âge > 70 ans
– Sexe féminin
– Antécédent(s) d’infarctus du myocarde
– Siège antérieur de l’infarctus
– Insuffisance cardiaque gauche à la phase aiguë et/ou persistante
–Sténoses coronaires pluritronculaires et/ou atteintes de l’IVA ou du tronc commun
– Angor ou ischémie d’effort résiduels
– FEVG < 40 % et/ou dilatation marquée du ventricule gauche (en échographie)
– Arythmies ventriculaires complexes au Holter-ECG
– Facteurs de risque non corrigés (tabac, diabète, hypercholestérolémie, HTA)
Stratification du risque de mort subite(14)
Pour augmenter la valeur prédictive positive de chacun des examens pris isolément, différentes associations de facteurs de risque évalués par méthodes non invasives ont été proposées en postinfarctus. Parmi l’ensemble des marqueurs, la FEVG paraît un élément majeur du pronostic avec une valeur seuil autour de 35 %.
Si la FEVG est > 35 %, la présence de TV non soutenues au Holter-ECG est associée à un risque faible de décès à 1 an (< 3 %) ; lorsqu’elles sont associées à la présence de PT et à une baisse de la VRS, le risque est intermédiaire (3 à 10 %). Les TV soutenues ont un pronostic plus défavorable, d’autant qu’elles sont mal tolérées ou inductibles sous antiarythmique.
Si la FEVG est ≤ à 35 %, la mortalité annuelle varie de 7 à 10. Si ce paramètre est associé à la présence de TV non soutenues, l’incidence de la mort subite cardiaque est élevée (14 à 17 %). En cas de TV soutenues, le risque de mortalité est très élevé (> 50 %)(6 [p. 474]).
Optimiser la prise en charge
Le sevrage tabagique, le contrôle de l’HTA et du diabète et l’utilisation des bêtabloquants, de l’aspirine, des statines et des IEC (association « BASIC ») sont les paramètres clés de la prévention secondaire en postinfarctus.
Recommandations de prévention secondaire après infarctus du myocarde(1-4)
Tabagisme
• Objectif : sevrage complet.
• Interventions :
– évaluer l’intensité du tabagisme ;
– encourager le patient et la famille à arrêter de fumer ;
– conseiller sur les thérapeutiques de soutien au sevrage : substituts nicotiniques, médicaments ou programmes appropriés.
Contrôle tensionnel
• Objectif : PA < 140/90 mmHg (130/80 mmHg si insuffisance rénale chronique ou diabète).
• Interventions :
– si PA ≥ 120/80 mmHg, modifications de style de vie : contrôle pondéral, activité physique, consommation modérée d’alcool, restriction sodée modérée, privilégier fruits, légumes et produits laitiers pauvres en graisses ;
– si PA ≥ 140/90 mmHg (130/80 mmHg si insuffisance rénale chronique ou diabète) : instaurer un traitement antihypertenseur avec une préférence pour les bêtabloquants et les inhibiteurs du système rénine angiotensine aldostérone.
Profil lipidique
• Si triglycérides < 200 mg/dl
– Instaurer un régime approprié chez tous les patients (graisses saturées < 7 % des calories totales et cholestérol < 200 mg/j).
– Favoriser l’activité physique et le contrôle pondéral .
– Encourager la consommation d’acide gras oméga 3.
• Objectif : LDL cholestérol < 100 mg/dl.
• Interventions :
– statine, en général introduite dans les 24 h après l’infarctus ;
– si LDL < 100 mg/dl, poursuivre les statines ;
– si LDL ≥ 100 mg/dl sous traitement, intensifier la thérapeutique en donnant la préférence aux statines.
• Si triglycérides ≥ 200 mg/ dl
• Objectif : Non-HDL cholestérol* < 130 mg/dl
• Interventions :
– si triglycérides = 200-500 mg/dl : après traitement par statine, considérer l’adjonction d’un fibrate ou d’acide nicotinique ;
– si triglycérides ≥ 500 mg/dl : considérer en première intention fibrate ou acide nicotinique avant statine, et envisager l’adjonction d’acide gras oméga 3.
Activité physique
• Objectif : Activité physique minimale = 30 min/j, 3 à 4 fois par semaine, et si possible tous les jours.
• Interventions :
– évaluer le risque par test d’effort pour guider la prescription ;
– encourager au minimum 30 à 60 min/j d’activité, de préférence tous les jours, au moins 3 à 4 fois/semaine (marche, jogging, cyclisme ou activités en aérobiose) complétées par une augmentation des activités quotidiennes ;
– les programmes de réadaptation à l’effort sont recommandés en postinfarctus, particulièrement en cas de facteurs de risque modifiables multiples et/ou en cas de risque modéré à élevé.
Contrôle pondéral
• Objectifs : IMC entre 18,5 et 24,9 kg/m2. Une perte de poids initiale de 10 % du poids corporel sur 6 mois est la cible recommandée ; la perte de poids devrait être de l’ordre de 0,5 à 1 kg par semaine.
– Périmètre abdominal : chez la femme < 88 cm ; chez l’homme < 102 cm.
• Interventions :
– calculer l’IMC et mesurer la circonférence abdominale ;
– monitorer la réponse de ces paramètres aux modifications d’hygiène de vie ;
– démarrer le contrôle du poids et l’activité physique dès que possible ;
– si le périmètre abdominal est anormal, traiter le syndrome métabolique.
Diabète
• Objectif : HbA1c < 7 %.
• Interventions :
– thérapeutique hypoglycémiante appropriée ;
– traiter les autres facteurs de risque (exercice, poids, HTA et cholestérol).
Traitements
• Antiagrégants et anticoagulants
• Interventions :
– continuer indéfiniment l’aspirine (75 à 162 mg/j) sauf contre-indication ;
– envisager le clopidogrel (75 mg/j) si l’aspirine est contre-indiquée.
• Bloqueurs du système rénine-angiotensine-aldostérone
• Interventions :
– IEC chez tous les patients, indéfiniment, instaurés précocement si haut risque (infarctus antérieur, récidive d’infarctus, classe Killip ≥ 2, FEVG < 40 %) ;
– antagoniste des récepteurs de l’angiotensine (ARAII) si intolérance aux IEC et signes cliniques ou radiologiques d’insuffisance cardiaque ou FEVG < 40 % ;
– antialdostérone en l’absence de dysfonction rénale ou d’hyperkaliémie*, si dose thérapeutique d’IEC, FEVG ≤ 40 %, diabétique ou insuffisant cardiaque.
• Bêtabloquants
• Intervention : pour tous les patients et indéfiniment, sauf contre-indications.
* Non-HDL cholestérol : cholestérol total – HDL cholestérol ; dysfonction rénale chronique : créatinine > 2,5 mg/dl chez l’homme ou 2 mg/dl chez la femme ; la kaliémie doit être < 5 meq/l.
Médicaments indiqués
Bêtabloquants
Les bêtabloquants doivent être débutés dans les premiers jours suivant l’infarctus, et poursuivis au-delà de la première année, sauf contre-indication (avec dans ce cas une préférence pour le vérapamil) ou, éventuellement en cas de risque faible (FEVG normale, reperfusion coronaire, absence d’arythmie).
Les contre-indications doivent être limitées au maximum, même chez le sujet âgé. La thérapeutique doit être poursuivie au moins 2 à 3 ans, mais le traitement lorsqu’il est bien toléré est le plus souvent poursuivi plus longtemps.
Statines
La prescription doit être systématique quel que soit le taux de LDL, et les doses ajustées pour obtenir un LDL < 1 g/l (2,6 mmol/l)(15). Pour certains patients en prévention secondaire, des données récentes seraient en faveur d’un objectif plus bas (0,7 g/l), mais le rapport bénéfice sur risque de cette stratégie intensive reste à évaluer précisément car l’utilisation de fortes doses de statines est associée à un risque musculaire et/ou hépatique plus important.
L’efficacité démontrée des statines ne justifie pas l’abstention thérapeutique sur le seul argument d’un âge avancé. Les transaminases doivent être dosées au moins une fois dans les 3 mois qui suivent l’instauration du traitement, avec, si ce taux est normal, un contrôle annuel en l’absence de symptômes. L’arrêt du traitement est justifié devant une augmentation persistante (contrôlée à 1 mois) des transaminases au-delà de 3 fois la normale. Tout symptôme musculaire inexpliqué apparaissant sous traitement doit faire pratiquer un dosage de CPK, mais la surveillance systématique des CPK n’a pas d’intérêt démontré.
IEC
Un traitement par IEC au long cours doit être proposé à tous les patients ayant présenté une insuffisance cardiaque clinique ou avec FEVG < 40 %. En cas d’intolérance aux IEC, les ARAII peuvent être utilisés. Plus récemment, l’étude HOPE a apporté des arguments en faveur d’une systématisation des indications des IEC en postinfarctus, en particulier chez le diabétique. Chez le coronarien stable tout-venant, l'étude EUROPA a montré aussi que la prescription systématique d’un IEC en sus du traitement optimal réduit les décès cardiovasculaires, les infarctus du myocarde et les arrêts cardiaques avec une réduction associée du risque d'insuffisance cardiaque.
Autres médicaments
Il n’y a pas d’indication aux dihydropyridines à durée d’action courte, mais les antagonistes calciques peuvent être utilisés en cas d’angor résiduel ou d’HTA.
La prescription systématique de dérivés nitrés n’est pas recommandée, mais peut être licite en cas d’angor.
L’usage des antivitamines K au long cours se limite en général aux patients ne pouvant pas prendre d’antiagrégants plaquettaires, ou ceux avec fibrillation auriculaire, anévrisme et/ou thrombus intraventriculaire, voire dysfonction ventriculaire gauche systolique très sévère.
L’ibuprofène peut limiter les effets cardioprotecteurs de l’aspirine, et sa co-prescription chez le coronarien est déconseillée.
Les thiazolidinediones ne doivent pas être utilisées chez les patients diabétiques après infarctus en classe III ou IV de la NYHA.
Les vitamines antioxydantes E et C ne devraient pas être prescrites à titre de prévention secondaire.
Hormis les bêtabloquants, aucun antiarythmique ne possède d’effet majeur de réduction de la mortalité après infarctus. L’amiodarone est la molécule la plus efficace, mais la réduction du risque de mort subite sous amiodarone n’est significative que chez les patients traités par bêtabloquants.
Facteurs de risque
L’activité physique, la réduction pondérale, la modification des habitudes alimentaires, la prise en charge du stress et de l’arrêt du tabac contribuent à améliorer le profil lipidique. Le régime « méditerranéen » (riche en pain, fruits et légumes, poissons, huile d’olive et pauvre en viande autre que la volaille) doit être conseillé dans tous les cas.
L’arrêt du tabagisme est essentiel, mais un tiers à la moitié des patients récidive dans les 6 à 12 mois. L’utilisation précoce de substituts nicotiniques est une aide importante qui a prouvé son efficacité sans risque cardiovasculaire notable, même chez le coronarien, dans le cadre d’une prise en charge globale (soutien psychologique, accompagnement, prise en compte de l’exogènose ou d’un état anxiodépressif associé qui aggrave le pronostic).
Éducation
Avant la sortie d’hôpital, tous les patients en postinfarctus devraient être éduqués et activement impliqués dans un programme d’adhérence aux modifications d’hygiène de vie et à la thérapeutique ciblée sur la prévention secondaire.
Principes d’éducation du patient en postinfarctus(3)
• Évaluer la compréhension que le patient a de son état et de sa prise en charge ;
• Persuader le patient en se basant sur des démonstrations épidémiologiques ;
• S’aider d’autres professionnels de santé : diabétologues, cardiologues, infirmières, kinésithérapeutes, nutritionnistes, pharmaciens, etc. ;
• Utiliser un support éducationnel combinant matériel écrit et audiovisuel, instructions orales et approche en groupe ;
• Établir en collaboration avec le patient un plan d’action de prise en charge, en fonction du statut socioprofessionnel et économique, du niveau d’éducation, du souhait de
changement et des barrières de langage. Il peut être contreproductif de tenter de modifier en même temps plusieurs habitudes de vie comme le tabagisme, le régime ou l’exercice physique.
• Impliquer les membres de la famille dans les efforts d’éducation (repas, sevrage tabagique, réduction pondérale, activité physique) ;
• Répéter et renforcer les conseils à intervalles réguliers, et ne pas omettre de féliciter le patient pour les progrès obtenus même lorsque les buts ne sont pas totalement atteints.
Ainsi, un patient qui a réduit son tabagisme de 2 paquets à 1 paquet/j n’est pas à l’objectif thérapeutique mais atteint un palier majeur dans la voie vers le sevrage complet.
Suivi à long terme
Recommandations de suivi médical en postinfarctus(1-4)
• Visites de suivi à la recherche de symptômes et pour classifier la gène fonctionnelle.
• Réévaluer les médications et titrations des IEC, bêtabloquants et statines.
• Vérifier la FEVG et éventuellement faire un Holter-ECG si FEVG hospitalière < 40 % (afin d’envisager éventuellement la pose d’un défibrillateur).
• Insister sur les principes de prévention secondaire avec le patient et sa famille.
• Évaluer le statut psychosocial : dépression, anxiété, sommeil, etc.
• Discuter de l’activité physique, du retour au travail, de l’activité sexuelle, des voyages (conduite, voyages aériens).
• Mettre à disposition des patients et familles les adresses de structures d’éducation aux méthodes de réanimation cardiorespiratoire.
• Discuter avec les patients et leurs familles du risque de récidive, des symptômes d’infarctus, de la nécessité d’appeler le 15 si les symptômes persistent ou s’aggravent après 5 minutes.
Activité physique
La réadaptation à l’effort permet de mieux préciser les capacités et réduit la mortalité d’environ 20 %. En ce qui concerne l’activité physique ultérieure, l’intensité conseillée est celle qui s’accompagne d’une augmentation de fréquence correspondant à 60-75 % de la fréquence maximale théorique. Il faut conseiller les sports d’endurance en aérobie, à une fréquence de 4 à 5 séances de 20-30 minutes environ par semaine (marche, vélo, natation, etc.).
Sexualité
Les problèmes sexuels touchent 50 à 75 % des patients en post-infarctus. Il faut évoquer systématiquement avec le patient la reprise de l’activité sexuelle. Chez les patients stables, l’activité sexuelle usuelle peut être reprise 7 à 10 jours après l’événement initial. Bien que le risque d’infarctus soit augmenté après un rapport sexuel, celui-ci n’exige pas une performance plus importante que la plupart des efforts de la vie quotidienne. Le sildénafil ou apparentés peuvent être utiles, à la condition de disposer d’un test d’effort négatif et de vérifier l’absence de prise de dérivés nitrés ou assimilés (sprays de trinitrine, y compris dans les 24 h qui suivent la prise, molsidomine, inhibiteurs des canaux potassiques, etc.). Il est préférable de débuter ce traitement par la dose la plus faible, après la 8e semaine, en l’absence d’angor résiduel ou troubles du rythme, si le test d’effort est négatif et en l’absence de dysfonction ventriculaire gauche marquée.
Reprise du travail
La reprise du travail, effective dans 50 à 70 % des cas selon les études, peut être rapide après infarctus non compliqué de petite taille, mais ne devrait pas se faire le plus souvent avant 3 semaines. Un reclassement professionnel peut s’avérer indispensable en cas d’infarctus étendu avec insuffisance cardiaque.
Traitement hormonal substitutif de la ménopause
Le THS œstrogèno-progestatif ne devrait pas être introduit en prévention secondaire chez les femmes ménopausées après infarctus. Les femmes déjà traitées sous THS au moment de l’infarctus devraient arrêter ce traitement. Cependant, lorsque le traitement a été débuté 1 à 2 ans avant l’événement et qu’il est souhaitable de le poursuivre en raison d’une pathologie liée à la ménopause, il faut tenir compte du ratio bénéfice/risque d’un tel traitement.
Dépression
La dépression est fréquente après infarctus (50 % des cas), majeure dans 20 % des cas. Elle est un facteur prédictif indépendant de mortalité. Sa prise en charge par les thérapeutiques comportementales ou les inhibiteurs du recaptage de la sérotonine améliore les symptômes dépressifs dans l’année qui suit la sortie de l’hôpital. Il apparaît prudent d’évaluer les patients avant la sortie de l’hôpital et au 1er mois, et de les réévaluer tous les ans jusqu’à la 5e année si nécessaire.
Conduite automobile
Elle peut être reprise une semaine après la sortie de l’hôpital, 2-3 semaines après résolution des symptômes en cas d’infarctus compliqué.
Antiagrégants plaquettaires
La prévention des thromboses de stent est fondée sur une association clopidogrel et aspirine pour au moins 1 mois après stent nu, 3 mois après stent au sirolimus et 6 mois après stent au paclitaxel, et, idéalement, jusqu’à 12 mois en cas de stent actif s’il n’y a pas de risque élevé de saignement(16). La thromboses de stent, événement souvent catastrophique, survient le plus souvent dans le 1er mois, mais des thromboses tardives ont été décrites des mois ou années après implantation. L’arrêt de l’association antiagrégante multiplie par 161 le risque de thrombose de stent dans le 1er mois et 50 par la suite. La plupart des procédures ayant amené à l’arrêt du traitement (chirurgie mineure, détartrage ou extraction dentaires) peut être effectuées avec un risque faiblement majoré de saignement ou retardées jusqu’à l’arrêt complet de l’association.
Bilan à 6 mois
Le bilan à 6 mois est capital et doit inclure les questions suivantes : Respectez-vous toujours les règles alimentaires ? Le sevrage tabagique est-il maintenu ? Avez-vous une activité physique régulière ? La perte de poids est-elle maintenue ? La glycémie reste-t-elle normale avec un LDL < 1 g/l ? Les traitements sont-ils régulièrement pris ? Il faut disposer d’un test d’effort entre 3 et 6 mois à la recherche d’une resténose coronaire lorsqu’une angioplastie a été réalisée en phase aiguë.
Bilan à 1 an
Il devrait inclure une évaluation des facteurs de risque et de l’activité physique, une exploration d’une anomalie lipidique, le dépistage des lésions artérielles non coronaires (carotides), un ECG d’effort et une échocardiographie systématiques, une réévaluation thérapeutique si le patient est à faible risque.
Pour conclure
Ainsi faut-il régulièrement réévaluer nos patients coronariens même en l’absence de symptômes pour prescrire le traitement le mieux adapté en fonction du bilan et selon les recommandations.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :