Cas clinique
Publié le 09 fév 2024Lecture 7 min
La non-compaction du VG : une cardiomyopathie à part entière ou une réponse adaptative du myocarde ?
Laura BACIULESCU, cardiologue, CH d’Agen
Je vois en consultation de suivi Mme X, âgée de 72 ans, à qui j’ai découvert de façon fortuite, il y a un mois, devant un BNP élevé et un BBGC, une cardiomyopathie dilatée hypokinétique, FEVG à 25 %, de type non-compaction du VG. La patiente a eu une coronarographie de contrôle en juin 2023, qui retrouve des artères sans aucune lésion athéromateuse. Une IRM cardiaque au gadolinium sera réalisée en août. Le BBG est connu depuis l’âge de 24 ans, mais sans altérations de la FEVG jusqu’alors. Elle avait bénéficié d’une échographie de stress au Dobutrex® en 2002 négative pour ischémie myocardique, échographie cardiaque en 2003 : normale à part une dyskinésie septale sur bloc de branche gauche ; coronarographie réalisée en 2014 normale. Il existe des morts subites dans sa famille notamment chez un frère à 31 ans, un autre frère à 39 ans, son père décédé à 49 ans, mais dans un contexte d’hypercholestérolémie familiale et donc de possible cardiopathie ischémique.
Antécédents : anneau gastrique en 2011, syndrome de Raynaud, hémithyroïdectomie en 1995 sur nodule, hépatite B guérie, cataracte congénitale athéromateuse carotidienne et fémorale sans sténoses significatives
Facteurs de risque CV : tabagisme sevré, hérédité coronarienne, hypercholestérolémie familiale
Ethnie : caucasienne
Profession : IDE retraitée
Activités : jardinage, marche
La patiente ne rapporte pas de dyspnée d’effort (NYHA I), pas de tachycardie ni de lipothymie/syncope. Tension artérielle à 144/90 mmHg. Actuellement, elle prend comme traitement seulement Tahor® 40 mg, l’Aldactone® 25 mg et l’Eliquis® 5 mg deux fois par jour. Le bêtabloquant a été arrêté en raison d’un syndrome de Raynaud sévère et l’Entresto® et le Forxiga® n’ont pas été pris par peur d’effets indésirables.
Biologie : le NT-proBNP est à 1 360 pg/mL, la troponine T est à 74 ng/L et le DFG à 73 mL/min/1,73 m². Absence de carence martiale ou des maladies auto-immunes ou de myopathie.
L’ECG inscrit un rythme sinusal à 73/min, PR à 154 ms, bloc de branche gauche complet avec des QRS à 150 ms, axe QRS a -61, troubles de la repolarisation secondaires.
Holter ECG : absence de trouble conductif ou d’arythmie significative tant à l’étage atrial que ventriculaire.
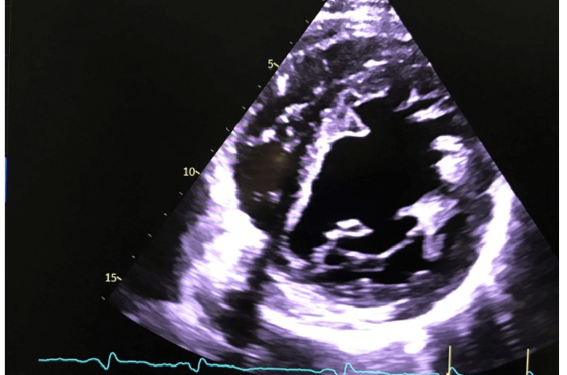
L’échographie cardiaque retrouve un ventricule gauche à 67 mm (60 mm lors de la dernière échographie), asynchronisme, fraction d’éjection à 31 % en SB, aspect de non-compaction apicale et latérale et de la paroi antéroapicale, SGL-9 ; IM grade I sur dilatation de l’anneau, oreillette gauche dilatée (volume 40 ml/m²sc), PAPS estimée à 46 mmHg, cavités droites de taille normale, veine cave inférieure 17 mm, compliante, bonne fonction systolique VD, HVD à 6 mm, profil mitral, troubles de la relaxation avec E/E' à 5 donc pressions gauches normales, IA légère, aorte non dilatée, péricarde sec.
Le strain longitudinal des segments hypertrabéculés est meilleur que le strain de parois compactées.
Je lui débute un traitement par Entresto® 24/26 mg matin et soir et du Carvedilol® 3 125 deux fois par jour (action vasodilatatrice associée, avec meilleure tolérance, surtout dans un contexte de syndrome de Raynaud). À noter que sous Entresto®, nous pouvons toujours faire le suivi de l’insuffisance cardiaque sur le plan biologique par le dosage du NT-proBNP.
Il est recommandé de faire effectuer un électrocardiogramme et une échocardiographie aux apparentés au premier degré.
D’un point de vue génétique, la patiente a bénéficié de la réalisation d’un test sanguin au CHU de Bordeaux pour analyses moléculaires à la recherche d’un variant génétique sarcomérique pathogène (panel de 72 gènes responsables de CMD et NCVG), avec résultats en attente (délais jusqu’à 12 mois).
Si la fraction d’éjection du VG restera toujours en dessous 35 % trois mois après l’optimisation du traitement médical, elle devrait bénéficier de l’implantation d’un CRT-D (resynchronisation cardiaque-défibrillateur), pour la prévention de la mort subite et de l’asynchronisme dû au BBGC, surtout vu l’historique des multiples morts subites dans la famille et la faible tolérance aux bêta-bloquants (en raison du syndrome de Raynaud).
Le sport en compétition, les activités physiques d’intensité modérée à importante, y compris en activité de loisir, le port de charges lourdes (plus de 10-15 kg), les activités en hauteur ou en altitude, sous l’eau (dont la plongée en bouteilles), les accélérations et décélérations brutales, les fortes variations de température sont contre-indiquées/à éviter le plus possible.
La trabéculation excessive du VG, désigné comme myocarde non compacté, est décrite à tout âge, du fœtus à l’adulte. Les études les plus récentes ne confirment pas la formation du myocarde compacté du myocarde non compacté ni l’arrêt de ce processus pour aboutir à la non-compaction du VG. La trabéculation excessive du VG est observée fréquemment chez des patients en bonne santé, ou pendant la grossesse (les femmes d’origine africaine développent 3 fois plus ce phénotype que les femmes caucasiennes, avec un phénotype réversible) ou chez les athlètes.
Les adultes à qui on découvre de façon incidentaire (ou accidentelle) une hypertrabéculation du VG ne nécessitent pas la plupart du temps un suivi au long cours dû à l’hypertrabéculation seule.
La trabéculation excessive du VG est aussi associée avec des cardiomyopathies dilatées, des CMP hypertrophiques, CMP restrictives, la dysplasie arythmogène du VD ou des malformations cardiaques congénitales (malformation d’Ebstein, situs solitus-hétérotaxie, valve aortique bicuspide, anomalies des artères carotides, etc.). Il y a des associations décrites avec le syndrome Wolff Parkinson White et bradycardie dans la population pédiatrique.
Les patients avec cardiomyopathie et hypertrabéculation sont pris en charge en fonction des leurs symptômes cardiovasculaires et pas en fonction du phénotype hypertrabéculé et le traitement doit suivre les recommandations générales pour l’insuffisance cardiaque. Le test génétique est recommandé pour les patients et les apparentes du premier degré.
Chez les enfants, en période néonatale et plus tard, la trabéculation excessive du VG est observée dans plusieurs maladies neuromusculaires comme la dystrophie musculaire Duchenne et Becker, le syndrome Barth, maladies mitochondriales, dystrophie myotonique, déficience de myoadenylate deaminase et plusieurs autres maladies neuromusculaires et génétiques rares.
Dans les désordres neuromusculaires, on a mis en évidence une augmentation progressive de l’épaisseur du myocarde trabéculé en parallèle avec une diminution du myocarde compacté, suggestive d’une cardiomyopathie caractérisée par un cytosquelette fragile évoluant vers l’altération progressive de la fonction systolique VG et le remodelage compensatoire du myocarde trabéculé.
Chez les nouveau-nés, enfants et adolescents, la découverte d’une non-compaction du VG doit amener à des investigations extensives, car il y a une fréquence élevée de la mort subite et des cardiopathies congénitales associées. La non-compaction du VG est considérée comme un type distinct de cardiomyopathie dans la population pédiatrique.
La trabéculation excessive est aussi décrite chez les patients avec des maladies hématologiques (hémoglobinopathies comme la bêta thalassémie), dans la dysfonction cardiaque à la suite de la chimiothérapie ou associée à la maladie rénale polykystique.
Ces données suggèrent une susceptibilité génétique de la réponse adaptative du myocarde à la surcharge de pression et/ou de volume, à l’augmentation de la pré et/ou de la post-charge VG.
Les critères diagnostiques les plus utilisés sont celles de Jenni et coll. : rapport maximal myocarde non compacté sur myocarde compact plus de 2 en télésystole en coupe parasternal axe courte en échocardiographie, avec l’implication des segments moyens et apicaux (surtout latéral et inférieur) et la présence du flux sanguin visible dans les lacunes et les trabéculations par Doppler couleur.
Les critères IRM sont un rapport myocarde non compacté/myocarde compact de 2,3 en télédiastole dans la coupe axe longue ou si la masse du myocarde trabéculé dépasse 20 % de la masse totale du VG. L’IRM cardiaque a une importance majeure pour la stratification du risque et du pronostic par la détection de la fibrose intramyocardique ou des thrombus.
La présentation clinique peut varier beaucoup, du stade asymptomatique aux manifestations de l’insuffisance cardiaque, arythmies parfois fatales ou accidents thromboemboliques (ischémie mésentérique, embolie pulmonaire, AVC ischémiques).
La stratégie optimale pour la prévention des accidents cardio-emboliques n’est pas encore élucidée. Il y a des études qui recommandent l’utilisation prophylactique des anticoagulants comme la warfarine pour tous les patients diagnostiques avec cardiomyopathie type NCVG, car il y a beaucoup de cas de thrombus logés entre les trabéculations décrits dans la littérature.
Malgré cela, les guides actuels recommandent l’utilisation des anticoagulants que chez les patients avec FEVG réduite, à moins de 40 % et des antécédents de fibrillation atriale ou d’accidents cardio-emboliques. On doit utiliser l’IRM cardiaque (pour exclure un thrombus intracardiaque) et l’IRM cérébrale (à la recherche des AVC ischémiques silencieux) pour la stratification du risque cardio-embolique.
L’implantation d’un défibrillateur en prévention primaire doit être réalisée si FEVG < 36 % et classe NYHA II et III ou si présence des facteurs de risque additionnels : des morts subites dans la famille, de tachycardies ventriculaires non soutenus à l’Holter sur 24 heures ou une histoire de syncope.
En prévention secondaire, le défibrillateur implantable est recommandé en cas de tachycardie ventriculaire soutenue et chez les patients qui ont récupéré après un arrêt cardiaque.
Un CRT-D (resynchronisation cardiaque-défibrillateur) doit être implanté si FEVG < 36 %, classe NYHA II ou III malgré trois mois de traitement optimal et QRS élargis > 130 ms, idéalement avec un aspect de bloc de branche gauche complet (peu d’intérêt pour la resynchronisation si bloc de branche droit ou indifférencié et QRS entre 130 et 150 ms).
Le traitement optimal comprend les suivantes classes thérapeutiques, à la dose maximale tolérée ; bêtabloquants, IEC/sartan/ARNI, antialdostéroniques, gliflozines et diurétiques en fonction des symptômes. En derniers recours, il y a les systèmes d’assistance ventriculaire gauche et la transplantation cardiaque.
EN PRATIQUE
• La non-compaction du VG est considérée comme un type distinct de cardiomyopathie dans la population pédiatrique. Chez les nouveau-nés, enfants et adolescents, la découverte d’une non-compaction du VG doit amener à des investigations extensives, car il y a une fréquence élevée de la mort subite, des cardiopathies congénitales associées et des myopathies/dystrophies neuromusculaires.
• Chez les adultes, les données suggèrent une susceptibilité génétique de la réponse adaptative du myocarde à la surcharge de pression et/ou de volume, à l’augmentation de la pré- et/ou de la post-charge VG.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :