Publié le 14 nov 2016Lecture 7 min
De la cardiomyopathie hypertrophique à l’écho du sportif
C. VINCENT, Hôpital du Haut-Lévêque, CHU de Bordeaux, Pessac
Journées Écho Cardio Bordeaux
CMH : la classification de Maron revisitée
D’après N. Mansencal
La cardiomyopathie hypertrophique (CMH) doit être évoquée en cas d’épaisseur de paroi supérieure à 15 mm en absence d’antécédent familial de CMH et 13 mm en cas de suspicion de CMH familiale.
La classification de Maron :
- correspond à une étude morphologique de l’hypertrophie VG ;
- permet de différencier 4 types (type I : hypertrophie limitée à la partie antérieure du septum, type II : hypertrophie touchant tout le septum, type III : hypertrophie touchant tout le septum et une autre paroi du ventricule, type IV : autres soit une hypertrophie apicale, latérale ou postérieure) ;
- est aujourd’hui multimodale en échographie transthoracique, avec notamment le strain longitudinal global, et en IRM cardiaque.
Les formes limites et atypiques de CMH
D’après T. Le Tourneau
La pénétrance et l’expression clinique de la CMH sont très variables selon l’âge (seulement 55 % d’expression clinique < 30 ans, 75 % entre 30 et 50 ans) et selon le sexe (expression plus sévère chez l’homme). Il existe une grande hétérogénéité génétique avec une faible association génotype-phénotype : dans certains cas, le phénotype échographique peut se limiter à un trouble de la relaxation, à une dilatation de l’oreillette gauche ou à une élongation valvulaire mitrale.
Dans les formes atypiques de CMH, il existe :
- les formes très localisées correspondant au type IV de la classification de Maron avec les formes apicale et latérale, et notamment l’hypertrophie isolée du segment inféro-latéral basal avec prolapsus valvulaire mitral ;
- les formes avec anomalies de la valve mitrale (élongation des feuillets) et de l’appareil sous-valvulaire (anomalies des piliers) au premier plan générant une obstruction de repos ou d’effort ;
- les formes avec anévrisme apical ;
- les formes évoluant vers une cardiomyopathie hypokinétique (burned-out phase) correspondant à 5 % des patients avec pronostic très défavorable.
Les tests dynamiques dans la CMH
D’après P. Réant
Dans la CMH, l’obstruction intra-VG est un phénomène labile et dynamique. C’est pourquoi son évaluation en position semi-couchée au repos est insuffisante.
L’utilisation de la manœuvre de Valsalva a une sensibilité de 40 % pour prédire le gradient d’effort et est difficile à standardiser et à reproduire exactement.
Les tests pharmacologiques sont peu physiologiques.
L’évaluation de l’obstruction au repos peut être complétée en position debout : elle est intéressante du fait de la diminution de la précharge et de l’augmentation de la contractilité et du débit cardiaque.
Actuellement, c’est l’échocardiographie per-effort réalisée sur bicyclette ergonomique en position semi-couchée qui est recommandée pour évaluer l’obstruction intra-VG à l’effort.
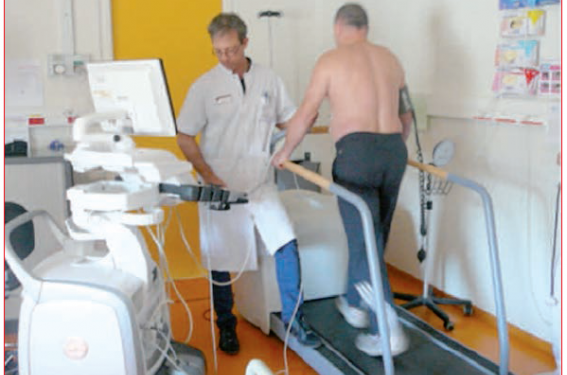
Cependant, l’hémodynamique globale de la CMH au repos et pendant l’effort dépend des conditions de charge, du débit cardiaque, et notamment de l’effet du retour veineux sur l’obstruction. En effet, le retour veineux (précharge) est augmenté en position couchée ou semicouchée, augmentant avec l’effort, et notamment par contraction des cuisses sur le vélo alors qu’il augmente moins chez le sujet en train de marcher. C’est pourquoi la réalisation d’une échocardiographie d’effort en position debout et sur tapis (figure) reproduit de manière plus physiologique les symptômes des activités quotidiennes. La faisabilité est de 90-95 %(1) mais nécessite une certaine expérience de l’opérateur.
Figure. Évaluation de l’obstruction à l’effort chez un patient suivi pour CMH sur tapis.
Hypertrophie cardiaque : diagnostics différentiels
D’après D. Mohty
Le principal diagnostic différentiel des CMH familiales sarcomériques est la cardiopathie hypertensive. Cependant, dans ce cas, l’hypertrophie est en général limitée (paroi < 13 mm). À noter le cas particulier du bourrelet septal sous-aortique du sujet âgé hypertendu de longue date qui peut mesurer 15 à 17 mm.
Les autres diagnostics différentiels sont plus rares mais à évoquer et à rechercher systématiquement :
- les cardiopathies « hypertrophiques » infiltratives : la cardiopathie amyloïde qui est la plus fréquente (sénile, héréditaire ou à chaînes légères), la sarcoïdose cardiaquemais aussi plus rarement la maladie de Gaucher et la maladie de Hurler ;
- les cardiopathies « hypertrophiques » de surcharge : la cardiopathie de Fabry, l’hémochromatose primitive ou secondaire.
L’approche diagnostique doit être multimodale avec l’ETT, les biomarqueurs, l’ECG, les signes extracardiaques, l’IRM cardiaque, la scintigraphie au Tc pour le type d’amylose et l’anatomopathologie.
Approche thérapeutique des CMH
Que disent les recommandations ?
D’après M.-C. Malergue
L’approche thérapeutique initiale est d’évaluer le niveau de risque hémodynamique lié à l’obstruction ventriculaire ainsi que le niveau de risque rythmique lié à la mort subite.
Prise en charge de l’obstruction intraventriculaire gauche… …
En cas de patient symptomatique avec gradient de repos > 50 mmHg ou après manœuvres de provocation (Valsalva, position assise ou debout) ou patients sans obstruction de repos mais apparaissant à l’effort et > 50 mmHg :
- en premier lieu, le traitement médical par bêtabloquants et par inhibiteurs calciques est indiqué en cas d’intolérance ou de contre-indication aux bêtabloquants ;
- en cas d’échec du traitement médical (inefficacité ou intolérance) chez un patient restant symptomatique, la myectomie sera discutée par alcoolisation septale ou par chirurgie, selon notamment les anomalies de la valve mitrale ou la présence d’une obstruction médioventriculaire ;
- la stimulation double chambre est actuellement recommandée avec un stade IIb pour diminuer le gradient d’obstruction ou faciliter le traitement médical (BB-, Ica) :
• en cas de CI à l’ablation septale ou à la myectomie ou à fort risque de développer un BAV après l’alcoolisation septale,
• chez les patients avec indication de défibrillateur ;
- chez un patient asymptomatique et sans obstruction, aucun traitement n’est à proposer, une surveillance annuelle par ETT est préconisée.
Prévention de la mort subite
En prévention secondaire, un défibrillateur est indiqué chez les patients ayant présenté un arrêt cardiaque récupéré par tachycardie (TV) ou fibrillation ventriculaire, une TV soutenue avec syncope et ayant une espérance de vie supérieure à un an.
En prévention primaire, l’évaluation du risque rythmique la plus récente est proposée par les recommandations ESC 2014 accessibles à l’adresse : http://doc 2do.com/hcm/webHCM.html. Il est composé des paramètres suivants : l’âge, l’épaisseur maximale pariétale, la taille de l’oreillette gauche, le gradient intraventriculaire, un antécédent familial de mort subite, une TVNS et une syncope inexpliquée. Ce score de risque ne prend pas en compte les patients de moins de 16 ans, les patients porteurs d’une CMH liée à un désordre métabolique ou en cas de syndrome malformatif. Un risque supérieur à 6 % est une indication à la pose d’un défibrillateur. Pour un risque inférieur à 4 %, le défibrillateur n’est pas indiqué. Pour un risque entre 4 et 6 %, le défibrillateur peut être considéré et dépend de l’avis d’une équipe spécialisée. Mais ce score ESC ne prend pas en compte la réponse anormale tensionnelle à l’effort, la présence d’un anévrisme apical, la présence d’un rehaussement tardif étendu à l’IRM et un SLG très abaissé, l’existence de doubles mutations pathogènes ou certaines mutations particulières.
Aucun algorithme ne peut remplacer le jugement clinique et l’évaluation du rapport bénéfice/risque chez un patient donné, en particulier dans les cas à risque intermédiaire.
Prise en charge de la fibrillation atriale
L’anticoagulation orale (par AVK ou AOD) s’impose pour tout patient en FA ou aux antécédents de FA. Le score CHA2DS2-VASc ne s’applique pas aux patients porteurs de CMH.
Le maintien en rythme sinusal est un objectif en cas de FA de survenue récente, avec recours à l’amiodarone ou au sotalol après cardioversion.
Les antiarythmiques de classe Ic (flécaïne) et la digoxine sont à éviter.
Pour le contrôle du rythme, préférer les bêtabloquants et inhibiteurs calciques (vérapamil ou diltiazem).
L’ablation par radiofréquence peut être proposée en prévention secondaire de la FA, notamment si elle est récurrente et les symptômes mal tolérés avec échec du traitement médicamenteux.
Approche multimodalités du coeur de l’athlète
D’après F. Carré
Le cœur d’athlète correspond à l’ensemble des adaptations cliniques, électrocardiographiques, morphologiques et fonctionnelles induites par la pratique d’une activité sportive intense (> 60 % VO2 max) et prolongée (au moins 8 h/semaine depuis plus de 6 mois).
La détection de pathologies cardiovasculaires chez l’athlète nécessite au moins en première intention un examen clinique et un électrocardiogramme.
Le rapport coût/bénéfice limite la place de l’imagerie systématique dans la population sportive à très faible risque.
Devant des anomalies ECG importantes (ondes T négatives par exemple) ou arythmies sévères, il faut savoir compléter un échocardiogramme normal par une IRM.
Chez les sportifs symptomatiques avec suspicion d’anomalies des coronaires, le scanner et l’IRM sont le choix de première intention.
Il existe actuellement peu de données sur l’échographie de stress pharmacologique et la place de l’échocardiogramme d’effort est mal précisée.
Une analyse multimodale est donc indispensable avant de conclure à l’intégrité du système cardiovasculaire de l’athlète.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :