Congrès et symposiums
Publié le 31 mai 2016Lecture 8 min
Les radicaux libres : mirages ou réalités en physiopathologie cardiovasculaire
L. ROCHETTE, Laboratoire de physiopathologie et pharmacologies cardio-métaboliques (LPPCM) Inserm UMR866, Université de Bourgogne Franche-Comté, Facultés des Sciences de Santé, Dijon
Le Printemps de la cardiologie
Le mirage (du latin miror, mirari ; s’étonner, découvrir avec étonnement) est un phénomène optique résultant de la déviation des faisceaux lumineux par des superpositions de couches d’air à des températures différentes. La déviation des rayons donne alors l’impression que l’élément que l’on observe est à un endroit différent de son réel emplacement. Les images associées à un mirage sont sujettes à interprétations, elles ne correspondent toutefois pas à une hallucination et peuvent être photographiées ; ce qui démontre leur vraie existence.
L’oxygène : source de la vie et à la base d’une biochimie « radicalaire »
L’approche de nos connaissances physicochimiques et physiopathologiques peut être intégrée à des notions complexes de l’identification et la quantification d’éléments qui appartiennent à des réalités chimiques. Les applications en biologie sont essentielles afin de mieux appréhender le vivant. Dans ce cadre, des éléments dits « chimiques » apparaissent comme essentiels ; ils vont interagir et évoluer pour structurer des molécules et mettre en place des organisations de plus en plus complexes. Une question qui a été récemment posée est liée de manière étonnante aux récentes découvertes apportées par la conquête spatiale : les comètes sont-elles à l’origine de la vie ? La mission récente sur la comète 67P/Churyumov- Gerasimenko est un événement exceptionnel. Grâce à l’atterrissage du module Philae le 12 novembre 2014 (lancement 10 ans auparavant) et à la sonde Rosetta, c’est la première fois que l’on détecte de l’oxygène moléculaire hors du globe terrestre(1). L’apparition de la vie sur terre et son évolution passent par les cyanobactéries ; productrices de dioxygène. Dans un environnement soumis à des rayonnements permanents, l’oxygène passe transitoirement sous des « formes activées » d’autant plus que des inducteurs de réaction en l’occurrence des métaux comme le fer existent. Apparaissent des éléments essentiels comme le carbone, l’azote, l’hydrogène ; au sein d’une chimie biologique évolutive où l’oxygène est en quelque sorte un chef d’orchestre.
Une vraie connaissance sur les propriétés et les fonctions de l’oxygène ne datent que du XVIIIe siècle. Découvert indépendamment en 1772 par le Suédois Carl Wilhelm Scheele et en 1774 par le britannique Joseph Priestley, l’oxygène a été nommé ainsi en 1777 par Antoine de Lavoisier à Paris à partir du grec oxys (« aigu », c’est-à-dire « acide »), et genês (« générateur »). La concentration importante de dioxygène associée aux éléments vivants est le résultat des cycles de l’oxygène et à son rôle essentiel dans les métabolismes intimes des cellules ; la production d’énergie cellulaire étant oxygènedépendant. On doit à des savants comme Louis Pasteur d’avoir su adapter les connaissances de la chimie de l’oxygène aux impératifs du vivant végétal, animal et/ou humain.
Espèces réactives de l’oxygène (ERO), de l’azote (ERN)… des radicaux libres !
Comment les identifier et les quantifier ?
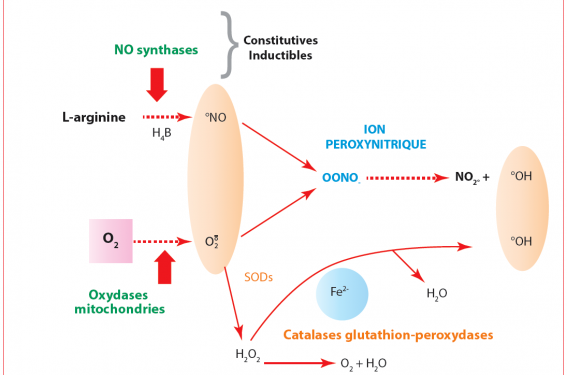
La définition d’un radical libre (RL) appartient au vocabulaire chimique ; on devrait dans une dénomination chimique exacte parler de radicaux ; en effet le qualificatif libre est presque un pléonasme. Il s’agit d’un atome ou d’une molécule qui possède un électron célibataire sur l’orbitale externe. L’oxygène est un biradical qui, acceptant un électron, devient l’anion superoxyde. Ces superoxydes sont produits par les réactions mitochondriales et les différentes oxydases (ex. NADPH oxydases). L’anion superoxyde, élément radicalaire, est à l’origine d’une cascade de réactions qui impliquent des inducteurs (métaux de transition : ex. fer, cuivre, etc.) mais aussi des enzymes aux fonctions bien définies : superoxydes dismutases (SODs) ; catalases ; glutathion peroxydases (GPX). Une mise en jeu coordonnée des réactions qui passent par un intermédiaire : l’eau oxygénée H2O2, conduit à la formation d’eau H2O mais aussi à une autre forme radicalaire l’hydroxyle : °OH (figure 1). Un point en exposant signe un composé radicalaire.
Figure 1. Schéma de la production des espèces radicalaires dérivées de l’oxygène et de l’azote.
Les classifications des dérivés activés de l’oxygène et de l’azote différencient les formes radicalaires des composés non radicalaires aux propriétés oxydantes. Ainsi H2O2 n’est pas un composé radicalaire mais oxydant. Pour les dérivés de l’azote ; la « révolution » est arrivée en 1986 lorsque Robert Furchgott (Prix Nobel 1998) a décrit les fonctions vasculaires de ce gaz radicalaire ; le monoxyde d’azote : °NO, produit par l’endothélium vasculaire et autres structures via les enzymes : NO synthases. Le °NO a d’ailleurs la possibilité de se fixer des éléments endogènes ; sa liaison à l’hémoglobine dans un complexe HbNO peut correspondre à une de ses formes de « stockage ». Un composé aux propriétés oxydantes majeures : le peroxynitrite OONO- résulte d’une réaction qui s’établit entre le superoxyde et le NO. Il est courant de lire que les radicaux libres sont « fugaces » ; ceci est vrai pour certains dérivés de l’oxygène : l’hydroxyle °OH aurait une demi-vie de la nanoseconde, quant au °NO, sa demivie est de l’ordre de la seconde (de 1 à 10 secondes). Il existe des formes radicalaires dérivées de composés endogènes ; ainsi la vitamine C peut exister sous forme de radical ascorbyle qui présente une relative stabilité. Ces données ne doivent être généralisées à l’ensemble des tissus et à tous les territoires intracellulaires. En effet, on doit tenir compte des compartiments intracellulaires qui n’ont pas forcément le même pH, la même pO2 ; ce qui conduit à des spécificités « territoriales » des métabolismes radicalaires(2). Si l’on prend pour exemple la mitochondrie qui transforme environ 5 % de l’oxygène moléculaire en anion superoxyde, son pH est de 8 au niveau de la matrice alors qu’il est voisin de 6 dans d’autres organites tel que l’appareil de Golgi, ce qui conduit à des réactions différentes au niveau de l’équilibre redox(3). Compte tenu de ces pH et des demi-vies différentes des espèces radicalaires, les zones de distribution de ces radicaux libres (RL) sont susceptibles de conduire à des superpositions, sources d’interférences spatiales et temporelles (ex. formation des peroxynitrites, interactions avec d’autres « médiateurs » : CO, H2S, etc.). Élément important à ne pas oublier dans ces processus, le rôle majeur que joue le fer dont l’homéostasie est sous la dépendance de multiples facteurs tels que les transporteurs du type transferrine ou hormonaux : hepcidine et érythroferrone(4).
Le stress oxydant est une réalité fondamentale et clinique parmi les autres stress : c’est un exemple de la « dynamique du vivant ».
La nature a su mettre en place dans notre évolution des « balances » entre les composés radicalaires aux propriétés oxydantes (susceptibles d’être des molécules de signalisation) et des défenses « antioxydantes » réparties judicieusement au niveau intracellulaire. La notion de stress oxydant découle de cette « balance » biologique où l’oxygène joue le rôle de dénominateur commun. Le rapport : oxydants/antioxydants règle bien souvent le devenir de la cellule vers un renouvellement ou une mort par apoptose.
Le terme antioxydant ne doit toutefois être accordé qu’à des substances qui, à l’état de trace, inhibe l’oxydation d’un substrat présent en concentration importante.
Les défenses naturelles vis-à-vis du stress oxydatif sont de type enzymatiques comme citées précédemment : SODs catalases, GPXs et non enzymatiques : vitamines A, C, E, acide folique, glutathion (couple oxydé/réduit), acide urique, bilirubine, hydrogène… Deux points doivent être notés à ce stade :
- 1) il apparaît essentiel d’aborder la biochimie de ces antioxydants par une approche dynamique en évoquant leurs taux de renouvellement d’où l’importance d’évaluer le rapport GSH/cystine dans les pathologies coronaires ;
- 2) l’interférence entre les vitamines antioxydantes : la vitamine C par un passage radicalaire (radical ascorbyle) permet la régénération de la vitamine E, indispensable à la protection des structures lipidiques membranaires.
L’identification et la quantification du stress oxydant sont possibles par des méthodes directes et indirectes. Ne pas oublier qu’un stress secondaire au stress radicalaire est le stress électrophile qui affecte les composés membranaires. La méthode de choix pour l’évaluation directe des RL est la résonance paramagnétique électronique (RPE)(6). Quant aux méthodes indirectes, elles sont nombreuses, souvent peu spécifiques, mais permettent d’approcher les niveaux d’oxydation de composés cibles des RL. De très nombreux travaux ont été publiés sur la participation du stress oxydatif et des RL, dans l’initiation, le développement des pathologies cardiovasculaires (hypertension, infarctus du myocarde, insuffisance cardiaque, diabètes, athérosclérose…)(7) ou des situations rencontrées en clinique (reperfusion coronaire, circulations extracorporelles(8)…). Les traitements mis en oeuvre dans ces pathologies ou lors des procédures de protections cardiaques en cardiologie interventionnelle ou chirurgie cardiaque ont pour objectif de réduire de manière directe et/ou indirecte les niveaux du stress oxydatif. L’inflammation inhérente à ces situations pathologiques est pourvoyeuse d’inductions radicalaires majeures. Dans ces pathologies les interférences entre formes activées de l’oxygène et de l’azote sont bien démontrées. Il existe des inhibiteurs endogènes circulants des NO synthases issus de protéolyses oxydatives qui peuvent être considérés comme des marqueurs circulants d’un stress oxydatif généralisé ; c’est le cas de l’inhibiteur des NO synthases : le dérivé asymétrique de l’arginine : l’ADMA(9-10).
La régénération tissulaire est-elle sous la dépendance de processus oxydatifs ?
Peut-on espérer rajeunir le cœur vieillissant ? Une voie prometteuse, celle du GDF11
Les mécanismes intimes associés au vieillissement sont multifactoriels avec des dommages de l’ADN, un raccourcissement des télomères, etc. Les progrès de la recherche ont permis de reconnaître le rôle important des facteurs génétiques, des altérations de la dynamique cellulaire et des systèmes de protection contre les processus oxydatifs. Il est bien connu que les cellules myocardiques ont de très faibles potentialités de se reproduire après la première semaine qui suit la naissance. L’exposition à l’oxygène atmosphérique stopperait la prolifération des cellules cardiaques. Une « révolution » récente dans nos concepts est liée aux travaux publiés en 2013 par Loffredo et Lee de l’Institut Harvard de Boston(11). Ils ont mis en œuvre des techniques de parabiose qui expérimentalement associent deux animaux (type siamois) ; cette technique avait été initialement décrite par le physiologiste français Paul Bert en 1862. Le groupe de l’Institut Harvard décrit que l’hypertrophie cardiaque de l’animal âgé peut être « réversée » en quelques semaines par le passage de sang de l’animal jeune vers l’animal âgé. Le composé de « réjuvénation » serait le GDF11, composé de la famille du transforming growth factor (TGF). Les concentrations plasmatiques du GDF11 diminueraient au cours de la vie et l’effet bénéfique du GDF11 pourrait être reproduit par injection. Une polémique s’est installée dans la communauté scientifique de la cardiologie fondamentale sur les propriétés du GDF11, dont les actions bénéfiques tissulaires s’étendraient à de nombreux organes subissant un vieillissement normal ou pathologique. Comment les RL pourraient participer à ce processus de réjuvénation ? Ils seraient nécessaires à l’activation du GDF11 qui préexiste sous une forme inactive liée à un complexe protéique. Sous l’impact des RL, le GDF11 libéré vient alors se fixer sur des récepteurs présents sur les cardiomyocytes et le processus de régénération serait alors initié(12). Une orientation vers la cardioprotection à l’aide des composés du type GDF11, lors des traitements par les anthracyclines et le trastuzumab(13), est une ouverture riche de potentialités sur le plan clinique(14).
En conclusion, la réjuvénation tissulaire n’est pas un mythe dont l’objectif serait de retrouver sa jeunesse, mais sur le plan physiopathologique, c’est un espoir qui sera, on l’espère, une réalité de demain.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :