Risque
Publié le 14 nov 2015Lecture 7 min
Insuffisance rénale chronique : quels facteurs de risque cardiovasculaires ?
F. ELLOUALI, J. ZARZUR, A. TAMDY, L. OUKERRAJ, M. CHERTI, Service de cardiologie B, CHU Ibn Sina, Université Mohammed V, Souissi, Rabat, Maroc
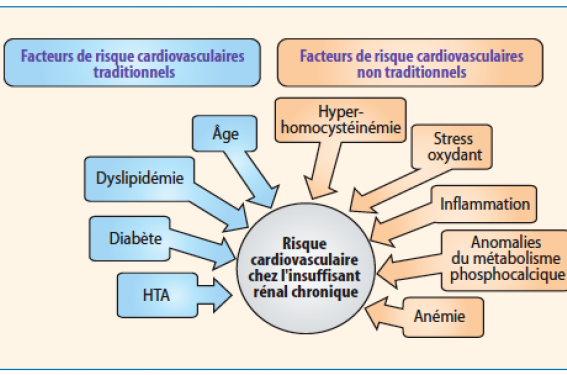
La particularité du profil de risque cardiovasculaire et la vulnérabilité artérielle accrue au cours de l’insuffisance rénale chronique est bien connue. Ce phénomène est attribué, non seulement à la fréquence accrue de facteurs de risque cardiovasculaires traditionnels, mais également à la présence de nombreuses comorbidités qui aggravent à eux seuls le risque cardiovasculaire. L’hyperhomocystéinémie, le stress oxydatif, l’inflammation et l’anémie font partie de ces facteurs. Des études épidémiologiques et interventionnelles explorent ce volet de la pathologie cardiovasculaire. Dans tous les cas et quel que soit le stade de l’urémie, la correction de ces facteurs constitue actuellement une composante primordiale de sa prise en charge.
Les complications cardiovasculaires représentent la première cause de mortalité chez le patient en insuffisance rénale chronique (IRC). L’existence d’un profil de risque particulier et d’une vulnérabilité artérielle accrue chez cette population est bien connue mais les facteurs de risque de ces événements ne sont pas complètement établis. L’insuffisance rénale chronique et les maladies cardiovasculaires, essentiellement la maladie coronaire, ont en commun plusieurs facteurs de risque tels que l’âge, le diabète sucré, l’hypertension et les dyslipidémies. Toutefois le débit de protéinurie, le stress oxydatif, les troubles minéraloosseux, l’anémie et l’état inflammatoire sont des comorbidités qui aggravent à elles seules le risque cardiovasculaire (RCV). Nous nous intéressons à cette catégorie de facteurs de risque car leur correction réduirait considérablement la mortalité cardiovasculaire(1).
Nous traiterons ici, de façon non exhaustive, un certain nombre des FDR non traditionnels et le moyen de palier leurs effets (figure).
L’hyperhomocystéinémie
L’hyperhomocystéinémie (HC) est fréquente au cours de l’insuffisance rénale chronique. Elle est corrélée au débit de filtration glomérulaire et à la créatininémie(2). Les séances de dialyse ne permettent pas son épuration. Plusieurs études ont montré qu’une augmentation de l’homocystéinémie était associée à un pronostic cardiovasculaire plus mauvais, dans la population d’IRC terminale(3-8).
Bien que sa responsabilité dans la genèse de l’athérosclérose et de ce fait dans le risque cardiovasculaire ne soit pas entièrement comprise, les études ont montré que des niveaux d’HC élevés peuvent faciliter des dommages oxydatifs au niveau de l’interface vasculaire(9-11), la prolifération des cellules musculaires lisses avec une augmentation de l’oxydation des lipoprotéines de faible densité(12) et une augmentation de l’agrégation plaquettaire favorisant un état prothrombotique(13,14).
Le stress oxydant
Plusieurs études ont montré que les marqueurs de stress oxydant étaient plus élevés chez le patient insuffisant rénal chronique(15,16). Même chez les patients en insuffisance rénale légère, le niveau de stress oxydatif est supérieur de façon significative par rapport à la population générale. En plus, le niveau de stress oxydatif s’intensifie au fur et à mesure que la fonction rénale se détériore(17).
Chez les patients en hémodialyse, il est lié à(18-22) :
- l’augmentation de taux de métaux comme le cuivre ;
- le défaut en cofacteurs antioxydants ;
- l’activation des leucocytes en rapport avec la bio-incompatibilité des membranes de dialyse ainsi qu’avec les contaminations éventuelles du liquide de dialyse ;
- la présence de toxines en rapport avec l’état urémique lui-même ;
- les infections aiguës ou chroniques ;
- les restrictions alimentaires et la malnutrition qui s’en suit.
En parallèle, certaines équipes ont prouvé que la dialyse permet d’éliminer les moyennes molécules et d’autres produits finaux d’oxydation, ce qui a pour effet une amélioration globale de la fonction endothéliale et du stress oxydatif(23-25).
Plusieurs thérapeutiques ont été utilisées pour réduire le stress oxydatif.
Deux études interventionnelles (l’étude SPACE testant la vitamine E et l’étude NAC testant la N-acétyl-cystéine) ont pu démontrer une efficacité dans la protection cardiovasculaire chez les patients HD(26,27). Mais cette protection ne peut pas être formellement attribuée à leurs effets antioxydants (les marqueurs du stress oxydant ont été peu ou pas explorés dans ces études).
Les ROS (Reactive Oxygen Species) ou espèces réactives oxygénées sont reconnues comme une source majeure de stress oxydatif. Dans les systèmes cardiovasculaires, elles sont principalement produites par la NADPH oxydase.
Le Rac-1, une petite protéine, a été récemment identifié pour être une molécule clé pour l’assemblage et le fonctionnement des composants de la NADPH oxydase(28). Ces deux molécules (NADPH oxydase et Rac-1) pourraient être la cible de statine pour réduire le stress oxydatif(29).
L’inflammation
La micro-inflammation systémique est très répandue chez les patients en insuffisance rénale quel que soit son stade, même légère(30-32). Ceci dit, certains auteurs suggèrent que les niveaux de CRP (comme marqueurs de l’inflammation) ne sont pas corrélés avec le GFR ou la progression de la maladie rénale(33).
D’autre part, des études ont prouvé que le degré de réponse inflammatoire était étroitement lié à l’incidence des événements cardiovasculaires et la mortalité cardiovasculaire chez les patients atteints d’IRC(33,34).
Ainsi, A.N. Friedman et coll.(35) ont suggéré que la CRP était un prédicteur important de mortalité dans la population dialysée. L’état inflammatoire chronique est impliqué dans la lésion et dysfonction endothéliales, dans la détérioration des processus de réparation endothéliale(36), mais également la propagation de l’athérosclérose, qui comprend l’initiation, la formation et la rupture de la plaque d’athérome(37).
Les anomalies du métabolisme phosphocalcique
La pathologie rénale semble être la cause la plus fréquente du déséquilibre du métabolisme phosphocalcique. Le déclin du GFR est accompagné d’une diminution de calcium sérique (Ca) alors que les niveaux d’hormone parathyroïdienne (PTH) et de phosphate deviennent élevés(38). L’hormone parathyroïdienne (PTH) est cardiotoxique et est associée à un risque accru de mortalité cardiovasculaire(39). La PTH favorise la fibrose cardiaque en activant les fibroblastes et interfère avec la contractilité cardiaque. Elle influence également la fréquence cardiaque en perturbant les échanges calciques(40). L’hyperphosphorémie, ainsi que le produit phosphocalcique(39), constitue un facteur de risque indépendant d’événements CV(41). En effet, chaque augmentation de 0,323 mmol/l de phosphate sérique est accompagnée d’une augmentation du risque de décès de 23 %(42). Les mécanismes d’implication de l’hyperphosphorémie dans le risque cardiovasculaire ne sont pas bien établis, mais il est proposé que les niveaux élevés de phosphate soient liés aux calcifications vasculaires(43), valvulaires(44) et à une prolifération des cellules musculaires lisses(45). Sur un modèle de maladie rénale chronique avec régime alimentaire riche en phosphore, U. Schwarz et coll. ont montré que l’hyperphosphrémie est également associée à une augmentation de la fibrose cardiaque et un épaississement de la paroi des artères intramyocardiques(46).
Des chélateurs de phosphates à base de calcium ont été utilisés pour réduire l’hyperphosphorémie et ses effets cardiovasculaires, mais la star actuelle est le Sevelamer. Cette molécule est un agent non absorbable ne contenant pas de calcium et ayant montré, dans un certain nombre d’essais, une efficacité dans la réduction des niveaux de phosphate sérique ainsi que la progression des calcifications vasculaires(47).
L’anémie
Au cours de l’insuffisance rénale, l’anémie est en rapport avec le déficit en production érythropoïétine due à la dysfonction rénale. Elle survient précocement lors de l’insuffisance rénale chronique(48) et s’aggrave avec la baisse la fonction rénale(49,50).
L’anémie a deux principales répercussions physiopathologiques, d’une part, une hypoxie tissulaire et, d’autre part, une augmentation du travail cardiaque avec stimulation du système nerveux sympathique et activation du système rénineangiotensine-aldostérone. En conséquence, l’anémie entraîne une hypertrophie du VG, retrouvée chez presque 74 % des patients au début de la thérapeutique de remplacement rénale.
Plusieurs études ont démontré que l’anémie est un facteur prédictif indépendant de morbidité et de mortalité cardiaque chez les patients en insuffisance rénale terminale(51-53). Plus encore, chaque diminution de 1 g/dl dans le taux d’hémoglobine est indépendamment liée à une augmentation de la mortalité chez les patients en programme de dialyse(54).
Plusieurs essais thérapeutiques se sont attelés à corriger l’anémie et à corréler les effets de cette correction au risque cardiovasculaire. Ainsi deux études ont montré les effets bénéfiques de l’érythropoïétine exogène sur le système cardiorénal(55,56). Cet effet serait dû, non seulement à la correction du taux d’hémoglobine, mais également à une action anti-inflammatoire, antioxydante, et antiapoptotique(57,58).
Cependant, des résultats contradictoires ont été constatés par A. Besarab et coll., puisque le groupe hématocrite élevé (cible Hte à 42 %) avait un risque de mortalité des événements thrombotiques d’accès vasculaires plus élevés par rapport au groupe hématocrite à 30 %. Aucune explication à ces résultats n’a été trouvée(59). Ainsi le groupe de travail sur l’anémie du ERBP (European Renal Best Practice) a considéré qu’une hémoglobine de 11 à 12 g/dl devrait être la cible thérapeutique, sans pour autant délibérément viser des objectifs au-dessus de 13 g/dl(60,61). Des essais se sont également intéressés à la correction de l’anémie par la supplémentation en fer. La plupart des résultats suggéraient qu’un excès en taux de fer était en rapport avec une augmentation des arythmies, du risque d’insuffisance cardiaque, des calcifications vasculaires(62,63), d’un épaississement de l’intimamédia carotidienne(64) ainsi qu’une augmentation du stress oxydatif(62).
En pratique
Plusieurs autres facteurs de risque, tel que le débit de protéinurie ou l’uricémie, sont actuellement bien établis chez l’insuffisant rénal chronique.
La cardioprotection doit désormais être considérée comme une composante essentielle du traitement de l’urémique chronique tant dialysé qu’au stade prédialytique.
En l’absence d’études interventionnelles randomisées établissant l’efficacité préventive des traitements chez l’urémique, le consensus préconise l’application aux urémiques des stratégies préventives ayant fait leurs preuves dans la population générale.
Références sur demande à la rédaction : biblio@axis-sante.com
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :