Publié le 07 fév 2006Lecture 8 min
Échographie de contraste myocardique et pathologie coronaire
D. KARILA-COHEN, Centre Cardiologique du Nord, Saint-Denis
Le principe de l’échographie de contraste myocardique (ECM) repose sur l'injection de microbulles dans les artères coronaires. Les microbulles sont des traceurs purement intravasculaires, dont la taille est comparable à celle des hématies, ce qui permet leur passage jusqu'à la microcirculation myocardique. L’ECM est réalisée en imagerie de seconde harmonique et permet donc d’obtenir des informations sur la perfusion myocardique, ce qui en fait un outil particulièrement adapté à l’étude des cardiopathies ischémiques.
Principes de la technologie
Les produits de contraste
L’échographie de contraste myocardique utilise actuellement des produits de contraste injectables par voie intraveineuse, permettant l'étude non invasive de la perfusion, au lit du malade ou au laboratoire d'échocardiographie.
Il faut pour cela utiliser des microbulles suffisamment petites pour passer la barrière pulmonaire et atteindre le ventricule gauche puis le myocarde. Ces microbulles, dont la taille est < 8 µm, sont composées d'air ou de gaz, entouré d'une coque protéique, glucidique ou lipidique qui stabilise la bulle. La distribution en taille de ces microbulles est très homogène (contrairement à celle des émulsions manuelles ou insonifiées), et les rares bulles dont le diamètre est trop important seront bloquées par les capillaires pulmonaires et n'atteindront pas le ventricule gauche. Les deux produits actuellement disponibles en France sont le Sonovue® et le Levovist®, tous deux ayant l’AMM pour l’opacification cavitaire.
L’imagerie réalisée en seconde harmonique
Le principe de cette technique est d’émettre des ultrasons à une fréquence donnée et de recevoir les échos d’une fréquence double, la seconde harmonique, qui a l’avantage de générer un signal plus facilement isolable du bruit de fond. Cette technique permet donc de visualiser de manière beaucoup plus intense les zones contenant des microbulles.
Les premières études en ECM étaient réalisées avec de l’imagerie dite intermittente (permettant d’émettre moins d’ultrasons, donc de ne pas détruire rapidement les microbulles), mais avec comme principal inconvénient le caractère haché de l’imagerie, difficile à décrypter en temps réel. L’évolution actuelle se fait plutôt vers l’imagerie en temps réel, utilisant une émission d’ultrasons à basse énergie.
Échographie de contraste myocardique et phase aiguë d’infarctus
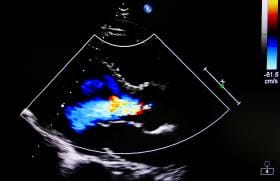
(figure 1)
Figure 1. Contraste injecté par voie veineuse : incidence 4 cavités apicales.
Détection des échecs de reperfusion
La détection non invasive des nombreux échecs de la thrombolyse grâce à l'ECM par voie intraveineuse (ECM IV), au lit du patient en fin de thrombolyse, serait une avancée majeure ; elle permettrait de pratiquer une coronarographie en urgence chez les patients suspects d’échec de thrombolyse afin de leur proposer une angioplastie de sauvetage, ou de prescrire un traitement pharmacologique adjuvant. Cette démarche « rationnelle » permettrait surtout de ne plus pratiquer de coronarographie en urgence sur des critères dont on connaît les limites objectives (douleur, ECG, profil enzymatique).
Visualisation de la zone à risque
(figure 2)
Figure 2. Détection du no-reflow : I-V injection de Perfluorocarbon Microbubbles (Nycomed).
L’ECM IV pourrait être utile dans la prise en charge des syndromes douloureux thoraciques vus en urgence :
• en cas de doute diagnostique (bloc de branche gauche, modifications électrocardiographiques peu importantes), la visualisation d’un défaut de perfusion myocardique segmentaire pourrait confirmer l’existence d’une zone à risque, donc d’une occlusion coronaire (sous réserve d’une collatéralité importante) ;
• en cas de syndrome coronarien aigu sans sus-décalage du segment ST, la visualisation d’anomalies segmentaires de la perfusion myocardique pourrait orienter vers une prise en charge plus précoce et plus « agressive ».
Détection du no-reflow
(figure 2)
Le phénomène de non-reperfusion (no-reflow) est l’association d’une perméabilité angiographique complète de l’artère responsable de l’infarctus et d’un défaut de perfusion dans la zone de l’infarctus, traduisant une absence de perméabilité de la microcirculation coronaire.
Ce phénomène a été démontré pour la première fois chez l’homme en 1992 par l’équipe d’Ito, grâce à l’ECM. L’incidence du no-reflow varie entre 15 et 35 % selon les études. De nombreuses études utilisant l'ECM intracoronaire (figures 3 et 4) ont montré qu'il existe une forte corrélation entre l'existence d'un no-reflow précoce et une mauvaise récupération fonctionnelle du ventricule gauche. En 1996, Ito et coll. ont montré sur une série de 126 patients une corrélation entre l'absence de perfusion myocardique à la phase aiguë de l'infarctus et l'existence d'une dilatation ventriculaire gauche à distance (remodelage ventriculaire), ainsi qu'avec la survenue d’événements cliniques défavorables (insuffisance cardiaque, arythmies ventriculaires, épanchement péricardique).
Figure 3. Injection coronaire gauche de contraste avant angioplastie. En rouge : segments myocardiques non perfusés : sans prise de contraste.
Figure 4. Injection coronaire gauche de contraste après angioplastie.
Les études réalisées en phase aiguë d’infarctus en utilisant l’ECM IV sont beaucoup moins nombreuses, et leurs résultats globalement plus décevants. On peut citer l’étude de Kamp qui a réalisé des ECM IV (Sonozoïd) avant angioplastie coronaire pour infarctus aigu. L’échographie n’était capable de détecter un défaut segmentaire de perfusion que chez 51 % des patients ayant une artère occluse. En revanche, la zone à risque était toujours visualisable chez les patients présentant un infarctus antérieur. Ce relativement mauvais résultat de l’étude est probablement lié aux difficultés de la technique à repérer les petits défauts de perfusion, et plus particulièrement ceux situés au niveau de la paroi inférieure (en raison d’une atténuation du signal par rapport à la paroi antérieure, plus proche du capteur ultrasonore). Une étude plus récente, utilisant l’Optison et l’ECM en temps réel (avec un index mécanique bas), a montré que le score de contraste dans la zone de l’infarctus, 12 à 24 heures après la phase aiguë, permet de prédire l’évolution de la cinétique dans le territoire de l’infarctus avec beaucoup plus d’acuité que la résolution du segment ST après angioplastie, ou que des scores angiographiques comme le « corrected TIMI Frame Count » ou le « Myocardial Blush Grade » (figures 3 et 4).
Pharmacologie : évaluation de l’effet des traitements adjuvants
Un outil de recherche clinique
L’ECM IV (figure 1) pourrait constituer un puissant instrument de recherche clinique pour l'évaluation de nouvelles thérapeutiques visant à améliorer la perfusion myocardique et à diminuer l’incidence du phénomène de no-reflow. Des résultats prometteurs ont ainsi été obtenus avec le nicorandil, avec une diminution significative de l’incidence du no-reflow (13 versus 33 % dans le groupe placebo, p < 0,05), et avec le vérapamil. Des études sont en cours avec l’adénosine.
Un vecteur thérapeutique
Les microbulles peuvent aussi être utilisées comme des vecteurs thérapeutiques, en introduisant des substances actives à l’intérieur de celles-ci et en les faisant éclater au niveau d’un site précis (en les soumettant à des ultrasons de forte puissance). Cette technique permettrait de délivrer de hautes concentrations d’un médicament ou d’un gène au site précis où son action est nécessaire (par exemple, un gène de croissance pour induire une néoangiogenèse, ou des cellules musculaires indifférenciées pour améliorer la cinétique d’un territoire nécrosé), de manière non invasive. Cette perspective est pour l’instant purement spéculative, mais devrait déboucher sur de nombreux travaux de recherche expérimentale.
Évaluation de la viabilité postinfarctus
On sait aujourd’hui que la cinétique ventriculaire gauche s’améliore à un mois, uniquement chez les patients dont la prise de contraste dans la zone de l’infarctus (donc la perfusion résiduelle) est significative au stade initial.
Une bonne sensibilité de l’ECM intracoronaire
Plusieurs études ont comparé l’ECM par voie intracoronaire à l’échographie de stress à la dobutamine, l’un des examens de référence pour la recherche de viabilité. Le but de ces examens était donc de prévoir, chez des patients dont l’artère était occluse et avec une anomalie de cinétique, une récupération de cinétique segmentaire après revascularisation (par angioplastie ou chirurgie). L’ensemble de ces études retrouve une meilleure sensibilité de l’ECM et une meilleure spécificité de l’échographie de stress à la dobutamine.
L’ECM est donc un bon examen de dépistage, de très bonne valeur prédictive négative, puisque l’absence de perfusion résiduelle dans le territoire akinétique est associée à une absence de viabilité.
L’ECM IV : une étude de la perfusion et de la fonction
Les études plus récentes ont été réalisées avec l’ECM IV, et plus particulièrement en mode temps réel (basse énergie) permettant d’étudier dans le même temps la perfusion et la fonction. Elles sont peu nombreuses et retrouvent des résultats comparables à ceux des études plus anciennes, avec cependant une spécificité plus proche de celle de l’échographie de stress à la dobutamine.
L’avenir résidera probablement dans l’association des deux techniques. En effet, l’injection de contraste par voie intraveineuse, grâce à l’opacification cavitaire du ventricule gauche, permet d’améliorer la visualisation des limites de l’endocarde, et donc les performances diagnostiques de l’échographie de stress à la dobutamine.
Dans le même temps, et à condition d’optimiser les réglages échographiques et les procédures d’injection du contraste, une étude de la perfusion myocardique pourrait être réalisée, mais les études manquent à ce sujet.
Diagnostic des sténoses coronaires
L’une des perspectives les plus prometteuses de l’ECM IV est la détection non invasive des sténoses coronaires.
- Dès 1995, Kaul et coll. ont montré qu’une ECM par injection intraatriale gauche chez le chien au cours d’une hyperémie pharmacologique permet de diagnostiquer l’existence d’une sténose coronaire. Ces résultats ont ensuite été confirmés par Kaul et par Porter, toujours chez le chien, avec l’ECM IV.
- En 1997, Kaul et coll. ont montré que ces résultats étaient applicables à l’homme. Chez 30 patients ayant une maladie coronaire connue ou suspectée, une ECM IV et une scintigraphie au MIBI ont été réalisées, toutes deux au repos et après stimulation par le dipyridamole.
La concordance de la cotation de prise de contraste segmentaire entre les deux méthodes était de 92 %. La concordance pour le diagnostic d’ischémie myocardique (donc de sténose coronaire) dans le groupe de 30 patients était de 86 %.
Ces résultats ont été confirmés plus récemment en utilisant une technique d’ECM IV à haute énergie, permettant la destruction des microbulles au fur et à mesure de leur arrivée dans les plus gros vaisseaux intramyocardiques, et donc le calcul du volume sanguin artériolaire intramyocardique. Cette technique a permis la détection des sténoses coronaires > 75 %, au repos (sans effort ni injection de vasodilatateur) avec une sensibilité > 80 % et une spécificité > 70 %.
Conclusion
L’ECM est un examen particulièrement utile dans l’exploration des cardiopathies ischémiques. La plupart des avancées physiopathologiques et pronostiques ont été réalisées avec l’ECM par voie intracoronaire, dont l’utilisation est limitée par le caractère invasif.
L’ECM IV s’est développée grâce à l’arrivée sur le marché de microbulles de 2e et 3e générations, de durée de vie prolongée, et à la maîtrise de l’imagerie à basse énergie, permettant de travailler en temps réel.
Pourtant, les études de qualité en ECM IV sont globalement assez peu nombreuses, et déçoivent parfois par la disproportion entre le travail fourni et la qualité finale des images, dont certaines nécessitent un remaniement « post-processing » informatique incompatible avec l’utilisation en routine clinique. De même, il n’existe aucun consensus sur la quantification et l’analyse des images de perfusion, ce qui rend complexe l’analyse rationnelle de la littérature, chacun faisant « sa cuisine ».
Ces limites, heureusement surmontables, font que de nombreux champs d’applications de l’ECM IV, tels qu’ils ont été décrits dans ce texte, soient cités au conditionnel.
Enfin, il ne faut pas perdre de vue que seuls deux produits de contraste sont disponibles en France actuellement, et que leur AMM est censée être limitée à l’opacification cavitaire et non myocardique, ce qui en limite théoriquement la portée d’utilisation.
Il reste donc encore beaucoup à accomplir pour faire de l’ECM une technique de routine, dont l’utilité prévisible est réellement importante.
Une bibliographie sera adressée aux lecteurs sur demande au journal.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :