Échocardiographie
Publié le 06 mai 2008Lecture 10 min
L'échocardiographie du sujet âgé : du vieillissement cardiaque à la pathologie avérée
J.-L. MONIN, CHU Henri Mondor, Créteil
Les modifications physiologiques liées au vieillissement cardiaque font que le sujet âgé est un insuffisant cardiaque en puissance. En effet, les anomalies de la fonction diastolique, l’augmentation de la rigidité artérielle et la désensibilisation des bêtarécepteurs sont compensées la plupart du temps, permettant un débit cardiaque normal au repos. Cependant, le sujet âgé est exposé aux troubles du rythme, aux poussées hypertensives ou à l’ischémie myocardique qui dépassent rapidement les facultés d’adaptation cardiovasculaire et le précipitent vers l’insuffisance cardiaque. Une des difficultés de l’échocardiographie du sujet âgé est de faire la part entre les anomalies physiologiques liées au vieillissement et la présence d’une « vraie » pathologie cardiaque, potentiellement responsable des symptômes décrits par le patient.
Modifications liées au vieillissement cardiaque
Les modifications physiologiques liées au vieillissement touchent essentiellement le myocarde, les valves, les gros vaisseaux et le système sympathique. L’augmentation du diamètre des gros vaisseaux s’accompagne d’une augmentation de la rigidité artérielle et de l’impédance aortique ; cela est partiellement corrigé par un remodelage concentrique ventriculaire gauche, voire une hypertrophie myocardique dont le but est de maintenir une contrainte pariétale normale. L’hypertrophie myocardique s’accompagne d’une perte relative en myocytes, associée à une augmentation du pourcentage de fibrose, ce qui entraîne des anomalies de la relaxation ventriculaire gauche. La désensibilisation des bêtarécepteurs myocardiques et vasculaires entraîne une diminution des capacités d’adaptation à l’effort par insuffisance chronotrope et baisse de la réserve vasodilatatrice artérielle. L’ensemble de ces modifications explique la diminution de la consommation d’oxygène à l’effort, mesurée par une baisse de la VO2max de 5 à 10 % par décennie à partir de 30 ans.
Difficultés techniques par voie transthoracique
L'échocardiographie transthoracique (ETT) est un examen non invasif particulièrement précieux chez les patients âgés. Il permet d'étudier l'anatomie et l'hémodynamique intracardiaque, et de distinguer la pathologie de certaines modifications physiologiques liées à l'âge. Cependant, les patients très âgés sont difficilement mobilisables, du fait de certaines maladies associées, notamment l’arthrose et les maladies neurologiques (essentiellement Parkinson ou séquelles d’accident vasculaire cérébral). En plus des difficultés d’installation du patient, la coopération pendant l’examen peut être réduite, le simple contact de la sonde d’échographie étant volontiers jugé douloureux. Il en résulte que le temps d’examen doit être le plus court possible ; cet impératif n’est pas toujours compatible avec les difficultés techniques liées à l’âge : coudure septo-aortique, calcifications valvulaires importantes, fibrillation auriculaire ou mauvaise échogénicité liée à une déformation thoracique.
Échographie transœsophagienne/stress-écho : des indications limitées
L’échographie transœsophagienne (ETO) est souvent mal tolérée par les patients âgés. De plus, les complications, notamment des réactions vagales intenses ou des fausses routes, sont significativement plus fréquentes chez le vieillard. De ce fait, les indications d'ETO sont exceptionnelles au-delà de 80 ans : cet examen ne se justifie que si le résultat a une importance capitale pour le diagnostic et/ou l'orientation thérapeutique du patient.
Concernant l’échographie de stress, les indications sont également mûrement réfléchies. La faible capacité d’effort contre-indique la plupart du temps le recours à l’échographie d’effort. L’échographie dobutamine est plus souvent indiquée, notamment dans le cadre d’une recherche d’ischémie myocardique avant une chirurgie lourde (vasculaire ou orthopédique) ou en cas de RAC en bas débit avec faibles gradients transvalvulaires(1). Avant une chirurgie non cardiaque, l’écho-dobutamine n’est justifiée qu’en présence d’au moins deux facteurs de risque (en plus de l’âge > 70 ans) parmi les suivants : angor, antécédent d’infarctus, poussée d’insuffisance cardiaque, accident vasculaire cérébral, diabète traité par les médicaments ou insuffisance rénale(2).
Remodelage concentrique/hypertrophie modérée du ventricule gauche
Une des principales modifications structurales liées au vieillissement est un remodelage concentrique du ventricule gauche, avec augmentation de l’épaisseur pariétale aux dépens du diamètre interne de la cavité, entraînant une augmentation du rapport épaisseur/rayon. Il s’ensuit une anomalie de la relaxation ventriculaire gauche, qui se traduit sur le flux Doppler transmitral par une inversion du rapport E/A, un allongement du temps de relaxation isovolumique (TRIV) et du temps de décélération de l’onde E (figure 1). La participation plus importante de la systole auriculaire au remplissage ventriculaire chez le sujet âgé explique la fréquence des décompensations cardiaques en cas de fibrillation auriculaire. Une dilatation modérée de l’oreillette gauche est quasiment constante, contemporaine des modifications structurales du ventricule gauche.
Figure 1. Doppler pulsé transmural : profil diastolique physiologique chez un patient âgé avec inversion du rapport E/A, allongement du temps de relaxation isovolumétrique (TRIV), du temps de décélération mitral ; l’ensemble de ces anomalies traduit un allongement de la relaxation ventriculaire.
Après 75 ans, une épaisseur pariétale télédiastolique ≥ 15 mm est en faveur d’une hypertrophie ventriculaire gauche (HVG) ; la masse myocardique indexée peut être calculée d'après les mesures TM si le rapport des épaisseurs diastoliques septum/paroi postérieure est < 1,3. On parle d'HVG si la masse myocardique indexée est > 110 g/m2 pour les femmes et > 135 g/m2 chez les hommes. Parmi les patients > 80 ans, on retrouve 33 % d'HVG chez les hommes et 50 % chez les femmes. Le degré d'hypertrophie est plus important en cas d’hypertension artérielle associée. Ainsi, la constatation d'une hypertrophie myocardique modérée et isolée en dehors d'un contexte d'insuffisance cardiaque est banale après 80 ans, et ne nécessite pas d'exploration complémentaire particulière.
Cardiopathie hypertrophique du sujet âgé
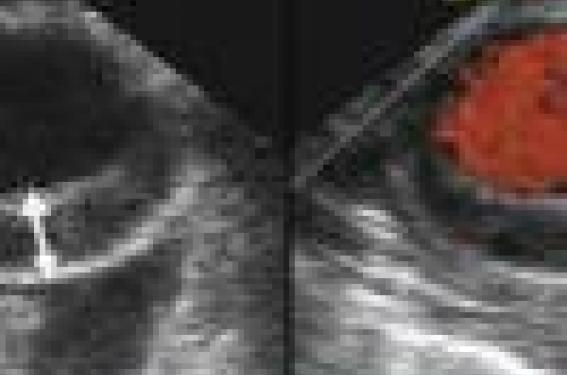
Une HVG importante peut se traduire par des symptômes d'insuffisance cardiaque. La cardiomyopathie hypertrophique du sujet âgé est caractérisée par une prévalence élevée d'insuffisance cardiaque congestive avec une fonction systolique ventriculaire gauche le plus souvent normale. Il existe en revanche une élévation des pressions de remplissage ventriculaire gauche détectables par l’analyse des flux Doppler transmitral, du Doppler tissulaire à l’anneau, voire la comparaison de la durée de l’onde A mitrale/pulmonaire (figure 2). Ces patients ont habituellement une cavité ventriculaire gauche de petite taille et une hypertrophie concentrique importante. Il existe parfois une véritable cardiomyopathie obstructive se traduisant par un gradient dynamique intraventriculaire gauche (figure 3). Le traitement au long cours de ces insuffisances cardiaques à fonction systolique normale fait volontiers appel aux bêtabloquants ou aux inhibiteurs calciques ; l'adjonction de diurétiques est nécessaire dans certains cas qui ne sont pas la majorité.
Figure 2. Évaluation des pressions de remplissage : 1. Flux Doppler pulsé transmitral (rapport E/A, durée de l’onde Am) ; 2. Doppler pulsé tissulaire à l’anneau (onde Ea, rapport E/Ea) ; 3. Vitesse de propagation du flux en TM couleur (pente Vp) ; 4. Flux veineux pulmonaire (durée de l’onde Ap).
Figure 3. Cardiomyopathie hypertrophique du sujet âgé avec obstruction dynamique sous-aortique. Visualisation du flux d’accélération en Doppler couleur par voie apicale (A). Flux d’accélération dynamique avec pic de vitesse entre 3,5 et 4 m/s en Doppler continu (B).
Amylose cardiaque
Chez le vieillard, des dépôts cardiaques amyloïdes sont retrouvés à l'autopsie chez 65 % des sujets > 90 ans. Dans la plupart des cas, les dépôts amyloïdes sont limités aux oreillettes. Une infiltration plus diffuse des ventricules et des valves cardiaques se voit en cas de maladie associée (myélome multiple) ou d'amylose primitive systémique. En cas d'infiltration du myocarde ventriculaire, le tableau clinique est celui d'une insuffisance cardiaque congestive gauche ou globale. Le profil hémodynamique du flux Doppler mitral est celui d'une cardiopathie restrictive (E/A > 2, temps de décélération de E court), la fonction systolique ventriculaire gauche étant initialement conservée. L'échographie bidimensionnelle retrouve un myocarde épaissi, avec un aspect hyper-brillant particulier, lié à l'infiltration myocardique. L'hypertrophie touche également la paroi libre du ventricule droit ; un épaississement valvulaire et un épanchement péricardique modéré sont fréquemment associés (figure 4).
Figure 4. Amylose cardiaque : forte hypertrophie ventriculaire gauche associée à un aspect « scintillant » du myocarde traduisant l’infiltration par la substance amyloïde. Noter l’épanchement péricardique (flèches) très fréquent en cas d’amylose cardiaque.
Sclérose valvulaire aortique/rétrécissement aortique
On observe un épaississement progressif des valves avec l’âge, notamment sur la valve aortique. Une sclérose valvulaire aortique, définie par une fibrose modérée sans calcification notable des sigmoïdes, est présente chez 20 à 30 % des patients > 65 ans, associée en règle à une insuffisance aortique minime sans sténose significative. L’évolution vers un rétrécissement aortique calcifié (RAC) ne concerne que 2 à 3 % de la population générale et survient habituellement entre 65 et 80 ans. La limitation d’ouverture des sigmoïdes est liée à la sclérose et aux calcifications valvulaires qui se développent sur le versant aortique des valves et progressent de la base d’insertion vers le bord libre sans fusion commissurale. Rappelons que, d’après les derniers travaux de W.-C. Roberts, après exclusion des rares cas de valvulopathie rhumatismale, la moitié des RAC opérés dans les pays industrialisés sont dus à une anomalie congénitale (bicuspidie aortique les plus souvent)(3). Les difficultés d’examen en cas de RAC sont amplifiées par l’âge : visualisation difficile du diamètre sous-aortique du fait de calcifications importantes, difficultés d’alignement sur le flux transvalvulaire par voie apicale nécessitant une mobilisation supplémentaire afin d’explorer systématiquement les fenêtres parasternales droites en Doppler continu.
Calcifications de l’anneau mitral
La prévalence des calcifications de l'anneau mitral retrouvées en échocardiographie croît avec l'âge des patients examinés, atteignant 40 % des cas dans certaines séries après 85 ans. L'amas calcaire prédomine généralement sur l'hémi-circonférence postérieure de l'anneau, en regard de la petite valve. La progression de la coulée calcaire se fait de façon circonférentielle autour de l'appareil valvulaire ; le corps des valves n'étant habituellement pas touché (figure 5). Ces calcifications provoquent une perte de la contraction systolique de l'anneau avec une insuffisance mitrale modérée dans plus de 50 % des cas. Par ailleurs, les calcifications de l'anneau peuvent participer au déplacement antérieur de l'appareil valvulaire en systole et à l'obstruction dynamique (SAM) à l'éjection ventriculaire gauche dans les cardiopathies hypertrophiques du sujet âgé. Concernant la corrélation avec la survenue d'accidents vasculaires cérébraux, il semblerait que les calcifications mitrales soient un marqueur d'athérosclérose plutôt que la cause directe de ces accidents.
Figure 5. Calcification de l’anneau mitral : masse calcifiée arrondie englobant la base du feuillet postérieur : vue parasternale grand axe (A) ; noter le cône d’ombre derrière la calcification (flèches) et vue apicale 4 cavités (B).
Insuffisance mitrale
L’insuffisance mitrale dégénérative par ballonisation ou prolapsus valvulaire est actuellement la deuxième cause de valvulopathie native en Europe et touche volontiers les patients âgés : 13 % de ballonisations mitrales chez les hommes et 17 % chez les femmes > 90 ans dans une étude autopsique de la Mayo Clinic. L'atteinte la plus fréquente est le prolapsus de la portion médiane du feuillet postérieur (P2) retrouvée dans 4/5 des cas (figure 6)(4). Une fuite mitrale importante par prolapsus, généralement associée à des ruptures de cordages, peut amener à discuter un geste chirurgical chez un patient âgé symptomatique en bon état général. La faisabilité d’une plastie mitrale est un argument supplémentaire en faveur de la chirurgie, compte tenu des meilleurs résultats à moyen terme par rapport au remplacement valvulaire. Un bilan complet de faisabilité d’une plastie mitrale est possible par échographie transthoracique, pourvu que l’examinateur possède une expertise suffisante(4). Les points importants sont :
– l’extension des zones de prolapsus et des ruptures de cordage,
– la hauteur du feuillet postérieur (qui détermine le risque de SAM postopératoire),
– le degré de calcification de l’anneau, qui peut être un obstacle sérieux à la réalisation d’une plastie en cas de calcification extensive.
Figure 6. Schéma illustrant l’aspect typique d’un prolapsus de P2 en échographie transthoracique dans les incidences parasternale grand axe (A), apicale 2 cavités (plan intercommissural, B), parasternale transverse (C) et apicale 4 cavités (D).
Dilatation des gros vaisseaux/pathologie de l’aorte thoracique
Le diamètre de l’anneau aortique varie peu avec l’âge ; il est davantage corrélé avec la surface corporelle alors que les diamètres de la jonction sino-tubulaire et de l’aorte ascendante augmentent avec l’âge. En cas de douleur thoracique brutale, intense et d’emblée maximale, la suspicion d’un syndrome aortique aigu est l’une des rares indications d’ETO en urgence chez un patient âgé en bon état général.
Dans ce contexte, l’ETO peut retrouver un hématome intrapariétal (HIP) aortique, variante de la dissection vraie, qui survient spécifiquement chez les patients âgés et hypertendus (classe II de la classification des syndromes aortiques aigus, cf. Cardiologie Pratique n° 813). L’HIP est dû à la rupture d'un vasa vasorum dans l’épaisseur de la média. L’ETO montre un épaississement « en croissant », dont l’extension en hauteur est relativement limitée et dont le contenu évoque un hématome, sans faux chenal ni voile intimal (figure 7). Une fois le diagnostic établi, la conduite à tenir est la même que pour une dissection vraie : chirurgie en urgence (en dehors des contre-indications) si l’hématome touche l’aorte ascendante (type A de Stanford), compte tenu du risque de rupture aortique. En cas d’hématome limité à l’aorte descendante (type B de Stanford, 2/3 des cas), la surveillance en unité de soins intensifs est recommandée, sous monitoring strict de la douleur et de la pression artérielle.
Figure 7. ETO : hématome pariétal de l’aorte descendante (type B): A : épaississement en croissant de la paroi aortique dont l’épaisseur peut être mesurée (double flèche) ; B : le Doppler couleur montre l’absence de communication entre la lumière aortique et la zone d’hématome ; C : en coupe longitudinale, plusieurs zones liquidiennes sont visibles au sein de l’hématome, sans flux circulant.
En conclusion
Dans la majorité des cas, l’écho-Doppler transthoracique permet d’identifier des anomalies physiologiques liées au vieillissement cardiaque : dilatation modérée du culot aortique, remodelage concentrique des parois ventriculaires gauches, hypertrophie concentrique ventriculaire modérée avec anomalies de la relaxation, calcification de l’anneau mitral avec insuffisance mitrale minime ou sclérose valvulaire aortique sans retentissement hémodynamique. L’ensemble de ces anomalies ne nécessite pas d’autre examen complémentaire et a fortiori aucun traitement propre.
À l’opposé, une cardiomyopathie hypertrophique sévère peut nécessiter un traitement propre en cas de signes d’insuffisance cardiaque congestive. De même, une intervention chirurgicale peut être proposée en cas de rétrécissement aortique sévère ou d’insuffisance mitrale importante lorsque ces anomalies sont clairement responsables de symptômes invalidants et en dehors de contre-indications extracardiaques. Bien entendu, la chirurgie valvulaire cardiaque au stade asymptomatique reste contre-indiquée chez les patients > 75 ans, compte tenu d’un rapport bénéfice/risque défavorable.
Enfin, une pathologie aortique aiguë (notamment l’hématome intrapariétal) peut justifier un geste chirurgical en urgence lorsque l’aorte ascendante est impliquée.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :