Congrès et symposiums
Publié le 14 mai 2016Lecture 9 min
La prise en charge de l’infarctus cérébral à la phase aiguë en 2016
W. BOISSEAU, M. MAZIGHI*, Unité Inserm 1148, Laboratory of Vascular Translational Science *Service de neurologie et unité neurovasculaire, AP-HP, Hôpital Lariboisière, Paris TUC
TUC
Les accidents vasculaires cérébraux (AVC) constituent un problème majeur de santé publique compte tenu de leur forte incidence (environ 150 000 cas chaque année en France) et de leur impact sur la qualité de vie. Les AVC représentent la première cause de handicap acquis de l’adulte et la deuxième cause de mortalité dans le monde(1). Les AVC regroupent les infarctus cérébraux (80-90 % des AVC), secondaires à l’occlusion d’un vaisseau intracrânien, et les hémorragies cérébrales (10-20 % des AVC) consécutives à la rupture d’un vaisseau. Une fois le diagnostic d’AVC évoqué, l’urgence est de réaliser, le plus rapidement possible, une imagerie cérébrale afin de distinguer l’infarctus de l’hémorragie cérébrale.
Seule l’imagerie cérébrale permet de faire la différence entre l’ischémie et l’hémorragie. L’examen de choix est l’IRM-ARM cérébrale (avec les séquences diffusion, FLAIR, 3DTOF, T2*). À défaut (contre-indication à l’IRM, plateau technique limité), un scanner cérébral avec un angioscanner du polygone de Willis est réalisé. Une fois le diagnostic d’infarctus cérébral posé, la prise en charge doit être réalisée en urgence dans un service dédié (unité neurovasculaire [UNV]). Plus la prise en charge est précoce, meilleur est le pronostic. Ces derniers mois ont vu des changements majeurs dans la prise en charge de l’infarctus cérébral et notamment dans les thérapeutiques de reperfusion à la phase aiguë.
Ce qui ne change pas
L’hospitalisation en unité neurovasculaire
Selon les recommandations françaises et internationales(2), tout patient atteint d’un AVC doit être hospitalisé dans une unité spécialisée dans la prise en charge des pathologies neurovasculaires (UNV) comprenant notamment un personnel médical et paramédical spécialisé. Une revue de la Cochrane en 2013(3) a confirmé l’intérêt des UNV. En effet, les patients hospitalisés dans les UNV ont un risque de décès et de handicap diminué de 20 %, en comparaison aux patients admis dans d’autres services, indépendamment de tout traitement spécifique reçu (par exemple, la thrombolyse intraveineuse [IV]). Les raisons de ce meilleur pronostic sont multiples et résultent :
- d’un bilan diagnostique et pronostique de l’AVC ;
- d’une surveillance intensive de l’examen neurologique et des fonctions vitales ;
- d’une institution rapide des traitements spécifiques de l’AVC et de la prévention des récidives ;
- d’une prévention et traitement des complications générales ;
- d’une mobilisation et rééducation précoces ;
- d’une prise en charge psychologique du patient et son entourage ;
- d’une information et éducation du patient et de son entourage ;
- d’un suivi thérapeutique avec projet rééducation et de réadaptation personnalisé.
En pratique, 10 mesures sont l’objet de recommandations lors de l’hospitalisation en UNV :
- maintien d’une pression artérielle < 220/110 mmHg (sauf situations spécifiques, pression artérielle systolique < 140 mmHg en cas d’hémorragie cérébrale non traumatique et non liée à une malformation vasculaire ; pression artérielle systolique et diastolique < 185/110 mmHg en cas de thrombolyse IV) ;
- solution salée isotonique (le sérum glucosé est proscrit sauf situations spécifiques telle l’hypoglycémie) ;
- maintien d’une glycémie < 1,8 g/l ;
- traitement de T° > 37,5 °C ;
- oxygène nasal si SaO2 < 95 % ;
- prévention des troubles de la déglutition ;
- prévention des infections urinaires ;
- prévention d’escarres ;
- prévention des thromboses veineuses profondes des membres inférieurs ;
- prévention de l’œdème cérébral.
La thrombolyse IV
La thrombolyse IV par altéplase jusqu’à 4 h 30 après le début des symptômes, à la dose de 0,9 mg/kg (10 % en bolus, le reste en perfusion continue pendant 1 h) reste le traitement médicamenteux validé par plusieurs essais thérapeutiques(4-6). Une revue récente de la Cochrane(7), reprenant 27 essais thérapeutiques, a confirmé l’efficacité de la thrombolyse IV avec une augmentation du nombre de patients indépendants (score de Rankin modifié entre 0 et 2) par rapport aux patients traités par placebo. Il est estimé que pour 1 000 patients traités par thrombolyse IV, 41 éviteront la mort ou la dépendance(7).
La thrombolyse IV par altéplase possède néanmoins 3 principales limites :
- une augmentation significative du taux d’hémorragie cérébrale symptomatique responsable d’une surmortalité durant les 7 à 10 premiers jours ;
- de nombreuses contre-indications (fenêtre horaire restreinte, troubles de l’hémostase, etc.) ;
- une efficacité limitée (faible taux de recanalisation) en cas d’occlusion d’une artère de gros calibre (terminaison artère carotide interne [ACI], segments proximaux de l’artère cérébrale moyenne [ACM])(8).
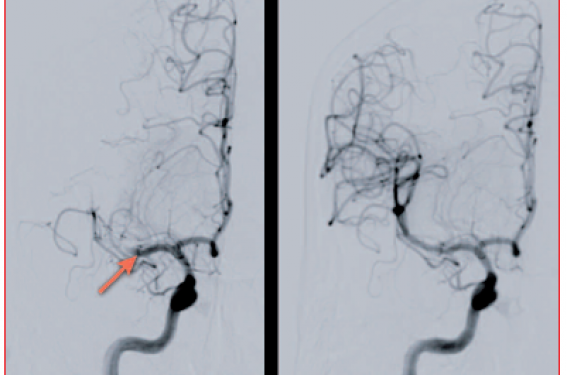
Ces différentes limites ont conduit au développement de nouvelles stratégies thérapeutiques et notamment de l’approche endovasculaire (figure 1).
Figure 1. Clichés d’artériographie cérébrale de face, après injection dans la carotide interne droite. À gauche, occlusion de la partie proximale de l’artère cérébrale moyenne (flèche). À droite, recanalisation complète de l’artère cérébrale moyenne après thrombectomie.
Ce qui change
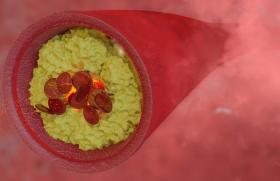
En 2015, 5 essais thérapeutiques ont prouvé l’efficacité de la thrombectomie mécanique en association à la thrombolyse IV dans le traitement des infarctus cérébraux avec occlusion des artères de gros calibre de la circulation antérieure (ACI et ACM)(9-13). La thrombectomie est réalisée grâce à l’utilisation de stents non largables ou stent retriever (figure 2). Ces stents auto-expansifs sont déployés dans le thrombus, pour plaquer ce dernier contre la paroi de l’artère et rétablir un flux dans le territoire vasculaire ischémié. Après quelques minutes le stent retriever est retiré, ce qui permet d’extraire le caillot. Le stent retriever est donc déployé mais non largué.
Figure 2. Image de stent retriever après thrombectomie, montrant le caillot capturé dans les mailles du stent.
La thrombectomie en association à la thrombolyse IV est associée à une probabilité plus importante d’être indépendant à 3 mois par rapport à la prise en charge standard (incluant la thrombolyse IV)(14). Cette amélioration ne s’accompagne pas de différences des taux d’hémorragies cérébrales symptomatiques et de mortalité à 90 jours. Cette récupération est impactée par le délai pour réouvrir l’artère. Dans ces différents essais thérapeutiques publiés en 2015, ceux présentant le plus grand pourcentage de patients avec une évolution favorable ont été ceux dont la reperfusion a été obtenue le plus précocement (dans les 4 h 30). Pour les reperfusions entre 4 h 30-6 h, moins de 40 % des patients ont une évolution favorable et moins de 20 % au-delà de 6 heures(15). Ces résultats confirment la nécessité de recanaliser le plus rapidement possible. Il faut noter par ailleurs que les données de métaanalyse sur données individuelles montrent que les patients les plus âgés (> 80 ans) sont ceux qui bénéficient le plus de la thrombectomie. L’âge ne peut donc être considéré comme une contre-indication à la thrombectomie(16).
L’ensemble de ces essais a conduit la Société française de neurovasculaire (SFNV) à proposer les critères suivants d’éligibilité pour la thrombectomie : des patients avec un infarctus cérébral consécutif à une occlusion proximale des artères de la circulation antérieure confirmée par imagerie (ACI, segments proximaux de l’ACM) ; une reperfusion à obtenir dans les 6 heures qui suivent le début des symptômes ; la réalisation en association avec la thrombolyse IV en l’absence de contre-indication.
Malgré ces résultats positifs, plusieurs questions restent encore en suspens :
- peut-on proposer une thrombectomie pour une occlusion du tronc basilaire ? Aucune des études précédemment citées n’a inclus de patients avec une occlusion du tronc basilaire. Une étude en cours (BASICS) n’incluant que des patients avec une occlusion du tronc basilaire évalue la thrombectomie mécanique dans cette situation. Actuellement, en cas d’occlusion du tronc basilaire, la conduite à tenir est discutée au cas par cas ;
- quelle est la modalité d’imagerie à utiliser ? Il n’existe là encore pas de consensus sur la réalisation préférentielle d’une IRM ou d’un scanner. Il est néanmoins recommandé que cette imagerie comporte une imagerie parenchymateuse, des vaisseaux cervico-encéphaliques (angio-MR ou angioscanner, afin de confirmer une occlusion d’un vaisseau de gros calibre). Une imagerie de perfusion est recommandée par la SFNV afin de permettre une meilleure sélection des patients et une identification de ceux avec une hypoperfusion cérébrale importante. Le choix se fera en fonction de la disponibilité et de l’expertise de chaque site ;
- quel type d’anesthésie utiliser pendant la thrombectomie ? La méthode d’anesthésie (anesthésie générale ou sédation consciente) est actuellement débattue. Les données issues d’analyses rétrospectives et de sous-groupes des essais randomisés semblent plutôt en faveur de la sédation consciente avec des taux moindres de mortalité et de handicap(17). Parmi, les hypothèses envisagées, une baisse de la pression de perfusion cérébrale (à l’induction de l’anesthésie générale) et un taux accru de pneumopathie d’inhalation pourraient expliquer un surcroît de morbi-mortalité. Mais il est probable que les patients intubés-ventilés soient les plus graves, ce qui pourrait être un biais majeur. Plusieurs essais thérapeutiques sont actuellement en cours afin de déterminer s’il existe une supériorité d’une des 2 méthodes d’anesthésie(18-21).
Ce qui va peut-être changer
La ténectéplase
Depuis 1995, l’altéplase est le thrombolytique de référence. La ténectéplase (TNK), un « mutant » du tPA natif 14 fois plus spécifique de la fibrine que le rtPA et 80 fois plus résistant à son inhibiteur le PAI-1, apparaît comme une alternative potentielle(22). Il est à noter que la demi-vie de la TNK est plus longue (environ 18 minutes) permettant une administration en un seul bolus IV. Cet élément de faisabilité n’est pas à négliger, quand l’altéplase nécessite une perfusion d’une heure. Plusieurs études à la phase aiguë de l’infarctus cérébral comparant la TNK à l’altéplase ont montré des taux de reperfusion plus élevés(23,24) avec une probabilité d’évolution clinique favorable à 3 mois plus importante sous TNK que sous altéplase (évolution clinique favorable — score mRS 0-2 — : 44 % des patients traités par altéplase versus 72 % des patients traités par TNK, p = 0,02)(24). Autre élément important, la TNK apparaît associé à un taux moindre de transformation hémorragique que l’altéplase(24-26). Deux études de phase III sont actuellement en cours pour étudier l’efficacité du TNK par rapport à l’altéplase, seule (étude TASTE(27)) ou en association avec la thrombectomie (étude EXTEND-IA TNK(28)). Si les données des études pilotes se confirment, la TNK pourrait remplacer à terme l’altéplase.
La neuroprotection
En cas de reperfusion du territoire ischémié, de nombreux phénomènes se produisent incluant : excito-toxicité, inflammation, stress oxydatif, rupture barrière hémato-encéphalique, apoptose et autophagie. Ces phénomènes peuvent conduire à une extension de la zone nécrosée malgré la reperfusion : ce sont les lésions dites de « reperfusion ». De nombreuses molécules, ciblant un ou plusieurs mécanismes précédemment cités ont semblé prometteur chez l’animal mais ont toujours échoué à prouver leur efficacité chez l’homme.
Dans ce contexte, une nouvelle molécule, le fingolimod (« modulateur » des récepteurs sphingosine-1-phosphate), médicament utilisé dans la prévention des poussées dans la sclérose en plaques semble donner des résultats encourageants. Plusieurs essais chez l’animal ont mis en évidence une diminution du volume d’infarctus cérébral dans des modèles « d’ischémie-reperfusion ». Une métaanalyse de 9 études faites chez l’animal, a confirmé ces résultats(29) avec notamment une diminution de la taille de l’infarctus et une amélioration clinique. Le fingolimob entraîne une rétention intraganglionnaire des lymphocytes(30). Ces derniers ont un rôle dans la dysfonction endothéliale et la thrombose vasculaire après reperfusion(30,31), participant ainsi à l’extension de l’infarctus cérébral. Lors du traitement par fingolimod, les lymphocytes seraient donc « piégés » dans les ganglions et ne pourraient donc exercer leurs effets néfastes sur la microcirculation après reperfusion. Le fingolimod est actuellement en évaluation chez l’homme et les résultats seront prochainement publiés. Nous verrons s’il s’agit d’une nouvelle désillusion ou d’une option thérapeutique innovante.
En pratique
Le diagnostic d’AVC est évoqué devant tout déficit neurologique d’apparition brutale. L’urgence est alors de réaliser une imagerie cérébrale afin de distinguer un infarctus d’une hémorragie cérébrale et d’explorer les vaisseaux intracrâniens.
Un AVC est une urgence diagnostique et thérapeutique : plus la prise en charge est précoce, meilleur est le pronostic.
Tout patient atteint d’un AVC doit pouvoir bénéficier d’une hospitalisation dans une unité spécialisée dans la prise en charge des pathologies neurovasculaires (unité neurovasculaire).
Le nouveau traitement de référence de l’infarctus cérébral est la thrombolyse IV dans les 4 h 30 associée à la throm bectomie dans les 6 heures en cas d’occlusion des artères carotide interne et/ou cérébrale moyenne proximales.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :