Échocardiographie
Publié le 20 oct 2015Lecture 21 min
Intérêt de l’échographie de contraste en pathologie artérielle
G. DEKLUNDER, C. GAUTIER, Service des EFCV, Hôpital Cardiologique, Lille
L’échographie a une place très importante dans le diagnostic et la surveillance des patients porteurs de lésions vasculaires, lésions athéromateuses en particulier. Ces pathologies sont très fréquentes et susceptibles de bénéficier d’un traitement qui sera choisi en fonction de la localisation et de la sévérité des lésions, caractéristiques que l’échographie a pour rôle de préciser, le plus souvent en première intention. Pour cette raison, elle se doit d’être le plus sensible et le plus spécifique possible. Le niveau de qualité actuel des examens échographiques permet le plus souvent d’atteindre ces objectifs. L’utilisation des agents de contraste est cependant très utile pour améliorer les performances et la reproductibilité de ces examens lorsque les conditions techniques sont difficiles (vaisseaux profonds, obstacles interposés), ou lorsque l’on est en présence de flux très lents (petits vaisseaux, microcirculation, obstructions sévères). Bien plus, l’utilisation des agents de contraste permet d’élargir les indications de l’échographie vasculaire et d’envisager des applications nouvelles dans différents territoires, à la condition toutefois d’avoir recours à des séquences spécifiques d’imagerie.
Bases de l’échographie de contraste
Les produits de contraste ultrasonore
Les produits de contraste ultrasonore (PCUS) sont composés de microbulles qui sont d’excellents diffuseurs des ultrasons et renforcent donc fortement le signal rétrodiffusé par le sang. Le seul agent de contraste utilisé en France est le SonoVue® ; il est composé de microbulles d’hexafluorure de soufre stabilisées par une enveloppe phospholipidique. Les PCUS sont des marqueurs purs du compartiment sanguin qui permettent donc non seulement de dépasser les limites des techniques Doppler conventionnelles, mais aussi de visualiser, et c’est cela qui est l’apport majeur des PCUS, le compartiment microvasculaire.
La qualité et la durée du rehaussement du signal dépendent d’une part des caractéristiques physiques des microbulles mais également des modalités d’injection et des modes échographiques utilisés. Selon la technique d’injection et le mode échographique utilisé, on obtiendra donc une information de qualité variable. La situation est en effet particulière dans le sens où il existe une interaction entre les microbulles et l’onde sonore incidente. En fait, le comportement des microbulles situées dans le champ ultrasonore dépend de l’amplitude de l’onde sonore elle-même.
À faible pression, la réponse des microbulles est linéaire (leur expansion et leur contraction dans le champ ultrasonore est symétrique), la destruction des microbulles est limitée ce qui autorise des études en temps réel et des balayages pouvant durer plusieurs minutes.
Au-delà d’un certain seuil, variable selon les caractéristiques physiques des microbulles, leur réponse devient non linéaire et elles émettent alors des fréquences harmoniques que les modes d’imagerie spécifiques permettent de détecter. Les techniques d’imagerie utilisées pour l’étude de la microcirculation reposent ainsi sur la détection de ce que l’on peut appeler la signature des microbulles.
À très haute pression, de l’ordre de 1MPa, le comportement non linéaire est transitoire et suivi d’une destruction des microbulles. Ce phénomène est utilisé pour étudier le remplissage vasculaire d’un parenchyme après destruction et donc la perfusion des organes.
Modalités d’administration, tolérance, principales contre-indications
Les PCUS sont administrés par voie intraveineuse, le plus souvent en bolus. Celui-ci est suivi d’une injection de sérum physiologique (10 ml) facilitée par l’utilisation d’un robinet à trois voies.
Les PCUS sont très bien tolérés et l’incidence des effets secondaires est faible. Des réactions d’hypersensibilité ou des réactions allergiques sévères ont été rapportées mais avec une incidence nettement plus faible que pour les agents de contraste iodés. Il est donc nécessaire de prendre des précautions similaires à celles liées à l’usage des autres agents de contraste (matériel de réanimation à disposition)(1). Chez des patients présentant une insuffisance cardiaque sévère, les PCUS peuvent entraîner des effets secondaires graves et ils sont donc contre-indiqués dans ces conditions. Des précautions sont également nécessaires chez les patients présentant une coronaropathie sévère. Les PCUS ne sont pas utilisables chez la femme enceinte ou allaitante. Ils sont, pour l’instant, réservés à l’adulte.
Comme pour tous les examens échographiques, mais cela est d’autant plus vrai avec l’usage des PCUS, il est préférable de maintenir l’indice mécanique et l’indice thermique à une valeur basse et d’éviter une exposition inutile prolongée aux ultrasons pour éviter des effets biologiques indésirables(1).
Échographie de contraste vasculaire : généralités
De façon générale et quels que soient les territoires vasculaires considérés, l’échographie de contraste est indiquée dans les cas où le flux circulant est mal ou non visualisé malgré le choix d’une fréquence de sonde et de réglages de l’échographe adaptés aux conditions en présence. L’utilisation d’un produit de contraste ultrasonore permet en effet de s’affranchir des obstacles les plus courants.
Limites courantes de l’échographie vasculaire
Limites liées aux lésions pariétales
Les lésions athéromateuses à l’origine des sténoses artérielles sont en règle générale de nature complexe et d’aspect hétérogène. Il existe souvent des calcifications au sein des plaques qui entraînent des cônes d’ombre acoustique pouvant gêner, sur une distance plus ou moins importante, la visualisation du chenal vasculaire. Malgré une optimisation des réglages, il est donc souvent impossible d’évaluer correctement l’importance de la sténose entraînée par la plaque en présence. La difficulté est d’autant plus incontournable que la plaque et l’obstacle sont longs puisqu’en effet, dans les obstacles courts, les anomalies hémodynamiques observées à l’entrée et à la sortie de la lésion permettent d’apprécier la sévérité de la sténose dans la plupart des cas.
Limites liées aux caractéristiques du flux
Lorsque les sténoses athéromateuses sont extrêmement serrées et que le débit n’est plus maintenu dans le circuit artériel concerné, l’énergie ultrasonore rétrodiffusée par le flux résiduel est très faible, en deçà des capacités de détection des échographes usuels. Ce peut être également le cas dans les dissections carotides aiguës où l’hématome de paroi réduit considérablement la lumière artérielle et où ne persiste qu’un flux très minime, ou dans le faux chenal à flux lent d’une dissection aortique. Dans ces cas, le diagnostic d’occlusion peut être porté abusivement lorsque ni l’imagerie Doppler ni le Doppler spectral ne parviennent à mettre en évidence de flux circulant, malgré l’utilisation de réglages adéquats.
Limites liées à l’environnement du vaisseau
Il existe de nombreux obstacles potentiels à la pénétration des ultrasons dans les tissus. Si ceux-ci sont interposés entre la sonde d’échographie et la zone d’intérêt, les renseignements fournis par l’examen peuvent être incomplets voire absents. En pratique, l’existence d’un œdème ou d’un hématome sous-cutané, de modifications tissulaires cicatricielles après une chirurgie ou une radiothérapie locale peuvent entraîner une absorption telle de l’énergie ultrasonore qu’il devient impossible de définir correctement l’état des vaisseaux. Ceci vaut pour l’ensemble des vaisseaux, mais la gêne est d’autant plus importante que les vaisseaux sont profonds et que l’extension des obstacles est telle qu’un changement de plan de coupe ou de voie d’abord ne peut en venir à bout. En ce qui concerne l’abdomen, en plus des difficultés retrouvées dans l’ensemble des territoires, il existe très souvent une altération du faisceau ultrasonore liée à l’existence d’un pannicule adipeux épais ou à l’interposition d’anses intestinales. Quant aux vaisseaux intracérébraux, la principale limite à leur exploration est liée aux caractéristiques de l’écaille temporale. La « fenêtre » temporale est en effet souvent étroite, en particulier quand l’âge augmente et qu’il s’agit d’un patient de sexe féminin. Les individus de race noire ou asiatique, même jeunes, ont très souvent une écaille temporale épaisse limitant considérablement l’exploration des vaisseaux. Cependant, même dans les cas favorables, l’examen est rarement exhaustif(2). On peut en général enregistrer le flux dans les segments proximaux des principales artères cérébrales ainsi que dans la partie distale du siphon carotidien. Les sténoses athéromateuses ou les occlusions proximales de l’artère cérébrale moyenne sont donc le plus souvent détectées mais les lésions situées sur des segments plus distaux échappent presque toujours à un examen standard. De la même façon, dans un contexte d’hémorragie méningée, certaines zones, pourtant fréquemment concernées par le vasospasme comme l’artère cérébrale antérieure dans son segment distal, sont d’accès très difficile. Dans le territoire postérieur, l’exploration par voie sous-occipitale permet en général d’enregistrer les artères vertébrales dans leur segment V4 et l’artère basilaire dans sa portion initiale, mais l’exploration de l’artère basilaire distale est presque toujours impossible(3).
Apports de l’échographie vasculaire de contraste
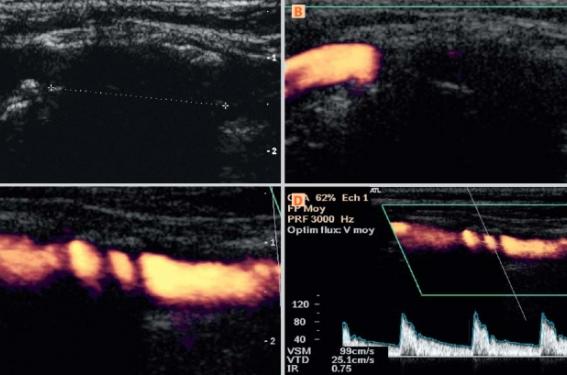
L’utilisation d’un agent de contraste ultrasonore, en renforçant le signal en provenance du sang circulant, permet de reculer les limites préalablement citées, à savoir qu’un vaisseau très profond, un vaisseau masqué par un obstacle pariétal (figure 1), sous-cutané ou intra-abdominal, un vaisseau ou un segment de vaisseau où le flux circulant est très réduit ou ralenti peuvent alors être visualisés dans la quasi-totalité des cas. Ainsi la quantification des sténoses artérielles devient presque toujours réalisable, même dans les cas difficiles, avec l’aide d’un agent de contraste, et ce quel que soit le territoire(4). De même, la détection des flux devient possible dans le chenal résiduel d’une sténose très sévère ou dans le faux chenal d’une dissection.
Figure 1. Plaque calcifiée longue, aucun signal Doppler à l’examen standard (A, B). Après injection d’un petit volume de SonoVue®, le chenal est correctement visualisé même s’il persiste quelques ombres acoustiques (C) et le flux analysable (D). DR
L’utilisation des PCUS impose cependant une phase d’apprentissage pour que, en fonction de l’importance de l’obstacle et de la profondeur du vaisseau, en fonction de l’indication de l’examen et des informations recherchées, l’utilisateur choisisse les modalités adéquates. L’importance et la durée du renforcement du signal en provenance du vaisseau dépendent à la fois des caractéristiques du patient, de l’importance de l’obstacle en présence, des caractéristiques de l’agent de contraste utilisé, de la dose utilisée et du type d’administration. En mode Doppler, une injection rapide, surtout si l’obstacle n’est pas trop important, a par exemple le désavantage d’entraîner une phase initiale de renforcement excessif du signal en provenance du vaisseau, à l’origine d’artéfacts de saturation rendant impossible toute interprétation. Dans ces conditions en effet, le signal Doppler couleur ou puissance déborde largement des limites du chenal circulant et même de celles du vaisseau, et l’enveloppe spectrale présente de très nombreuses irrégularités. Lorsque l’injection est plus lente, ces artéfacts sont réduits ou absents avec par conséquent un temps de renforcement efficace plus long. Ces contraintes sont réelles lorsque l’on utilise le contraste avec un mode Doppler standard, mais n’existent plus lorsque l’on privilégie, comme on le fait actuellement dans la majorité des cas, l’usage des PCUS avec celui d’une modalité spécifique d’imagerie. L’utilisation d’un mode dédié facilite l’examen dans les indications courantes mais ouvre surtout la porte à une série d’applications nouvelles dans la mesure où elle permet de bénéficier des qualités de résolution de l’imagerie bidimensionnelle, bien supérieures à celles des modes d’imagerie Doppler. En fin d’examen cependant, lorsque la concentration en PCUS a diminué, et si on a besoin d’informations sur le sens du flux, on réalise alors un enregistrement Doppler dans de bonnes conditions.
Applications en pathologie neurovasculaire
Le domaine clinique dans lequel l’extension du champ d’applications de l’échographie vasculaire doit le plus à l’usage des PCUS est pour l’instant la pathologie neurovasculaire. C’est également le seul domaine où l’utilisation des agents de contraste est clairement recommandée(1). Quelle que soit l’indication de l’écho-Doppler transcrânien (EDTC), on aura recours à l’injection d’un agent de contraste lorsque la fenêtre acoustique est mauvaise et que les structures anatomiques sont mal visualisées en 2D, ou lorsqu’il est nécessaire d’effectuer une exploration exhaustive des artères intracrâniennes. En pratique, on injecte par voie intraveineuse un bolus de 1 à 2 ml de SonoVue® (il est possible d’injecter jusqu’à 4,8 ml selon l’importance de l’obstacle et du nombre de données à acquérir), puis un bolus de 10 ml de sérum physiologique, après avoir optimisé le plan de coupe d’intérêt et l’image.
L’injection d’un agent de contraste rend possible l’examen des artères intracérébrales chez pratiquement tous les patients. L’identification des variantes anatomiques, extrêmement fréquentes et diverses au niveau du polygone de Willis, devient possible en échographie de contraste, ce qui facilite grandement l’interprétation adéquate des examens. L’utilisation du contraste permet également une exploration plus complète des artères cérébrales, bien au-delà de leur segment proximal, ce qui autorise un examen plus exhaustif, indispensable dans de multiples circonstances.
Les indications courantes comme l’analyse du retentissement hémodynamique d’une sténose athéromateuse ou d’une dissection carotide ou vertébrale, ou la détection des lésions intracéré brales, sont du ressort de tous les médecins vasculaires. Dans ces situations cliniques fréquentes, l’apport de l’EDTC dans la prise en charge du patient est très important car l’objectif de l’examen [examen standard de référence, de niveau 2 selon les critères de la Société Française de Médecine Vasculaire (SFMV)] est de fournir un descriptif lésionnel précis et une évaluation de la qualité du polygone de Willis et de la collatéralité mise en jeu. Le risque ischémique du patient est en effet maximal quand il n’existe pas de collatéralité intracrânienne et il diminue avec le nombre de collatérales mises en jeu(5,6). En présence d’un cercle de Willis complet et à la condition que les artères suppléantes soient exemptes de lésions, le risque ischémique avoisine zéro. L’EDTC est cependant sous-utilisé en pratique, sans doute en raison des difficultés techniques souvent rencontrées en l’absence d’injection de PCUS.
L’avantage majeur de l’échographie de contraste est qu’elle permet presque toujours d’atteindre l’objectif de l’examen et de réaliser une exploration complète du polygone de Willis et des branches impliquées dans les suppléances. Cette évaluation peut être d’une aide précieuse pour le traitement, par exemple en cas de mise en évidence d’anastomoses piales dont l’efficacité dépend d’un maintien de la pression artérielle à un niveau supra normal.
Au total, en matière de pathologie athéromateuse, l’utilisation des agents de contraste permet une évaluation plus complète du retentissement des lésions artérielles localisées à l’étage cervical et autorise la détection et l’analyse de lésions intracrâniennes éventuellement associées, la connaissance de ces éléments étant capitale pour une prise en charge optimale du patient (figure 2).
Figure 2. A. Sténose très serrée proximale et très courte de l’ACM en mode couleur. Accélération focale majeure des vitesses à l’origine du segment M1, persistance d’une zone de repliement spectral en dépit du réglage élevé de la PRF. Détection possible uniquement après injection d’un agent de contraste. Renforcement intense du signal, le signal doppler couleur déborde des limites du vaisseau et l'enveloppe spectrale présente de très nombreuses irrégularités mais le diagnostic peut être adéquatement posé. B. Sténose très serrée proximale de l’ACM en EDTC avec enregistrement spectral. Accélération importante des vitesses : VMS à 430 cm.s- 1, VTD proche de 220 cm.s- 1, et TAMX proche de 290 cm.s- 1, soit une sténose estimée entre 90 et 95 % en doppler et qui sera confirmée en angioscanner. DR
Indications urgentes : le diagnostic d’occlusion d’une artère intracrânienne est très difficile en conditions basales, en particulier en raison des nombreuses variantes anatomiques possibles du polygone. L’échographie de contraste permet de l’établir avec une sensibilité maximale et d’excellentes corrélations avec les autres modalités d’imagerie (figure 3)(2). Plusieurs auteurs suggèrent donc d’utiliser d’emblée l’échographie de contraste dans ce contexte. Elle permet également de surveiller adéquatement, et au lit du patient ce qui est un avantage important à souligner, la recanalisation sous traitement.
Il semble que l’application des ultrasons, surtout lorsqu’elle est associée à l’utilisation d’un PCUS, puisse amplifier les effets de la thrombolyse, accélérer la lyse du caillot et induire ainsi une réduction plus importante de la zone d’ischémie. Les données des expérimentations sur l’animal sont très encourageantes(7). Les études chez l’homme sont encore peu nombreuses, la technique optimale reste discutée et il est donc pour l’instant prématuré d’en recommander l’usage(8).
Figure 3. Infarctus sylvien superficiel gauche. Thrombose de l’ACM : absence complète de flux dans le territoire sylvien gauche. L’EDTC est réalisé en mode puissance avec injection d’un agent de contraste. DR
Il existe par ailleurs des indications plus rares et spécifiques mais cependant très importantes en pratique comme la détection des lésions drépanocytaires (recommandation de Type A, Classe 1 de l’ American Academy of Neurology), la surveillance du vasospasme (même niveau de recommandation), la surveillance des anévrysmes (recommandation de Type B, Classe 2 de l’AAN) et des malformations artérioveineuses, indications auxquelles s’ajoute le diagnostic de la mort cérébrale pour ceux qui travaillent en milieu de réanimation(9).
Dans ces indications plus spécialisées, il s’agit de réaliser un EDTC de niveau 3, selon les critères de la SFMV, soit un examen détaillé, s’intéressant non seulement aux différents segments du polygone de Willis mais également aux branches principales des artères qui le constituent. L’EDTC doit alors permettre l’analyse exhaustive, anatomique et hémodynamique des différentes artères pour un bilan lésionnel complet, ce qui implique l’injection quasi systématique d’un PCUS et l’utilisation de séquences spécifiques d’imagerie. En termes d’anévrysme intracérébral par exemple, la capacité de détection s’est très nettement améliorée avec l’utilisation du contraste, rendant possible la détection de petits anévrysmes même localisés dans des territoires d’accès très difficile en conditions basales (figure 4)(2,4). Ainsi, dans les équipes spécialisées, l’EDTC de contraste prend progressivement sa place dans le suivi des anévrysmes traités par voie endovasculaire ou chirurgicale puisque l’évaluation de la taille du sac anévrysmal, l’étude du flux au sein du sac et la détection des thrombus deviennent possibles (figure 5). La détection des vasospasmes localisés devient également réalisable ce qui permet d’éviter des artériographies itératives chez des patients fragiles et difficilement transportables. De la même façon, le nombre d’examens invasifs peut être diminué dans la surveillance des malformations artérioveineuses(2).
Figure 4. A. Anévrysme de l’artère communicante antérieure. EDTC en mode puissance avec injection de contraste. B. Angiographie. C. Angiographie avec reconstruction 3D. DR
Figure 5. A. Anévrysme géant de la terminaison de la carotide. EDTC en mode harmonique avec injection d’un agent de contraste. Flux hétérogène dans le sac, rapide à sa partie antérieure, plus lent au centre et défaut de remplissage de la partie distale qui correspond à du thrombus. B. Angiographie. DR
Applications en pathologie abdominale
Pathologie aortique aiguë
Même si la tomodensitométrie (TDM) est l’examen de référence en termes de pathologie abdominale aiguë, il peut se révéler important pour l’examen d’un patient au lit en situation critique de disposer à la demande d’un outil non invasif et efficace, permettant un diagnostic rapide. Ceci vaut également pour les patients en insuffisance rénale sévère ou allergiques aux agents de contraste et pour lesquels existe donc une contre-indication. Dans ce contexte, l’échographie avec injection de PCUS et utilisation d’un logiciel dédié se révèle nettement plus efficace que l’échographie standard dont elle permet presque toujours de s’affranchir des limitations classiques. Les indications les plus fréquentes sont la recherche de signes de dissection aor tique (le faux chenal peut être facilement identifié en échog raphie de contraste, en raison de l’apparition retardée des microbulles/vrai chenal et la visualisation de la membrane de dissection est grandement facilitée) et de complications d’un anévrysme de l’aorte abdominale (rupture couverte, fistule aorto-cave en par ticulier)(10,11). Même si cela n’a pas fait l’objet de multiples publications, les services rendus au quotidien sont fréquents entre des mains expérimentées et les corrélations avec le scanner excellentes.
Ainsi, l’échographie de contraste est utilisée comme une alternative à la TDM lorsque les patients présentent une contre-indication ou sont trop instables pour être déplacés, mais elle peut aussi être utilisée en complément (recherche de thrombose d’une branche viscérale ou d’une altération de la perfusion rénale en cas de dissection, contrôle après traitement par exemple)(11).
Surveillance des endoprothèses aortiques
Les endoprothèses aortiques sont de plus en plus souvent utilisées dans le traitement des anévrysmes de l’aorte abdominale (AAA). Elles le seront d’autant plus que les dernières recommandations (HAS, novembre 2009) permettent désormais de les proposer en première intention et quel que soit le niveau de risque de la chirurgie.
Malgré une amélioration très sensible des matériaux implantés, des anomalies peuvent cependant advenir et il est donc nécessaire de réaliser une surveillance régulière. En France, l’échographie vasculaire n’est recommandée qu’en cas de contre-indication au scanner. On constate cependant que dans les centres experts, en France mais aussi à travers le monde, la pratique est différente de celle recommandée. De nombreuses équipes utilisent en effet l’échographie de contraste pour la surveillance des endoprothèses, parce que ses performances, à moindre risque pour les patients et à moindre coût, atteignent celles de la TDM. À la condition de coupler contraste et imagerie non linéaire et de respecter certaines précautions, l’échographie est en effet un outil très efficace pour le dépistage et l’analyse des endofuites(12,13) (figure 6). Les performances de l’échographie sont donc maintenant reconnues, mais un consensus reste à trouver sur la place respective des différents examens d’imagerie dans la surveillance des patients(14).
Figure 6. Endofuite de type 2 (★) en provenance d’une artère lombaire chez un patient récemment traité (en raison du délai court/intervention, le thrombus dans le sac anévrysmal est encore très hétérogène). DR
L’échographie 2D permet de mesurer le calibre anévrysmal (diamètre maximal antéropostérieur), qui est le critère majeur de la surveillance, et l’utilisation des agents de contraste permet de détecter avec une très grande sensibilité la présence d’une endofuite. La sensibilité de l’échographie de contraste pour la détection des endofuites semble même meilleure que celle du scanner dans certaines fuites à flux lent(11,13). Ces 2 modalités d’imagerie ne doivent pas être mises en concurrence, elles peuvent être utilisées en alternance ce qui permet de limiter l’irradiation des patients et les conséquences sur la fonction rénale. De plus, leur complémentarité est précieuse dans certains cas pour préciser le type de fuite quand il est mal défini par l’examen utilisé en première intention, quel qu’il soit.
L’endofuite est une complication assez fréquente après pose d’endoprothèse, elle entraîne une absence d’exclusion de l’anévrysme et nécessite donc une cor- rection thérapeutique, tout au moins lorsqu’elle entraîne une croissance du sac anévrysmal, le traitement des petites endofuites sans retentissement sur le ca- libre étant discutable. Elle peut être détectée au 1er contrôle post-opératoire mais peut aussi apparaître secondairement, ce qui justifie une surveillance à long terme. Quoi qu’il en soit, on ob- serve alors un flux circulant à l’intérieur du sac dont la localisation dépend du type de l’endofuite et dont l’extension dans le sac varie en fonction de son importance. En pratique, on réalise d’abord un repérage des structures et un examen standard avec mesure du diamère antéro-postérieur de l’anévrysme en 2D et vérification de la perméabilité du montage en Doppler. L’injection d’un bolus de Sonovue® est suivie d’un balayage en coupe transverse (2D avec logiciel contraste) sur toute la longueur du sac anévrysmal pendant la phase artérielle et en phase tardive pour détecter les endofuites à flux lent. L’utilisation de plans de coupe dans le grand axe aortique peut être nécessaire pour bien visualiser l’extension complète du trajet de l’endofuite et pour en préciser le mécanisme s’il n’a pas été élucidé lors du balayage transverse. Une séquence de destruction-reperfusion peut éventuellement être réalisée dans les cas douteux. On termine le plus souvent l’examen par un enregistrement en mode Doppler couleur pour confirmer le sens des flux, certaines endofuites se caractérisant par une seule porte d’entrée-sortie, d’autres par une entrée via une collatérale et une sortie par une autre. La quantité de microbulles circulantes, à distance de l’injection, est alors moins importante et il est en général facile de se débarrasser des artéfacts liés à l’excès de signal en diminuant simplement le gain du Doppler.
Dans la plupart des équipes expérimentées, l’échographie de contraste est réalisée :
- systématiquement dans la période post-opératoire ou après le traitement d’une complication (examen de référence) (figure 6) ;
- au cours de la surveillance :
• lorsqu’il n’y a pas de régression du calibre de l’anévrysme, ou a fortiori si une croissance du calibre est observée ;
• lorsque l’échographie 2D met en évidence une modification des caractéristiques du thrombus ;
- en tout temps lorsqu’une endofuite est détectée pour en préciser les caractéristiques.
Développements futurs
Étude de la néovascularisation de la plaque
Les caractéristiques de la plaque d’athérome conditionnent en bonne partie le risque embolique qui dépend bien sûr aussi des contraintes mécaniques s’exerçant sur elle, et donc du degré de sténose. L’analyse échographique précise des lésions apporte donc une aide précieuse à la stratification individuelle du risque. Il n’existe cependant pas de critère échographique spécifique permettant d’identifier telle ou telle lésion histologique(15). L’étude de la néovascularisation de la plaque est une technique nouvelle qui permet d’obtenir une information complémentaire. En effet, on sait que la prolifération des vasa vasorum adventiciels est liée au processus inflammatoire, aux phases évolutives de la plaque et qu’elle témoigne de sa vulnérabilité. La détection de ces microvaisseaux pariétaux est devenue possible grâce à l’utilisation de l’échographie de contraste et des séquences dédiées d’imagerie (figure 7)(16,17). Dans un avenir proche, elle pourrait être intégrée à l’examen des axes carotidiens en présence d’une plaque suspecte(18).
Figure 7. Plaque hypoéchogène située à l’origine de l’artère carotide interne. Injection d’un agent de contraste ultrasonore : rehaussement de la plaque débutant 4 secondes après le rehaussement de la lumière. DR
Perfusion cérébrale
L’étude de la perfusion cérébrale avec l’échographie de contraste a pour l’instant fait l’objet de très peu de travaux comparativement à ce que l’on peut observer dans d’autres territoires. Ceci est très probablement lié à l’interposition de l’écaille temporale, obstacle d’importance variable comme on le sait en fonction des individus et ne laissant pas forcément accès à l’ensemble du parenchyme cérébral. L’examen est codifié, il est réalisé par voie temporale homolatérale à la lésion ischémique. Après avoir optimisé l’image en mode B dans le plan de référence, on injecte un bolus de 2,4 ml de SonoVue® (qui pourra être suivi si besoin d’un deuxième bolus équivalent). L’orientation du plan de coupe peut être modifié à la recherche de la zone lésée. Les expérimentations sur l’animal ont démontré l’intérêt et la faisabilité de la technique(19), chez l’homme, l’usage en est encore peu répandu sauf chez des patients porteurs d’un traumatisme crânien chez lesquelles on réalise une craniectomie de décompression. Dans ces cas bien sûr, l’accès au parenchyme est aisé et l’échographie de contraste très efficace et appropriée à l’étude de l’extension des anomalies de perfusion et de son évolution sous traitement, à la fois au bloc opératoire et au lit du patient(20). Il existe cependant des précautions particulières à prendre dans cette situation où le parenchyme cérébral, en l’absence d’os crânien intact, est directement exposé aux effets biologiques des ultrasons et aux interactions entre les ultrasons et les microbulles. L’index mécanique et l’index thermique doivent donc être maintenus au plus bas.
La technique d’utilisation du contraste en échographie vasculaire doit être choisie en fonction des indications de l’examen. Dans le cas où l’on cherche simplement à obtenir un renforcement du signal intravasculaire sur une lésion isolée, on utilise l’injection d’une petite quantité d’un agent de contraste ultrasonore couplée à l’utilisation d’un mode Doppler conventionnel. Dans tous les autres cas, il faut utiliser des séquences spécifiques d’imagerie. C’est en effet l’utilisation de l’imagerie non linéaire couplée à l’injection d’un agent de contraste qui a rendu possible l’essor de nouvelles applications en échographie vasculaire. Quoi qu’il en soit, il existe une courbe d’apprentissage des examinateurs, indispensable à l’utilisation optimale de l’échographie de contraste vasculaire.
Quel que soit le territoire considéré et quelle qu’en soit l’indication, l’utilisation appropriée des agents de contraste tend à améliorer la performance globale de l’ultrasonographie vasculaire ainsi que son objectivité, puisque la reproductibilité inter-observateur et les corrélations avec les autres modalités d’imagerie sont clairement améliorées. Associée à l’imagerie de référence, l’échographie de contraste peut souvent apporter des renseignements complémentaires utiles à une prise en charge optimale des patients. Dans certaines applications, elle peut même se substituer à l’imagerie de référence. Le champ des applications de l’échographie de contraste vasculaire n’est pas clos et des avancées importantes en pratique, comme l’étude de la néovascularisation des plaques carotides, devraient se développer dans un avenir proche.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :