Explorations-Imagerie
Publié le 09 fév 2024Lecture 9 min
Comment explorer une masse intracardiaque ?
Catherine SZYMANSKI, Hôpital Necker, service de cardiologie adultes, Paris ; UFR Simone Veil-Santé, Université Versailles-Saint-Quentin
Les masses intracardiaques sont des structures anormales immédiatement adjacentes à une structure cardiaque. Elles sont représentées par les tumeurs, les thrombus et les végétations. Les tumeurs cardiaques sont bénignes dans 75 % des cas et sont des myxomes dans près de la moitié des cas. L’échocardiographie (ETT, souvent complétée d’une ETO) permet de faire le diagnostic positif de la masse et de préciser ses caractéristiques et son aspect (échogénicité, caractère mobile, calcifié, circulant…), sa localisation, son extension, ses dimensions, son retentissement hémodynamique et de tenter d’évaluer son risque embolique.
Conditions d’examen
• Multiplier les incidences et les modalités (TM, 2D, 3D…) pour éliminer un artéfact.
• Nécessité d’une imagerie d’excellente qualité avec une haute fréquence et une focale courte.
• Analyse de la masse tout au long du cycle cardiaque.
• Diagnostic différentiel avec les structures anatomiques normales (tableau 1).
• Ne pas hésiter à recourir à l’échrographie transœsophagienne (ETO) et aux imageries complémentaires :
– scanner et/ou IRM cardiaques (peu performants pour les masses implantées sur les valves) : meilleure caractérisation tissulaire, recherche de rehaussement et de vascularisation, évaluation d’une éventuelle extension extracardiaque ;
– TEP-scanner : si suspicion de tumeur maligne.
Tumeurs cardiaques primitives bénignes
(tableau 2)
OD : oreillette droite ; OG : oreillette gauche ; SIV : septum interventriculaire ; VG : ventricule gauche
L’échocardiographie ne permet que de suspecter la nature d’une tumeur (« l’aspect à l’écho évoque… »), qui est identifiée par l’histologie.
Myxome
(figure 1)
Figure 1. Myxomes. A. Volumineux myxome de l’oreillette gauche s’enclavant dans la valve mitrale. B. Myxome appendu au versant auriculaire de la valve mitrale. C. Volumineux myxome s’enclavant dans la valve mitrale et responsable d’une sténose mitrale (aliasing).
• Épidémiologie :
– 27 % des tumeurs cardiaques primitives, 50 % des tumeurs bénignes ;
– âge de survenue le plus souvent 30-60 ans, possibles formes familiales à transmission autosomique dominante (signes associés fréquents : pigmentation cutanée anormale, myxome cutané, néoplasie endocrinienne).
• Localisation :
– 75 % oreillette gauche (OG) (figure 1A), souvent au niveau de la fosse ovale ;
– 15-20 % oreillette droite (OD) ;
– beaucoup plus rarement : VG, VD ou même au niveau d’une valve (figure 1B) ;
– unique dans plus de 90 % des cas, mais parfois multiples.
• Aspect :
– souvent arrondi, avec un aspect gélatineux ;
– lisse ou irrégulier avec aspect « friable » ;
– pédicule court à base d’implantation large rattaché le plus souvent au SIA ;
– mobile ;
– possibles zones de calcifications, d’hémorragie ou de nécrose ;
– taille très variable (le plus souvent 3-6 cm, parfois beaucoup plus volumineux).
• Présentation clinique :
– asymptomatique (découverte fortuite) ;
– AVC ;
– signes fonctionnels cardiologiques : dyspnée, malaise ou palpitations.
• Complications :
– sténose mitrale (figure 1C)/insuffisance mitrale (IM) ;
– embolies systémiques +++ (circonstance de découverte fréquente).
• Examens complémentaires :
– ETO pour compléter le bilan : site d’insertion, exclure une localisation multiple et une implication valvulaire, vérifier en postopératoire l’excision complète ;
– échocardiographie de contraste (rarement réalisée) : rehaussement hétérogène.
• Prise en charge :
– habituellement, exérèse chirurgicale systématique ;
– suivi essentiel, car risque de récidive (surtout dans les formes familiales).
• Diagnostics différentiels :
– thrombus ;
– autres tumeurs bénignes ou malignes.
Fibroélastome papillaire
(figure 2)
Figure 2. Fibroélastome. A. Fibroélastome appendu au versant aortique d’une bicuspidie aortique. B. Fibroélastome appendu au versant auriculaire du feuillet mitral antérieur. C. Fibroélastome appendu au septum basal. D. Pièce macroscopique de la figure 2C, aspect en « anémone de mer ».
• Épidémiologie :
– prévalence inconnue, car souvent asymptomatique ;
– âge de découverte : généralement > 50 ans ;
– cause fréquente de tumeur bénigne.
• Localisation :
– essentiellement valvulaire (figures 2A et 2B), rarement non valvulaire (figure 2C) ;
– valve aortique (versant aortique) (figure 2A) > valve mitrale (versant atrial) (figure 2B).
• Aspect :
– évoque souvent une végétation valvulaire (figure 2), mais contexte clinique différent et habituellement pas de fuite valvulaire ;
– dense, homogène, bien délimité ;
– rond ou ovale ;
– souvent pédiculé (tige courte) ;
– plus ou moins mobile et vibratile ;
– aspect macroscopique en « anémone de mer » (figure 2D) ;
– unique dans plus de 90 % des cas ;
– taille : le plus souvent 8- 20 mm (souvent < 1 cm).
• Présentation clinique :
– asymptomatique (découverte fortuite fréquente) ;
– AVC.
• Complications :
– embolies systémiques.
• Examens complémentaires :
– ETO : recherche d’autres localisations.
• Prise en charge :
– discutée : au cas par cas (surveillance/traitement antiagrégant-anticoagulant/exérèse chirurgicale) ;
– ne pas hésiter à demander un avis spécialisé (peu de données dans la littérature, conduite à tenir controversée) ;
– orientation plutôt vers une chirurgie en cas de taille importante (> 1 cm) chez un patient ayant déjà « embolisé ».
• Diagnostics différentiels :
– nodule d’Arantius ;
– strand, excroissance de Lambl.
Lipome
• Épidémiologie :
– cause rare de tumeur bénigne.
• Localisation et aspect :
– masse graisseuse, encapsulée, homogène, sphérique ou ovoïde, unique, immobile ;
– hyperéchogène ;
– sous-endocardique ou péricardique.
• Présentation clinique et complications :
– asymptomatique de découverte fortuite ;
– possibles arythmies selon la localisation.
• Examens complémentaires :
– ETO si doute : masse hyperéchogène comportant parfois des échos linéaires en son sein.
Fibrome
• Épidémiologie :
– rare ;
– enfant dans plus de 80 % des cas (souvent avant 10 ans).
• Localisation et aspect :
– localisation intramyocardique (SIV, paroi postérieure du VG) (figure 3) ;
– tumeur arrondie, souvent hyperéchogène, calcifications centrales fréquentes ;
– unique ;
– taille : le plus souvent 2-10 cm +/- saillant dans la cavité.
Figure 3. Fibrome de la paroi latérale du ventricule gauche.
• Présentation clinique et complications :
– asymptomatique, de découverte fortuite ;
– possibles arythmies selon la localisation.
Rhabdomyome
• Épidémiologie :
– tumeur développée aux dépens des cellules myocardiques ;
– première cause de tumeur cardiaque de l’enfant ;
– enfant dans 90 % des cas (souvent avant 5 ans) ;
– associé à une sclérose tubéreuse de Bourneville dans 50 % des cas ;
– parfois associé à des cardiopathies congénitales (communication inter-auriculaire [CIA], communication interventriculaire [CIV], transposition des gros vaisseaux…).
• Localisation et aspect :
– masses polypoïdes, arrondies, de taille variable (quelques millimètres à plusieurs centimètres) ;
– hyperéchogènes, intramurales, principalement ventriculaires (ETO peu intéressantes pour ces tumeurs), sensiblement plus brillant que le reste du myocarde ;
– multiples dans 90 % des cas.
• Présentation clinique et évolution :
– asymptomatique, de découverte fortuite (bilan de sclérose tubéreuse de Bourneville) ;
– importante proportion de rhabdomyomes involuant spontanément.
Tumeurs malignes primitives
Elles sont très rares (incidences 0,05 pour 1 000). Les causes sont dominées par les sarcomes, les lymphomes, les mésothéliomes et, chez les enfants, par les tératomes malins. L’infiltration myocardique et l’envahissement des cavités cardiaques sont la règle.
Sarcome
(figure 4)
Figure 4. Sarcome dans le ventricule droit. Aspect très hétérogène et infiltrant.
• Épidémiologie :
– rare ;
– la plus fréquente de tumeurs malignes primitives cardiaques de l’adulte ;
– âge de survenue : le plus souvent 30-50 ans, femme = homme.
• Localisation et aspect :
– pas d’aspect typique ;
– diagnostic reposant sur l’histologie, mais en général, aspect écho infiltrant, hétérogène, épanchement péricardique fréquent ;
– peut toucher toutes les cavités cardiaques ;
– angiosarcome : le plus fréquent, homme adulte, atteinte OD, 40 % des sarcomes. L’échographie transthoracique (ETT) met généralement en évidence un épanchement péricardique plus ou moins abondant et, inconstamment, une masse sessile, polypoïde, hétérogène et hyperéchogène dans l’OD ;
– rhabdomyosarcome : enfant, atteintes multiples en particulier valvulaires. L’ETT met fréquemment en évidence un épanchement péricardique et, inconstamment, une masse polypoïde intracavitaire, hyperéchogène ;
– sarcome indifférencié : surtout l’OG ;
– autres : ostéosarcome (veines pulmonaires), léiomyosarcome, fibrosarcome, liposarcome.
• Examens complémentaires :
– l’extension intra- et extra-cardiaque de la tumeur doit être précisée par d’autres examens d’imagerie (scanner, TEP-scanner).
• Pronostic :
– sombre.
Lymphome primitif cardiaque
(figure 5)
Figure 5. Lymphome cardiaque avec atteinte de la paroi latérale du ventricule gaucher, du septum interatrial et épanchement péricardique.
• Épidémiologie :
– rare (mais l’infiltration cardiaque des lymphomes extracardiaques est décrite dans 30 % des cas) ;
– sujets immunodéprimés (allogreffe, sida).
• Localisation et aspect :
– atteinte OD surtout (mais les 4 cavités peuvent être atteintes) ;
– lésions multiples avec infiltration nodulaire extensive du myocarde ;
– peut mimer une cardiopathie hypertrophique ;
– envahissement du péricarde, tamponnade fréquente.
Tumeurs malignes secondaires
(figure 6)
Figure 6. Métastase ventriculaire droite d’un cancer utérin.
• Épidémiologie :
– métastases 20 fois plus fréquentes que les tumeurs primitives ;
– néoplasie rare à très fort potentiel métastatique : mélanome, tumeurs germinales, thymomes ;
– néoplasie fréquente à potentiel métastatique modéré : poumon, sein, utérus, hémopathie maligne ;
– néoplasie fréquente à potentiel métastatique faible : prostate, thyroïde, système nerveux central, vessie, foie, côlon.
• Localisation et aspect :
– dissémination hématogène, ou extension locale (tumeurs thoraciques) ;
– aspect le plus souvent infiltrant ;
– localisation : péricardique 19 %, épicardique 30 %, myocardique 42 %, endocardique < 6 %.
• Caractéristiques suggérant la malignité :
– présence d’autres métastases ;
– présence d’un cancer primitif ;
– envahissement médiastinal ;
– croissance tumorale rapide ;
– hémopéricarde ou tamponnade ;
– douleurs précordiales, altération de l’état général ;
– localisation aux cavités droites avec ou sans extension dans les veines caves ;
– localisations combinées intramurale et intracavitaire ;
– extension aux veines pulmonaires.
Variantes anatomiques des structures intracardiaques normales
L’aspect échographique de ces structures (non pathologiques) est à connaître afin de ne pas faire de diagnostic erroné de tumeur.
• Crista terminalis : repli musculaire de la paroi latérale de la veine cave inférieure (VCI) à la VCS (figure 7A).
• Réseau de Chiari : reliquat embryonnaire, structure filamenteuse, ondulante, s’étend de la partie inférolatérale de l’OD jusqu’au SIA (figure 7B).
• Valve d’Eustachi : reliquat embryonnaire du sinus veineux droit, dirige le flux sanguin vers le FOP chez le fœtus, dans l’OD à l’abouchement de la VCI (figure 7C).
• Septum lipomateux ou hypertrophie lipomateuse du SIA : bénin, personnes âgées, parfois associé à une obésité, hypertrophie parfois très franche du SIA épargnant la fosse ovale (figure 7D).
Figure 7. Variantes anatomiques des structures intracardiaques normales. A. Crista terminalis. B. Réseau de Chiari. C. Valvule d’Eustachi. D. Hypertrophie lipomateuse du septum atrial.
Thromboses des cavités gauches
• Thrombus de l’oreillette et de l’auricule gauche (figure 8) :
– localisation : plus de 80 % dans l’auricule gauche.
– contexte : trouble du rythme supraventriculaire, sidération post-cardioversion, dilatation OG/auricule gauche, diminution des vitesses de vidange de l’auricule, contraste spontané, rétrécissement mitral, maladie mitrale, remplacement valvulaire mitral.
Figure 8. Thrombus de l’auricule gauche.
En ETO (intérêt du mode biplan) : permet une excellente analyse de l’oreillette gauche, en particulier de l’auricule gauche :
– à partir de la coupe centrée sur l’orifice aortique à 0 et 45°, en retirant légèrement la sonde en antéflexion et rotation horaire ;
– auricule gauche apparaît sous forme triangulaire à base supérieure et apex étroit inférieur, en avant de l’éperon de la veine pulmonaire gauche ;
– analyse de la vitesse de vidange et de remplissage auriculaires en Doppler pulsé à la base de l’auricule : flux biphasique, positif (vidange), puis négatif (remplissage), valeurs normales > 40 cm/s : une diminution de ces vitesses est en faveur d’un risque plus important de thrombose dans le massif auriculaire.
• Thrombus ventriculaire gauche :
– plus échogène que l’endocarde et myocarde ;
– localisation : surtout apex (figure 9A), zone akinétique (figure 9B) ;
– 2 formes : tapissant la paroi ou mobile ;
– contexte : souvent cardiomyopathie dilatée ou ischémique, dysfonction VG systolique sévère.
Figure 9. Thrombus apical du VG. A. Thrombus apical frais. B. Volumineux thrombus apical en zone akinétique.
Thromboses des cavités droites
Elles s’observent dans des contextes particuliers.
• Embolie pulmonaire :
– visualisation directe d’un thrombus des cavités droites (aspect souvent « serpentiforme », mobile), plus rarement dans l’artère pulmonaire ;
– dilatation des cavités droites et HTAP ;
– cathéters et sondes de stimulation cardiaque. Thrombus dans l’OD : extension de thrombose naissant sur le cathéter ou par contact mécanique du cathéter avec la paroi de l’OD ;
– fibrillation atriale avec dilatation de l’OD ;
– cas particulier : thrombus à cheval sur la cloison inter-auriculaire :
. thrombose provenant le plus souvent du réseau veineux pro fond (migration) enclavé dans un foramen ovale perméable fosse ovale, visible de part et d’autre du SIA dans l’OG et l’OD,
. peut se compliquer en embolie pulmonaire ou paradoxale en cas de FOP,
. contexte de phlébite et d’embolie pulmonaire.
Endocardite infectieuse/végétation
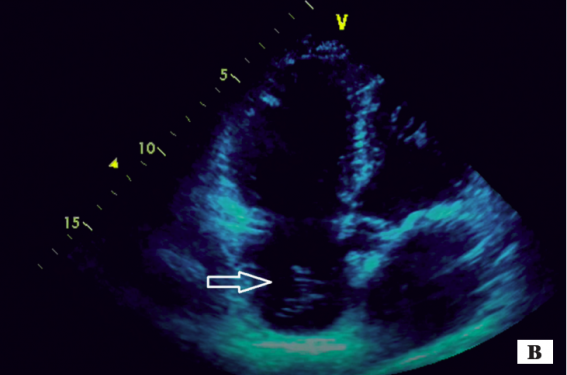
• Image d’addition valvulaire (figure 10).
Figure 10. Volumineuse végétation mitrale.
• Délabrement valvulaire, fuite valvulaire.
• Diagnostic différentiel : rupture de cordage, thrombus ou tumeur.
Nécrose caséeuse
• 1 % des calcifications annulaires mitrales.
• Masse nécrotique contenant une substance dense, amorphe, de consistance pâteuse entourée d’une coque calcifiée (figure 11).
Figure 11. Nécrose caséeuse au niveau de l’anneau mitral postérieur.
Kyste hydatique cardiaque
• Atteinte intramyocardique, péricardique ou oreillette gauche.
• Calcifiée, épanchement péricardique.
• Présence de kystes extracardiaques (hépatiques).
• Complications : rupture, emboles, arythmie.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :