Grand angle
Publié le 09 juin 2025Lecture 7 min
Infections de matériel endovasculaire
Xavier BÉRARD, Mathilde PUGES, service de chirurgie vasculaire et service de médecine infectieuse du CHU de Bordeaux ; Centre de référence des infections vasculaires du CHU de Bordeaux
L’infection d’un dispositif médical implantable (DMI) vasculaire est une complication rare mais grave, avec un risque d’amputation majeure si elle survient sur un membre, voire de décès à l’étage abdominal(1). Sa survenue en pathologie vasculaire est particulièrement redoutée en raison de la fragilité des patients atteints de nombreuses comorbidités et souvent plus âgés si l’on se compare aux cas d’infection de matériel ostéoarticulaire. Historiquement les infections de prothèses vasculaires ont occupé le devant de la scène, mais peu à peu celles survenant sur matériel endovasculaire, endoprothèse ou stent, sont logiquement apparues compte tenu du formidable essor de la révolution « endo first ». Nous vous proposons dans cet article de faire le point sur leurs critères diagnostiques et leur prise en charge.
Intuitivement, une ponction représente une faible source d’infection de site opératoire. Le risque d’infection, pour une chirurgie de revascularisation ouverte par patch et endartériectomie ou par pontage, est bien plus élevé en raison de la voie d’abord chirurgicale. En dehors d’un hématome ou d’un faux anévrysme surinfecté au point de ponction, le mécanisme de l’infection précoce n’est donc pas lié à la voie d’abord comme en chirurgie ouverte.
Cependant, malgré son caractère mini-invasif, le risque septique peropératoire persiste par défaut d’asepsie lors de la manipulation directe du dispositif médical implantable (DMI) sur le champ opératoire. Cela survient plus volontiers pour les stents et endoprothèses sertis sur ballon contrairement aux systèmes auto-expansibles qui sont protégés dans leur gaine. Les infections tardives sont le plus souvent de cause non procédurale et leur mécanisme peut être variable. La contamination hématogène lors d’une bactériémie représente le cas d’école : par exemple, un foyer dentaire, une arthrite septique ou une endocardite. Plus rarement, l’infection survient en raison d’une contamination de contact par inoculation d’un foyer septique provenant d’un organe ou d’une structure adjacente. Une fistule urétéro-iliaque au voisinage d’un stenting couvert de la bifurcation aortique étendu aux artères iliaques externes, une diverticulite sigmoïdienne abcédée dans un sac anévrismal exclus par une endoprothèse aortique pour anévrysme de l'aorte abdominale, un hématome de cuisse surinfecté proche d’une artère fémorale stentée sont des exemples.
Au-delà de ces mécanismes, notre communauté d’interventionnels a appris à demeurer vigilante au stade de l’ischémie critique avec trouble trophique, c’est probablement la menace de contamination précoce ou tardive la plus fréquente pour nos reconstructions endovasculaires.
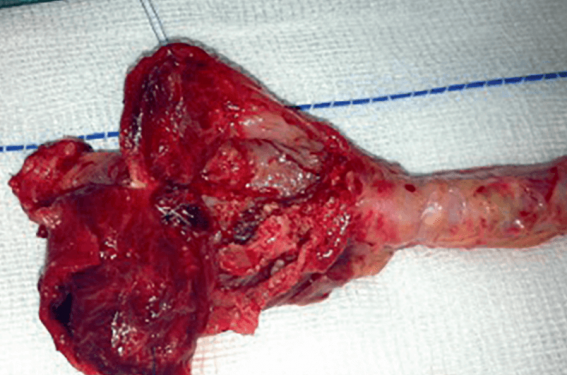
Fracture de stent avec pseudo-anévrysme infecté de l’artère fémorale.
Diagnostic d’une infection de matériel endovasculaire et prise en charge
Le diagnostic d’une infection de matériel endovasculaire diffère très peu de celui d’une infection d’une prothèse ou d’un patch. Au niveau des membres, l’infection d’un stent est moins bruyante cliniquement comparée à celle d’un patch ou d’une prothèse, dont les cicatrices opératoires vont se désunir et/ou le trajet de tunnelisation va rapidement devenir rouge et inflammatoire. C’est volontiers une évolution pseudoanévrysmale avec une masse battante dans un contexte septique qui va faire suspecter l’infection d’un stent ou d’une endoprothèse couverte. Au niveau abdominal, comme pour un tube prothétique aortique ou aorto-bi-iliaque, les signes cliniques sont souvent pauvres et c’est un tableau septique avec un examen vasculaire souvent normal qui devra éveiller l’attention du médecin interventionnel qui sait le patient porteur d’un DMI endovasculaire.
L'angioscanner représente l’examen de première intention, qui permet de vérifier l’intégrité du stent ou de l’endoprothèse, de rechercher d’éventuelles complications vasculaires et des signes directes d’infection comme une collection liquidienne plus ou moins associée à des bulles d’air (figure 1). En cas de doute diagnostique, il faudra recourir à l’imagerie nucléaire par TEP-scanner si l’implantation date de plus 3 mois, ou par scintigraphie aux leucocytes marqués si l’implantation est plus récente. En effet, le TEP-scanner a une excellente valeur prédictive négative mais de nombreux faux positifs sont liés à l’inflammation périopératoire ou en cas de thrombose ou d’endofuites. Cet examen permet en outre de retrouver le foyer septique responsable d’une infection hématogène, telle qu’une endocardite ou une spondylodiscite (figure 2). La documentation microbiologique est essentielle, en réalisant deux à trois paires d’hémocultures prolongées et en cas de collection profonde en recourant à des ponctions-drainages guidées par scanner ou échographie.
Figure 1. AngioTDM montrant une fistule entre le duodénum et un sac anévrysmal contenant une endoprothèse aortique avec cheminée.
Figure 2. TEP-scanner montrant une infection de stent fémoral associé à une spondylodiscite et une endocardite.
Dans le cas des endoprothèses aortiques, il faudra bien sûr au préalable éliminer la présence d’une endofuite avant de proposer une ponction d’un sac anévrysmal contenant des bulles d’air, voire un niveau hydroaérique(2). La documentation microbiologique reste inconnue dans 10 à 30 % des cas. Ainsi, les critères diagnostiques des infections de prothèses et d’endoprothèse vasculaires peuvent être divisés en composants cliniques, radiologiques et biologiques avec pour chacun des critères majeurs et mineurs. Le tableau sur le principe des critères MAGIC(3) reprend l’ensemble de ces éléments participant à établir le faisceau d’arguments en faveur de l’infection de matériel vasculaire(4).
Les recommandations de la Société européenne de chirurgie vasculaire et endovasculaire(1) insistent sur la nécessité d’une prise en charge multidisciplinaire en proposant une dépose du matériel infecté sans forcément revasculariser au niveau des membres si le patient n’est pas en situation d’ischémie critique. En revanche à l’étage abdominal, la revascularisation est nécessaire de préférence avec un matériel biologique en préférant une reconstruction in situ à un montage extra-anatomique ex situ par pontage axillo-bi-fémoral. La veine saphène est le substitut vasculaire de choix si un pontage du membre inférieur s’impose, mais son calibre la rend inappropriée au remplacement des vaisseaux aortoiliaques. Dans ce cas, les veines fémorales ou éventuellement le péricarde bovin tubulisé (figure 3) sont plus adaptés, le recours à des prothèses antimicrobiennes est parfois utile en cas de montage complexe comme lors d’une dépose d’endoprothèse fenêtrée infectée. Enfin, les allogreffes artérielles restent une alternative mais le risque de rupture septique précoce (lors d’une infection fungique ou à Pseudomonas spp) ou d’une dégénérescence tardive rendent leur usage plus à risque, en particulier pour des patients ayant une bonne espérance de vie. La couverture de la nouvelle reconstruction vasculaire peut nécessiter au membre inférieur la réalisation d’un lambeau musculaire ou musculocutané. Au niveau abdominal, une omentoplastie pédiculisée à travers le mésocôlon transverse, permet d’isoler le pontage par rapport au tube digestif. Elle favorise en outre la délivrance des antibiotiques dans l’espace rétropéritonéal, souvent dévascularisé par un debulking massif des tissus infectés.
Figure 3. Reconstruction aorto-bi-iliaque par péricarde tubulisé après dépose d’une endoprothèse aortique infectée.
En pratique
En pratique, suspecter une infection de matériel vasculaire doit être systématique pour tout patient avec du matériel et présentant une fièvre inexpliquée, un sepsis sévère ou une imagerie de contrôle révélant une collection liquidienne ou aérique de contact. La documentation microbiologique est la priorité, l’évaluation multidisciplinaire la règle. Ainsi, une décision collégiale basée sur la fragilité du patient, la sévérité de l’infection, la complexité du matériel implanté mais aussi les souhaits du patient clairement informé, permettra d’orienter la prise en charge vers une solution médicale ou vers une chirurgie d’explantation, plus ou moins associée à une reconstruction. Grâce aux prélèvements multiples, l’adaptation rapide du traitement probabiliste médicamenteux anti-infectieux est essentielle. La durée minimale est de 6 semaines en cas de traitement optimal et de dépose complète, parfois de 2 ans lors d’une fièvre Q par Coxiella burnetii. Une antibiothérapie prolongée à visée suppressive est nécessaire en cas de traitement médical conservateur seul ou après une chirurgie d’explantation partielle. Chez nos patients polypathologiques prenant souvent de nombreux médicaments, la surveillance de l’efficacité et de la bonne tolérance du traitement anti-infectieux au long court est capitale, le recours à un entretien de pharmacologie est utile pour les cas les plus complexes. Pendant 3 ans, les patients seront suivis grâce à des convocations régulières en hôpital de jour d’infectiologie, pour une évaluation clinique, biologique et par imagerie. Le TEP-scanner est précieux dans ce cas, en raison de son excellente valeur prédictive négative.
La meilleure prise en charge d’une infection repose encore sur sa prévention, au bloc opératoire bien sûr, mais aussi en éduquant nos patients (auto-examen des pieds, hygiène dentaire) et nos confrères, par exemple lors d’un geste d’extraction dentaire. L’antibioprophylaxie doit être administrée 30 à 60 minutes avant le geste invasif, avec de l’amoxicilline 2 g per os en première intention.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


