Publié le 07 sep 2010Lecture 7 min
Cardiomyopathie ischémique/non ischémique : quelle imagerie pour quel patient ?
P. COMMEAU, C. PARSAI, Ollioules et G. RIOUFOL, Lyon
Le Printemps de la cardiologie
Place de l’imagerie en coupe dans le SCA
L’imagerie en coupe (scanner coronaire 64 coupes et IRM cardiaque) a une place de plus en plus importante dans le diagnostic et le suivi de la cardiopathie ischémique. Néanmoins, son rôle reste controversé en présence de données encore limitées et s’appuie sur les recommandations d’un panel de sociétés américaines de médecine (JACC 2006). Malgré tout, il est souvent difficile pour le cardiologue traitant de s’y retrouver entre effet de « manche » médiatique et réalité scientifique.
Les études publiées pour la plupart comparent le scanner à la coronarographie conventionnelle en termes de diagnostic et d’identification des lésions pour déterminer spécificité, sensibilité, valeur prédictive positive, valeur prédictive négative de cette nouvelle technique, mais il manque une étude randomisée comparant les deux techniques dans des cas de figure bien définis pour déterminer la supériorité et la sécurité de l’une par rapport à l’autre.
Le scanner a des avantages tels sa facilité de réalisation sans ponction artérielle, ses très bonnes sensibilité et valeur prédictive négative, au prix d’une irradiation qu’il est impératif de maîtriser. Par contre, ses spécificités et valeur prédictive positive sont médiocres.
Ainsi, il semble judicieux de proposer le scanner coronaire lorsque l’on veut confirmer la normalité d’un réseau coronaire que l’on suspectait au préalable sur l’interrogatoire et l’examen clinique du patient par la faible prévalence de la maladie cardiovasculaire.
Dans ce cas, le coroscanner permet d’éliminer une coronaropathie de façon définitive et ainsi d’économiser de nombreux examens paracliniques (tels le test d’effort, l’écho de stress, la scintigraphie, etc.).
Dans les autres cas (probabilité intermédiaire et haute de maladie coronarienne), le coroscanner a peu d’intérêt en première intention et risque de ne conduire qu’à des procédures complémentaires multiples et onéreuses.
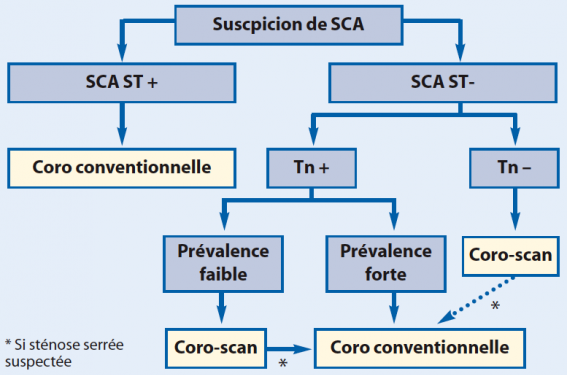
En cas de suspicion de SCA, seules deux études ont apprécié la place du coroscanner, plus particulièrement chez les patients à risque faible ou modéré (ROMICAT Trial, CT- STAT Trial). Dans cette population sélectionnée, le coroscanner fait gagner du temps et de l’argent sans faire prendre de risque aux patients. Ainsi, on peut proposer un algorithme décisionnel comme dans la figure.
Figure. Algorithme décisionnel.
Il faut bannir la réalisation du coroscanner en cas de suspicion de SCA chez le patient « stenté » ou « ponté » et chez le patient à forte prévalence de coronaropathie.
L’IRM cardiaque a par contre un grand intérêt en raison de son innocuité, de l’excellente résolution spatiale de l’imagerie ciné IRM en écho de gradient, de sa capacité d’identifier l’œdème intramyocardique et l’étude du rehaussement tardif myocardique après l’injection de gadolinium permettant de détecter les séquelles de nécrose.
Ainsi, après une coronarographie et un scanner coronaire normal, alors que la troponine est positive, elle permettra de différencier myocardite, syndrome de Tako-Tsubo et infarctus du myocarde à coronaires angiographiquement normales.
L’efficacité d’une revascularisation et le pronostic après un SCA ST + pourra être au mieux jugée par l’étude de la viabilité myocardique :
appréciation de l’étendue territoriale du rehaussement myocardique et de sa transmuralité. Ainsi, cet examen appréciera le pronostic à court, moyen et long termes du patient revascularisé. Le stress pharmacologique réalisé simultanément pourra confirmer, à faibles doses de dobutamine, la viabilité mais aussi rechercher, sous fortes doses de dobutamine, la nature ischémique des lésions non traitées lors la prise en charge initiale.
En pratique
Le scanner coronaire a sa place dans le cadre de la prise en charge du SCA en vue d’éliminer rapidement son origine coronarienne chez un patient à prévalence de maladie cardiovasculaire faible ou modérée et avec bas risque (ST-, Tn -).
Il n’a pas sa place dans l’évaluation d’un SCA ST+, ni dans l’évaluation de stent ou de pontage dans le cadre d’une suspicion de SCA quel qu’il soit.
L’IRM cardiaque est remarquable dans le diagnostic différentiel des SCA à coronaires saines et dans l’appréciation de la viabilité myocardique après revascularisation et donc dans l’évaluation du pronostic des patients revascularisés.
Quelle imagerie dans l’angor stable ?
À l’aune des études telles COURAGE ou 2D BARI, il est important de définir le caractère fonctionnellement significatif d’une lésion coronaire dépistée par des tests invasifs et confirmée par une imagerie. Ainsi, il est judicieux de déterminer les patients à risque afin de les traiter de la façon la plus adaptée.
L’appréciation fonctionnelle d’une sténose par l’étude de la FFR (Fractional Flow Reserve) au moyen d’un guide pression permet de constater que l’évaluation morphologique de la sténose, que ce soit par coronarographie ou au scanner coronaire a un très faible rendement. Il en est de même de l’étude isotopique qui, si on la compare à la FFR, surestime le degré de sévérité fonctionnelle d’une sténose dans 22 % des cas, et la sous-estime dans 36 % dans cas (JACC Interv 2010). Des études récentes concluent de façon identique pour l’écho de stress à la dobutamine (Eur Heart J 2008) et l’IRM mais à un moindre degré.
En fait, la présentation clinique avec le caractère typique de la douleur thoracique, la positivité du test à la trinitrine, la durée de la douleur et leur score de reproductibilité reste le marqueur essentiel de l’angor stable.
En pratique
Le luminogramme n’évalue pas correctement l’ischémie myocardique ;
Coronarographie et scanner coronaire ne sont pas adaptés au diagnostic de l’ischémie coronaire dans l’angor stable, à l’inverse de l’étude de la FFR ;
Les méthodes d’imagerie fonctionnelle restent encore imparfaites par manque de résolution, par défaut d’obtention d’une épreuve maximale, par manque d’accessibilité et par absence de réalisation ;
L’analyse clinique reste au premier plan.
Quelle imagerie dans les cardiopathies non ischémiques ?
Les cardiomyopathies non ischémiques regroupent les atteintes morphologiques et fonctionnelles du myocarde survenant en l’absence de maladie coronarienne, hypertensive, valvulaire ou congénitale pouvant expliquer le degré d’anomalie objective (ESC 2008, EHJ 2009).
Bien que l’échocardiographie transthoracique reste en première ligne, permettant de suspecter ces cardiomyopathies, l’IRM cardiaque représente un outil précieux et complémentaire dans leur évaluation.
Elle offre une aide au diagnostic mais fournit également des données pronostiques et la possibilité d’effectuer un dépistage familial sans irradiation, sans risque et de manière fiable en l’absence de contre-indication (pacemaker ou défibrillateur).
Par son excellente résolution spatiale, elle permet des mesures reproductibles (inter- et intra-observateurs) des volumes ventriculaires, masse et fraction d’éjection. De plus, l’épaisseur des parois myocardiques peut être mesurée précisément et dans tous les segments, améliorant la détection des formes apicales de la CMH, souvent mal visualisées en échocardiographie, et affinant le diagnostic de la non-compaction ventriculaire et d’anomalie de la cinétique segmentaire dans la dysplasie arythmogène du ventricule droit. Ses séquences de caractérisation tissulaire permettent la détection d’œdème intramyocardique (STIR) en présence de myocardite ou de sarcoïdose. Le fer intramyocardique peut être décelé et quantifié en cas de suspicion d’hémochromatose (séquences T2*).
Après injection de Gadolinium, la perfusion immédiate au repos et durant le stress pharmacologique est évaluée, permettant la détection d’une atteinte de la microcirculation (par exemple zones hypertrophiques dans la CMH).
Les séquences précoces après injection démasquent les thrombi intraventriculaires (zones d’hyposignal, ne se rehaussant pas, « noires ») alors que les séquences tardives décèlent les cicatrices d’infarctus ou la fibrose intramyocardique (zones d’hypersignal intramyocardiques, « blanches »).
La distribution du rehaussement tardif permet de distinguer la cicatrice d’infarctus de localisation sous-endocardique, de la fibrose de la cardiomyopathie dilatée de siège intramyocardique, au milieu de la paroi, de celle qui est sous-épicardique typique de la myocardite.
De plus, la présence de rehaussement tardif a une valeur pronostique. Dans la cardiomyopathie dilatée, elle est corrélée au risque de mort subite et d’arythmies ventriculaires, même après correction pour la fraction d’éjection (Wu et al, JACC 2008, Assomull et al. JACC 2006). Dans la CMH, les segments hypertrophiés démontrent de la fibrose dans 80 % des cas, aidant au diagnostic, mais ce sont aussi des prédicteurs indépendants de mortalité et de décharges par un DAI (Flett et al. Circ Cardiovasc Imaging 2009).
De manière unique, l’IRM, surtout par l’étude du rehaussement tardif, excelle dans le diagnostic et la détection de l’amylose cardiaque. En effet, le gadolinium suit la distribution des myofibrilles d’amyloïde et diffuse précocement dans l’espace interstitiel ainsi responsable d’un rehaussement tardif caractéristique, circonférentiel, d’aspect zébré, survenant précocement après injection. Cette distribution permet un diagnostic avec une sensibilité et une spécificité de 86 %, décelant une atteinte myocardique précoce (Ruberg et al. Am J Cardiol 2009, Syed et al. JACC Cardiovasc Imaging 2009).
En pratique
L’IRM cardiaque doit faire partie de l’évaluation d’une cardiomyopathie non ischémique.
Par la combinaison de séquences variées et en l’absence d’irradiation, elle assiste le diagnostic différentiel et procure des paramètres pronostiques et de dépistage.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :