Mise au point
Publié le 30 sep 2013Lecture 7 min
Myopathies et troubles du rythme cardiaque
K. WAHBI, Hôpital Cochin, Paris
Il existe un nombre important de myopathies, le plus souvent d’origine génétique avec une expression clinique familiale. Du fait de grandes similitudes de structure entre les muscles squelettiques et le tissu musculaire cardiaque, beaucoup de patients atteints de myopathies développent une atteinte cardiaque pouvant conditionner leur pronostic vital. Parmi ces complications, les troubles du rythme et conductifs occupent une place importante et peuvent être pourvoyeurs de morts subites ou d’accidents vasculaires cérébraux emboliques.
La physiopathologie, le « niveau » de risque rythmique, le type d’arythmies et par conséquent les stratégies de prise en charge diffèrent d’une pathologie à l’autre. Les informations à tirer de la littérature sont parfois pauvres et les recommandations des sociétés savantes européennes et américaines peu contributives car très générales, plaçant dans un fourre-tout des pathologies neuromusculaires pourtant différentes, avec des préconisations relativement imprécises.
Principes généraux de prise en charge
La prise en charge des arythmies est essentiellement fondée sur des études de suivi de cohortes de patients. Pour les pathologies à risque les plus fréquentes, comme la maladie de Steinert ou les laminopathies, cette prise en charge est relativement bien codifiée, avec un niveau de preuve proche de celui d’autres pathologies arythmogènes génétiques comme le syndrome de Brugada. Pour d’autres maladies plus rares, elle est empirique, basée sur une caractérisation la plus poussée possible du phénotype et une analyse détaillée des rares études, le plus souvent descriptives avec de faibles effectifs.
Les troubles conductifs
Ils sont une des complications les plus fréquentes des myopathies. Les pathologies les plus souvent concernées sont la maladie de Steinert, les laminopathies, certaines maladies mitochondriales (Kearns Sayre), les desminopathies et plus rarement la myopathie de Becker. Chacune de ces pathologies expose à un risque de mort subite par asystolie, principalement sur BAV complet, et justifie par conséquent de discuter l’implantation prophylactique d’un stimulateur, y compris chez les patients asymptomatiques, ou d’un défibrillateur chez les patients à risque de troubles du rythme ventriculaire concomittants. L’exploration électrophysiologique à la recherche de troubles conductifs infrahissiens trouve une place privilégiée dans ce contexte, un intervalle HV > 70 ms faisant discuter un appareillage. Cette attitude a été clairement validée dans la maladie de Steinert (stimulateur), avec un bénéfice prouvé sur la mortalité, ainsi que dans les laminopathies (défibrillateur), mais est utilisée de manière empirique dans les autres pathologies à risque.
Les troubles du rythme ventriculaire
Ces troubles survenant indépendamment de la présence d’une dysfonction ventriculaire gauche, sont fréquents dans les laminopathies et les desminopathies et sont plus rares dans la maladie de Steinert. Un défibrillateur est indiqué devant une tachycardie ventriculaire, mais aussi chez les patients ayant une indication à un stimulateur pour un trouble conductif, comme dans les laminopathies ou les desminopathies, du fait du risque rythmique très élevé. L’efficacité des antiarythmiques n’a jamais été évaluée dans ces pathologies.
Les troubles du rythme supraventriculaires
Ces troubles du rythme – fibrillation, flutter, tachysystolie – sont fréquents dans la maladie de Steinert, les laminopathies et les desminopathies. Plusieurs travaux ont montré un risque thromboembolique élevé, y compris en l’absence des facteurs de risque habituels, ce qui doit faire discuter au cas par cas un traitement anticoagulant oral, si le risque de chutes liées à la myopathie le permet. Nous disposons de données personnelles montrant une efficacité similaire à celle de la population générale de l’ablation du flutter auriculaire typique dans la maladie de Steinert. Le maniement des antiarythmiques, notamment de classe I, doit être effectué de manière très prudente du fait de la coexistence fréquente d’une hyperexcitabilité ventriculaire.
Maladie de Steinert
La maladie de Steinert ou dystrophie myotonique de type 1 (DM1) représente la cause la plus fréquente de maladie musculaire chez l’adulte, avec une incidence de 1/8 000, supérieure à celle de beaucoup de pathologies arythmogènes mieux connues des cardiologues. La mutation responsable est l’expansion anormale d’une séquence de triplets de nucléotides (CTG) dans le gène DMPK. Le tableau clinique associe un faciès souvent évocateur (ptosis, atrophie des muscles temporaux, alopécie frontale), une myotonie (lenteur anormale du relâchement musculaire), une faiblesse musculaire, une insuffisance respiratoire, un diabète ou une cataracte précoce.
Des troubles conductifs d’aggravation progressive sont présents chez 50 % des patients et représentent la manifestation cardiaque la plus fréquente de la maladie, devant les tachycardies atriales (7 %), les extrasystoles ventriculaires (15 %) et les troubles du rythme ventriculaires soutenus (1 à 2 %). Le risque de mort subite est élevé chez ces patients (1/3 des décès), avec une incidence de 0,5 à 0,8 %/an, compliquant le plus souvent des troubles conductifs sévères, et moins souvent des troubles du rythme ventriculaire, des embolies pulmonaires ou des complications respiratoires aiguës. La présence de troubles conductifs à l’ECG a été identifiée comme le principal facteur de risque de mort subite(1).
Plusieurs études françaises ont montré l’intérêt d’une prise en charge préventive basée sur la réalisation d’une exploration électrophysiologique endocavitaire chez les patients avec PR > 200 ms et/ou QRS > 100 ms et l’implantation d’un stimulateur si le HV est > 70 ms (figure 1). Une étude multicentrique française(2) a montré que les patients appareillés sur ces critères avaient un risque de 50 % à 5 ans de développer un BAV complet ou des pauses sévères. Plus récemment, notre équipe(3) a pu montrer, à travers l’analyse d’une cohorte de 914 patients, que cette stratégie était associée à une amélioration de la survie globale par le biais d’une réduction d’environ 70 % de l’incidence des morts subites. En dehors de la dysfonction ventriculaire gauche sévère et de troubles du rythme ventriculaires graves, la place de la stimulation ventriculaire programmée et les indications des défibrillateurs restent à codifier.
Figure 1. Un trouble conductif, même asymptomatique, justifie la réalisation d'une exploration électrophysiologique, en particulier pour évaluer la conduction infrahisienne.
Laminopathies
Il s’agit d’un groupe de pathologies liées à des mutations dans le gène LMNA comprenant des cardiomyopathies dilatées, plusieurs tableaux de myopathies (atteinte des racines de membres, rétractions tendineuses), ou l’association des deux. Une laminopathie constitue un risque élevé de mort subite, largement supérieur à celui du syndrome de Brugada, essentiellement lié à des troubles du rythme ventriculaire. Le traitement de référence est le défibrillateur implantable, compte tenu d’une proportion très importante de morts subites, y compris chez les porteurs de stimulateurs pour trouble conductif. Des facteurs de risque rythmiques ont été validés – TVNS, FEVG < 45 %, sexe masculin, type de mutation (non faux-sens) – des événements rythmiques ventriculaires sévères ayant été rapportés chez les patients ayant au moins deux de ces marqueurs. L’intérêt de l’exploration électrophysiologique, avec implantation d’un défibrillateur si l’intervalle HV est > 70 ms, a été validé par une étude montrant qu’un choc approprié était délivré à 42 % des patients d’une cohorte appareillée sur ces critères, après un suivi moyen de 2 ans 1/2.
Penser à une pathologie neuromusculaire génétique
Une complication cardiaque, notamment rythmique, peut parfois révéler ces pathologies génétiques à un stade où la myopathie est encore fruste. L’important pour le cardiologue est alors d’évoquer le diagnostic devant :
Des antécédents familiaux de cardiomyopathie, d’arythmie, mais aussi de pathologie musculaire. Une même mutation peut par exemple être responsable chez différents membres d’une même famille d’une arythmie, d’une myopathie ou des deux.
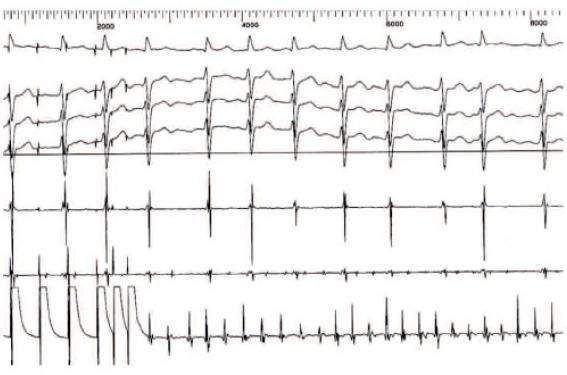
Une présentation clinique atypique, notamment un âge précoce de survenue d’une arythmie. Un flutter auriculaire (figure 2) avant l’âge de 20 ans est un mode de révélation non exceptionnel de la maladie de Steinert. Nous avons également identifié plusieurs cas de laminopathies chez des patients jeunes pris en charge pour un arrêt cardiaque.
La présence d’arguments en faveur d’une pathologie musculaire : déficit musculaire, intolérance à l’effort, antécédent de rhabdomyolyse, amyotrophie, élévation inexpliquée des CPK.
Figure 2. Flutter induit par stimulation programmée chez une jeune patiente atteinte de dystrophie myotonique.
En pratique
La prévention de la mort subite constitue le principal objectif chez les patients atteints de myopathies à risque de complications rythmiques et conductives, avec des stratégies d’évaluation et de traitement propres à chaque pathologie.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


