Valvulopathies
Publié le 04 nov 2008Lecture 8 min
L'irrésistible ascension des prothèses valvulaires implantées par cathétérisme
J.-L. MONIN, CHU Henri Mondor, Créteil
ESC
Malgré les restrictions liées à l’absence de remboursement et aux critères d’inclusion stricts des essais cliniques et autres registres, l’implantation des bioprothèses aortiques par voie percutanée s’est développée assez rapidement. La voie trans-apicale se développe également, bien que la diffusion en soit plus restreinte. Le nombre de patients implantés dans le monde dépasse actuellement les 2 500 et de nombreuses sessions plénières, symposiums et abstracts ont été consacrés à ce sujet pour cette édition 2008. Nombreux sont ceux qui considèrent que cette technique est une des avancées thérapeutiques majeures des 5 dernières années.
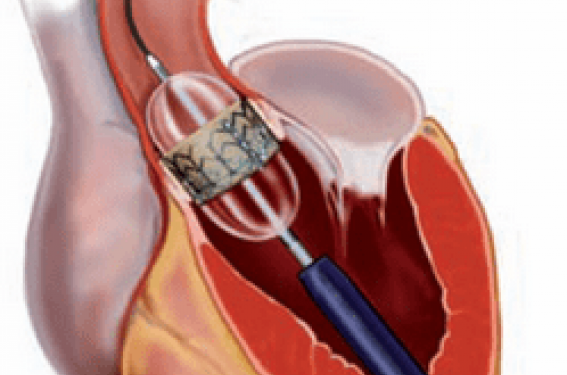
Prothèses aortiques implantées par cathétérisme
Implantation percutanée ou trans-apicale d’une bioprothèse aortique : résultats à J-30
En plus des équipes pionnières (A. Cribier à Rouen, J. Webb à Vancouver, Canada et E. Grube à Siegburg, Allemagne), sept équipes européennes, canadiennes et américaines ont rapporté leur expérience initiale de l’implantation trans-cathéter de prothèses aortiques, essentiellement par voie percutanée. Dans tous les cas, il s’agit de patients âgés de plus de 80 ans, à haut risque chirurgical estimé par un EuroSCORE logistique généralement > 20 % (www.euroscore.org) ou présentant une contre-indication à la chirurgie à thorax ouvert (aorte porcelaine, thorax irradié, etc.). Les résultats de ces séries préliminaires démontrent la faisabilité de l’implantation d’une valve aortique par voie percutanée (tableau 1). Il faut cependant garder à l’esprit que, chez ces patients âgés et fragiles, des complications graves peuvent survenir en cours de procédure. Ainsi, Wenaweser et coll. rapportent 2 décès per-procédure sur 22 implantations : une insuffisance aortique massive après valvuloplastie et une tamponade. Linke et coll. rapportent 5 accidents emboliques cérébraux sur 53 patients implantés.
Au total, malgré ces accidents et bien que la plupart de ces équipes soient encore en phase d’apprentissage, la mortalité observée (globalement autour de 10 %) est d’ores et déjà inférieure au risque anticipé par l’EuroSCORE (tableau 1).
Le développement de la voie trans-apicale (figure 1), qui reste un geste chirurgical pratiqué au bloc opératoire sous anesthésie générale, est légèrement en retrait par rapport à la voie percutanée artérielle fémorale rétrograde, avec moins de 300 patients implantés dans le monde actuellement. Parmi les résultats présentés à l’ESC, seuls 5 patients ont été implantés par cette voie par l’équipe de Munich et 12 patients par l’équipe de Laval, Québec. Sur cette série limitée, l’équipe canadienne rapporte un taux de succès de la voie trans-apicale de 100 % et une mortalité à J30 de 9 %.
Figure 1. Technique d’implantation d’une prothèse Edwards-SAPIEN™ par voie trans-apicale. A : Déploiement de la prothèse par injection rapide du ballon sur lequel la prothèse a été sertie ; la sonde porteuse traverse l’apex du ventricule gauche via une mini thoracotomie latérale gauche. B : Position finale de la prothèse après suture de l’apex ventriculaire gauche.
Voie percutanée vs chirurgie vs traitement médical
L’équipe du Thorax Center de Rotterdam (Otten et coll.) rapporte son expérience sur 93 patients adressés pour un rétrécissement aortique calcifié (RAC) sévère, symptomatique et à haut risque opératoire. Sur l’ensemble des patients, 35 ont bénéficié d’une valve percutanée, 15 ont été opérés sous CEC, 15 autres ont refusé toute procédure invasive et 28 n’avaient pas d’indication à un remplacement valvulaire.
Les résultats montrent que, malgré un profil de risque plus élevé, la survie à un an est meilleure en cas de valve percutanée que dans le groupe chirurgical (tableau 2). Sans surprise, le pronostic des patients ayant refusé les traitements est le plus péjoratif (50 % de survie à 1 an).
Une équipe anglaise (Jilaihawi et coll.) rapporte des résultats un peu plus nuancés sur le bénéfice de la voie percutanée par rapport à la chirurgie. Sur 102 patients adressés, compte tenu des problèmes de financement des prothèses, seulement 30 patients ont pu être implantés par voie percutanée (prothèse CoreValve, figure 2), 8 ont été opérés et 64 patients traités médicalement (en attente d’implantation). Le groupe chirurgical a été augmenté de 23 patients opérés pendant la même période et appariés sur les caractéristiques cliniques et hémodynamiques. Les résultats montrent que la mortalité à 18 mois est de 20 % dans le groupe implanté par voie percutanée, contre seulement 3 % dans le groupe chirurgical et 41 % dans le groupe traité médicalement. Pour être complet, il faut préciser que, sur les 6 décès du groupe « percutané », seulement 1 était relié à la procédure ; de plus, la différence de mortalité entre les deux groupes traités n’est pas significative (p = 0,09, figure 3).
Figure 2. Contrôle de la position exacte d’une bioprothèse CoreValve Revalving System™ implantée par voie percutanée (abord artériel fémoral rétrograde) par scanner cardiaque. A : reconstruction 3-D du volume cardiaque grâce à un scanner 64 barrettes. B : Bon positionnement de la prothèse. aorte ascendante ; Ostium : ostium coronaire ; TC : tronc commun coronaire gauche ; VG : ventricule gauche.
Figure 3. Survie estimée (Modèle de Cox) parmi 102 patients ayant un RAC sévère et symptomatique à risque opératoire élevé en fonction du traitement chirurgical (CHIR), prothèse percutanée (PAVR) ou médical (MED). Adapté d’après Jilaihawi et coll.
Les auteurs concluent que, chez des patients à haut risque présentant un RAC sévèrement symptomatique, le traitement par voie chirurgicale ou percutanée offre un bénéfice substantiel en termes de survie par rapport au traitement médical.
Ces résultats sont confirmés par l’équipe pionnière de Rouen (Zajarias et coll.) qui a rapporté une série de 174 patients évalués pour un RAC sévère, symptomatiques et à haut risque opératoire (EuroSCORE logistique > 20 %). Trente-six patients ont pu être implantés par voie percutanée (prothèse Edwards-SAPIEN, Figure 1), 88 étaient en attente de traitement et 50 patients ont été récusés pour état général médiocre (30 %), comorbidité extracardiaque (28 %), autre pathologie cardiaque incurable (23 %), abords vasculaires insuffisants (13 %) ou refus du patient (6 %). De manière non surprenante, 53 % de ces patients sont décédés dans un délai moyen de 2 mois (8 jours à 8 mois), essentiellement d’insuffisance cardiaque (63 %) ou de mort subite (29 %).
Les paramètres prédictifs d’un décès les plus péjoratifs étaient un EuroSCORE > 23 % et l’absence de valvuloplastie aortique au ballon (risque relatif de décès multiplié par 6,4 et 2,1 respectivement).
Quels résultats hémodynamiques à moyen terme ?
Le registre de faisabilité de la prothèse CoreValve de 3e génération (étude COR-2006-02) comprenait le recueil systématique des données échocardiographiques sous format numérique (DICOM) en vue d’une interprétation par un Core-Lab indépendant (CHU Henri Mondor, Créteil ; Monin et coll.). Les centres investigateurs de cette étude étaient répartis entre l’Europe (Siegburg et Leipzig, Allemagne ; Rotterdam et Breda, Pays Bas ; Leicester et Londres, Angleterre) et le Canada (Montréal, Otawa et Edmondon). Sur les 112 patients implantés, les données échographiques étaient disponibles pour 90 % des patients avant implantation et pour 77 % des patients arrivés à un an de suivi. Ce recueil partiel des données échographiques, non rare dans ce type de registre, est bien entendu la principale limite de cette étude.
Malgré cette limite, l’hémodynamique de cette bioprothèse reste stable à un an de suivi (surface brute : 1,7 cm2 ; indexée à 1,0 cm2/m2 avec un gradient moyen stable à 10 mmHg) sans aggravation des fuites paraprothétiques (minimes à modérées dans tous les cas) ni migration de prothèse. Bien entendu, d’autres études sont en cours afin d’obtenir des résultats à plus long terme et d’évaluer la durée de vie de ces nouvelles prothèses.
Rétrécissement aortique en 2008
Faut-il indexer la surface aortique à la surface corporelle ?
Ce travail italien (Badano et coll.) étudie l’impact du surpoids sur les calculs de surface aortique indexée sur une série de 137 patients consécutifs (55 % d’hommes, âgés de 76 ± 8 ans). Parmi ceux-ci, moins d’un tiers avaient un poids normal (n = 44, IMC < 25 kg/m2), un gros tiers était en surpoids (n = 51, IMC de 25 à 30 kg/m2) et le tiers restant était obèse (n = 42, IMC > 30 kg/m2). Les résultats montrent la même relation exponentielle entre les gradients trans-valvulaires et la surface aortique, qu’elle soit indexée ou non à la surface corporelle (figure 2 : relation exponentielle surface/gradient). Chez les obèses, la prévalence de RAC serrés est de 60 % en considérant une surface aortique brute < 1,0 cm2 ; elle augmente à 74 % en prenant comme seuil une surface indexée < 0,6 cm2/m2.
L’utilisation de la surface aortique indexée ne donne donc pas un meilleur reflet de la sévérité hémodynamique et amène probablement à surestimer la sévérité d’un RAC chez les patients obèses. Les auteurs notent au passage que ces données remettent gravement en cause le concept de discongruence patient/prothèse (mismatch), qui repose exclusivement sur des valeurs indexées à la surface corporelle.
Faut-il opérer les patients asymptomatiques ?
Une étude prospective coréenne (Kang et coll.) a suivi 227 patients relativement jeunes (61 ± 12 ans) également répartis entre les sexes, ayant un RAC sévère asymptomatique et une fonction VG normale (FE VG > 50 %). De manière non randomisée, 72 patients ont été opérés précocement (groupe A) et les 115 autres ont été opérés selon les recommandations, à l’apparition des symptômes. Aucune différence entre les deux groupes n’a été observée, sauf pour l’incidence de sténoses critiques (surface < 0,75 cm2), plus élevée dans le groupe opéré précocement (85 % vs 41 %, p < 0,01). Globalement, la chirurgie précoce n’a pas diminué significativement le taux de décès/insuffisance cardiaque à 7 ans, sauf dans le sous-groupe des sténoses critiques (13 % vs aucun événement en cas de chirurgie précoce, p < 0,05).
Rappelons que les recommandations américaines (ACC-AHA) considèrent une sténose asymptomatique critique (surface < 0,6 cm2) comme une indication opératoire discutable (classe IIb), alors que cet item ne figure pas dans les recommandations européennes. Le débat reste ouvert.
L’écho-dobutamine est-elle vraiment utile en cas de bas débit ?
Il s’agit d’une métaanalyse (Valencia Serrano et coll.) regroupant 13 études observationnelles, soit un total de 439 pa-tients opérés d’un RAC avec dysfonction ventriculaire gauche et bas débit. Les résultats montrent une diminution modeste mais significative (12,7 vs 14,1 %) de la mortalité opératoire globale lorsque l’écho-dobutamine est utilisée en préopératoire. Cette mortalité précoce est nettement influencée par la présence ou l’absence d’une réserve contractile ventriculaire gauche préopératoire (7,1 % vs 34,2 % respectivement, OR = 0,13, IC 95 % : 0,04-0,44, p = 0,001). Il est conclu que le test à la dobutamine est utile pour la stratification du risque opératoire en cas de RAC en bas débit, la présence d’une réserve contractile étant un argument fort en faveur d’un risque opératoire très acceptable.
En pratique
Le nombre de communications consacrées à cette nouvelle approche thérapeutique souligne le nombre de patients âgés et fragiles porteurs d’une sténose serrée et non candidats à la chirurgie.
Cette approche va aller en augmentant en raison de l’augmentation croissante de cette pathologie.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :







