Publié le 26 fév 2024Lecture 11 min
Une association très probable : prolapsus bivalvulaire mitral et QT long
Laura BACIULESCU, cardiologue, CH d’Agen
Patiente de 79 ans, venue en consultation pour le suivi de son défibrillateur sous-cutané marque Boston modèle EMBLEM. Elle présente une asthénie et une fatigue aggravée depuis 2 mois avec apparition des malaises sans perte de connaissance depuis quelques jours. Antécédents : hypothyroïdie centrale substituée, mort subite de son père à l’âge de 64 ans d’un infarctus du myocarde, chirurgie mammaire pour carcinome lobulaire in situ.
Concernant ses antécédents cardiovasculaires, elle a bénéficié de l’implantation d’un défibrillateur sous-cutanée, Boston en janvier 2017, en prévention secondaire d’une mort subite récupérée par fibrillation ventriculaire, en rapport soit avec un syndrome coronarien aigu sur sténose distale très serrée de la coronaire droite, soit en rapport avec une maladie de Barlow maligne soit en rapport avec un syndrome de QT long. La lésion de la coronaire droite a été dans un premier temps respectée. Cette lésion sera par la suite revascularisée du fait d’une instabilité rythmique persistante pendant les jours suivants avec plusieurs épisodes de torsade de pointes et plusieurs épisodes de fibrillation ventriculaire authentique, soutenus, nécessitant plusieurs chocs externes et ce survenant après correction de facteurs métaboliques (hypocalcémies à répétition). Cette angioplastie s’est malheureusement soldée par une dissection focale. Elle a présenté aussi une septicémie sur pneumopathie pendant le séjour en réanimation. La patiente présentait sur l’ECG initial fait en réanimation un QT très allongé (530 ms) avec rabotage onde R en antéroseptal.
Elle avait bénéficié d’un traitement par sulfate de magnésium IV, xylocaïne IV, et correction de la calcémie.
L’ECG quelques jours plus tard en réanimation montrait une diminution de l’espace QT, qui restait malgré tout allongé (496 ms).
L’échographie trans thoracique retrouvait une fraction d’éjection VG conservée à 70 %, sans dilatation, sans hypertrophie, une valve mitrale épaissie myxoïde avec un excès tissulaire important sur les deux feuillets, une ballonnisation bivalvulaire avec un prolapsus situé surtout au niveau de P2 à l’origine d’une fuite de grade IV, oreillette gauche très dilatée, PAPs a 40 mmHg. La patiente a été mise sous bêta-bloquants et IEC après la stabilisation hémodynamique.
Une IRM cardiaque avait été réalisée avant l’implantation du défibrillateur, retrouvant une fraction d’éjection VG conservée avec une hypoperfusion inféro-septale sans signe de nécrose constituée dans les séquencés de viabilité ; on confirme la fuite mitrale de haut grade ; pas d’anomalie évocatrice de myocardite.
Dans les suites de la pose du défibrillateur, il avait été convenu de lui proposer un geste de réparation mitrale, mais au vu d’un risque chirurgical jugé trop élevé (surtout en raison de la survenue d’une embolie pulmonaire en février 2018), la mise en place des deux MitraClip avait été réalisée le 3 mai 2018, avec un bon résultat échographique et clinique immédiat. Le traitement bêtabloquant n’avait pas été reconduit à la sortie de l’hospitalisation.
Le 14 mai 2018, la patiente a présenté une syncope avec traumatisme crânien et fracture du nez, raison pour laquelle elle a été hospitalisée dans notre service.
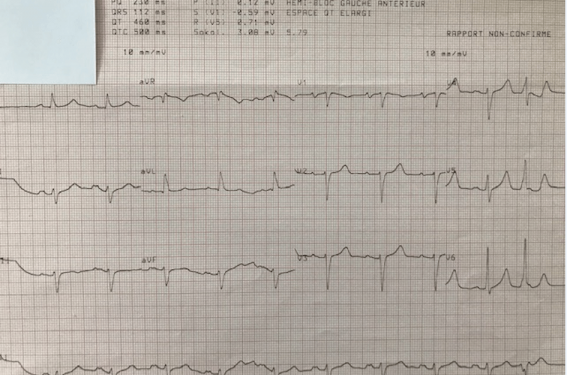
L’ECG initial retrouvait un RS, BAV du premier degré avec hypertrophie auriculaire gauche (PR à 230 ms), un hémibloc gauche antérieur, un QT allongé (500 ms), des ExV.
L’espace QTc varié d’un jour à l’autre, avec parfois des valeurs considérées comme normales pour les femmes (en dessous 459 ms) à 453 ms.
La troponine était normale, pas des troubles ioniques retrouvés (kaliémie, calcémie, magnésémie normale). L’échographie retrouvait une FEVG conservée, une insuffisance mitrale à deux jets, modérée, à la suite du MitraClip.
Le contrôle du défibrillateur montrait :
– un bon fonctionnement, avec impédance de choc et de la sonde normale, avec une très bonne détection au niveau du vecteur primaire ;
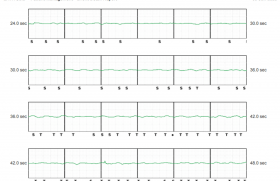
– un choc électrique interne approprié pour torsade de pointe/fibrillation ventriculaire « torsadiforme » après une détection de 17 secondes, exactement à l’heure de la syncope le 14 mai. Ci-joint le tracé.
Un traitement bêtabloquant a été débuté pendant l’hospitalisation. Le 18 mai, alors que la patiente était toujours hospitalisée, un nouvel CEI approprié a été délivré par son S-ICD.
On note un QT allongé (mesure non standardisée sur les tracés de S-ICD, mais espace QT plus long que la moitié de l’espace RR la plupart du temps), une extrasystole ventriculaire qui tombe sur l’onde T avec le démarrage d’une torsade de pointe/FV. Le traitement bêtabloquant a été augmenté.
En février 2019, le contrôle échographique retrouvait une fuite mitrale qui est redevenue sévère, avec une hypertension pulmonaire à 55 mmHg, chez une patiente avec dyspnée NYHA III.
Elle est donc adressée au CHU, où elle a bénéficié le 30 avril 2019 d’un remplacement de la valve mitrale par bioprothèse accompagné d’une annuloplastie tricuspide.
Les suites opératoires sont marques d’un épanchement péricardique minime et d’une fibrillation atriale persistante anticoagulée au long cours par coumadine.
Les échographies annuelles étaient rassurantes, retrouvant une FEVG préservée, prothèse mitrale normofonctionnelle, pas d’hypertension pulmonaire. Une scintigraphie myocardique réalisée en fin 2022 ne retrouvait pas d’ischémie résiduelle.
Un holter rythmique réalisé en avril 2023 retrouvait une bradycardie sinusale diurne à 35/min et nocturne à 30/min, nécessitant l’arrêt des bêtabloquants après leur diminution progressive.
Actuellement en consultation, la patiente présente sur l’ECG de surface une bradycardie sinusale à 42/min, un BAV I, bloc de branche gauche incomplet et un espace QTc allongé (non interprétable dans le contexte de bradycardie).
Vu la bradycardie actuelle malgré l’arrêt des bêtabloquants, la patiente est hospitalisée en urgence pour surveillance scopée. L’échographie cardiaque est rassurante, avec une FEVG à 51 %, bon fonctionnement de la bioprothèse mitrale, pas d’hypertension pulmonaire.
Le bilan biologique retrouve un NT-proBNP à 1 100 pg/mL, troponine, ionogramme, magnésémie, bilan phosphocalcique et thyroïdien normal.
Elle bénéficiera par la suite de l’implantation d’un défibrillateur endocavitaire double chambre pour la dysfonction sinusale sévère symptomatique et de la reprise des bêtabloquants.
Un bilan génétique et un dépistage familial chez les apparentes de premier degré seront réalisés. Les médicaments allongeant le QT sont contre-indiqués.
Avantages/désavantages S-ICD
À la différence d’un défibrillateur automatique implantable (DAI) conventionnel avec sonde endocavitaire, le système de défibrillation cardiaque sous-cutanée EMBLEM MRI S-ICD a les suivantes particularités :
– pas d’enregistrement des épisodes de bradycardies ;
– l’algorithme INSIGHT identifie et classifie le rythme cardiaque : classement des événements détectés comme cardiaques ou non (bruit) ou double détection, puis mesure de la fréquence cardiaque ; par la suite, la distinction entre les événements à traiter et d’autres événements à fréquence élevée (TSV) se fait par trois algorithmes : l’analyse morphologique statique qui compare la morphologie et la largeur à la référence, l’analyse morphologique dynamique, qui compare la morphologie beat-to-beat et l’analyse de la largeur du QRS comparé à celle de la référence ;
– enregistrement d’un épisode si le S-ICD a débuté la charge : 25 enregistrements d’épisodes traités, 20 enregistrements d’épisodes non traités ;
– enregistrement de la désactivation SMART PASS (algorithme destiné à réduire les surdétections de l’onde T) ;
– enregistrement ACFA de 44 s si la FA est soutenue (= 2 fenêtres de 192 battements consécutives classées en FA) : 7 épisodes maximum de FA stockés ;
– il peut délivrer jusqu’à 5 chocs par épisode, avec polarité inversée à chaque choc si inefficace ; le choc est biphasique, de 80 Joules ;
– il ne peut pas délivrer de traitement par stimulation antitachycardique (SAT) pour réduire une tachycardie ou une fibrillation ventriculaire et ne dispose pas des fonctions de stimulation antibradycardique d’un stimulateur cardiaque ;
– il est capable d’exercer une fonction de stimulation post-choc antitachycardique pendant une durée maximale de 30 secondes, a une fréquence non programmable de 50/min si asystolie post-choc : onde biphasique de 15 ms, fixée à 200 mA ;
– en l’absence d’accès veineux endocavitaire et en cas d’antécédent d’endocardite ou de septicémie, le système de défibrillation cardiaque sous-cutanée EMBLEM MRI S-ICD constitue un choix de 1re intention dans ces situations contre-indiquant l’implantation d’un DAI conventionnel avec sonde endocavitaire.
Discussion du cas
Quelle est la cause la plus probable de ces troubles du rythme ventriculaire malin à répétition ?
Le prolapsus valvulaire mitral (PVM) est une pathologie assez fréquente (jusqu’à 3 % de la population générale) et il est associé à la mort subite. L’incidence de la mort subite due au phénotype malin varie selon les études, mais peut arriver jusqu’à 1,9 %/an.
Les facteurs de risques de mort subite décrits dans la littérature sont :
– le prolapsus des deux feuillets, le sexe féminin ;
– l'inversion des ondes T dans les dérivations inférieures sur l’ECG de surface ;
– la présence d’une ectopie ventriculaire complexe : polymorphisme, couplets, triplets, tachycardie ventriculaire non soutenue, EXV originaires des muscles papillaires ou du système de Purkine, la charge quotidienne élevée en ExV à l’holter rythmique ;
– strain longitudinale global diminué, surtout en basal inféro-latéral VG ; dispersion mécanique marquée ;
– la présence d’une disjonction annulaire mitrale (DAM) inféro-latérale (adjacente au segment P2) ; à noter que la DAM de tout type est fréquente et peut être retrouvée chez des patients en bonne santé, sans valvulopathies, mais que celle inféro-latérale est rare (5 % de prévalence) et c’est presque toujours associé au prolapsus de la valve mitrale ; il n’y a pas de définition claire (un décollement partiel de l’anneau mitral du myocarde ventriculaire, permettant une hypermobilité de la valvule mitrale) ni de dimension exacte établie (on ne sait pas si 4 mm est aussi significatif pour le risque de mort subite qu’une dimension de 14 mm par exemple) ; il existe une corrélation linéaire entre le pourcentage de fibrose à l’IRM et la longueur de la DAM ; la sévérité de la DAM est corrélée avec l’occurrence de TVNS ;
– la présence et la quantité de la fibrose intramyocardique mise en évidence par le rehaussement tardif au gadolinium (RT) en IRM cardiaque : la plupart du temps focal, localisé typiquement au niveau de la paroi basale inféro-latérale ou au niveau du muscle papillaire ; c’est le substrat des arythmies ; quand il est présent, il s’associe avec une incidence de 7,7 % des événements rythmiques majeurs (par rapport à 2,7 % si prolapsus mitral, insuffisance mitrale modérée, mais pas de fibrose) ; la fibrose de remplacement est fréquente (25 % des patients avec MVP et insuffisance mitrale minime à modérée, 42 % des patients avec insuffisance mitrale sévère) et seule ne suffit pas pour considérer un patient à haut risque de mort subite ; 20-30 % des patients avec mort subite n’ont pas de fibrose… ;
– la présence d’un modèle de strain avec deux sommets (double peak strain pattern) augmente le risque d’arythmie maligne même en l’absence de fibrose intramyocardique : pendant que l’apex ventriculaire se contracte (premier pic présystolique), le prolapsus de la valve mitrale tire le muscle papillaire de l’autre côté (deuxième pic en télésystole) ;
– le signe Pickelhaube : la présence en Doppler tissulaire des vélocités systoliques (l’onde S) à l’anneau latéral très hautes, avec un aspect de « spike » double le risque de survenue ultérieure d’une tachycardie ventriculaire (une valeur de 19 a une spécificité de 72 %) ;
– la présence et la sévérité d’une inflammation myocardique démontrée par le TEP-scanner ou imagerie hybride (TEP couplé à l’IRM) ;
– le risque de mort subite est indépendant de la sévérité de la fuite mitrale : 80 % des morts subites surviennent chez les patients avec des insuffisances mitrales modérées ;
– une fuite mitrale massive peut être responsable des forces de traction mécanique importantes qui peuvent déclencher des troubles du rythme malin (« triggered activity » dépolarisations déclenchées par le stress mécanique) même en l’absence de fibrose intramyocardique.
La présentation initiale de cette patiente faisait suspecter un syndrome de QT long acquis sur ischémie et troubles ioniques (hypocalcémies à répétition).
Cette supposition est remise en question par les deux épisodes de TP/FV choquées survenues en mai 2018, après l’arrêt des bêtabloquants et sans facteur déclenchant retrouvé, à part l’espace QT allongé : troponine normale, pas d’ischémie, pas de troubles ioniques, pas de déséquilibre hormonal thyroïdien, pas de traitement par amiodarone ou autre médicament allongeant le QT à ce moment-là.
Après la reprise des bêtabloquants, la patiente n’a plus présenté des troubles du rythme soutenus : son défibrillateur n’a enregistré aucun épisode/événement rythmique depuis 2018, malgré la réapparition d’une insuffisance mitrale sévère nécessitant une reprise chirurgicale.
En revanche, son espace QT est variable avec parfois des valeurs considérées comme normales pour une femme (453 ms).
Le diagnostic de SQTL repose essentiellement sur la mesure de l’intervalle QTc (QT corrigé), qui est généralement allongé, bien que 20 % à 25 % des patients atteints de SQTL confirmé par la présence d’une mutation puissent avoir un QTc normal ; le chevauchement des intervalles QTc au repos entre les personnes en bonne santé et les patients atteints de SQTL rend d’ailleurs le diagnostic difficile.
EN PRATIQUE
Y a-t-il une variabilité importante de l’espace QTc avec apparition d’un QT long précédant les troubles du rythme malin dans le prolapsus de la valve mitrale ?
Les implications éventuelles de la confirmation de ce mécanisme dans la mort subite sont importantes.
Comme mesures préventives de la mort subite associée au PVM, est-ce qu’on devrait traiter la plupart des patients avec des bêtabloquants à forte dose ? Proscrire les médicaments allongeant le QT « comme la flécaïne » ou le sport de compétition ?
La prévention et la correction des anomalies électrolytiques (hypokaliémie, hypocalcémie, hypomagnésémie) pouvant survenir lors de diarrhées, de vomissements, de troubles métaboliques, ou de régimes alimentaires déséquilibrés sont nécessaires dans tous les cas.
La prévention agressive de la cardiopathie ischémique est capitale.
Pour en savoir plus
Yns B et al. EHRA expert consensus statement on arrhythmic mitral valve prolapse and mitral annular disjunction complex in collaboration with the ESC Council on valvular heart disease and the European Association of Cardiovascular Imaging endorsed by the Heart Rhythm Society, by the Asia Pacific Heart Rhythm Society, and by the Latin American Heart Rhythm Society. Europace 2022.
Basso C et al. Arrhythmic mitral valve prolapse and sudden cardiac death. Circulation 2015.
Muthukumar L et al. Association between malignant mitral valve prolapse and sudden cardiac death. JAMA Cardiol 2020.
Pavon AG et al. Myocardial extracellular volume by T1 mapping: a new marker of arrhythmia in mitral valve prolapse. J Cardiovasc Magn Reson 2021.
Nagata Y et al. Abnormal mechanics relate to myocardial fibrosis and ventricular arrhythmias in patients with mitral valve prolapse. Circ Cardiovasc Imaging 2023.
Huttin O et al. Interactions between mitral valve and left ventricle analysed by 2D speckle tracking in patients with mitral valve prolapse: one more piece to the puzzle. Eur Heart J Cardiovasc Imaging 2017.
Zia MI et al. Relation of mitral valve prolapse to basal left ventricular hypertrophy as determined by cardiac magnetic resonance imaging. Am J Cardiol 2012.
Garbi M et al. Mitral valve and left ventricular features in malignant mitral valve prolapse. Open Heart. 2018.
Lancellotti P, Garbi M. Malignant mitral valve prolapse: substrates to ventricular remodelling and arrhythmias. Circ Cardiovasc Imaging 2016.
Kubala M et al. Arrhythmias in patients with valvular heart disease: gaps in knowledge and the way forward. Front Cardiovasc Med 2022.
Miller MA et al. Hybrid positron emission tomography/magnetic resonance imaging in arrhythmic mitral valve prolapse. JAMA Cardiol 2020.
Basso C et al. Mitral valve prolapse, ventricular arrhythmias, and sudden death. Circulation 2019.
Denjoy Isabelle, Probst Vincent. Protocole national de diagnostic et de soins-syndrome du QT long, mai 2021.
SICD Training général-médecin, formation Boston Scientific.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :