Publié le 22 déc 2023Lecture 9 min
Quelle imagerie dans la cardiomyopathie restrictive ?
Jean-Christophe EICHER, Thibault LECLERCQ, service de cardiologie, centre de compétences cardiomyopathies, département d’imagerie, CHU François Mitterrand, Dijon
La cardiomyopathie restrictive (CMR) est la moins fréquente des cardiomyopathies. Elle est aussi la plus protéiforme, ce qui permet d’emblée de souligner que dans cette pathologie, peut-être plus que dans les autres cardiomyopathies, le bilan doit reposer sur tous les types d’imagerie disponibles. Cette imagerie multimodale appliquée aux CMR a fait l’objet d’un document de consensus de l’EACVI en 2017(1).
Définition
La définition, telle qu’elle figurait dans la publication en 2008 de la classification des cardiomyopathies de l’ESC, était la suivante : « Les cardiomyopathies restrictives sont définies par une physiologie restrictive en présence de volumes diastoliques normaux ou réduits et d’une épaisseur ventriculaire normale(2) ». Cette définition était imparfaite, car dans de nombreux cas l’épaisseur myocardique est augmentée. De plus, un profil restrictif peut être temporairement présent dans d’autres types de pathologies. Enfin, le terme cardiomyopathie implique une maladie du myocarde, alors que la fibrose endomyocardique fait partie de ce groupe de maladies.
Tout récemment, une nouvelle définition a été proposée(3). La CMR est caractérisée par la coexistence d’une physiologie restrictive persistante, avec dilatation atriale, sans dilatation ventriculaire, quelles que soient l’épaisseur ventriculaire et la fonction systolique. Il est également précisé que plusieurs formes de CMR sont dues à une atteinte endocardique prédominante, conduisant à un profil hémodynamique similaire aux maladies myocardiques isolées. Il faut ensuite comprendre que la définition de la CMR est différente des autres catégories de cardiomyopathies, qui sont définies par des critères morphologiques (dilatation, hypertrophie, atteinte ventriculaire droite, ou encore hypertrabéculation). La CMR est classée selon un critère fonctionnel (la physiologie restrictive), ce qui en fait un groupe hétérogène avec des étiologies multiples et un large spectre de présentations morphologiques, le dénominateur commun étant le profil restrictif. On devrait donc parler de cardiomyopathies restrictives au pluriel, en raison de la diversité des étiologies et des aspects phénotypiques.
Étiologies
Selon le mécanisme prédominant, on peut distinguer 4 principales catégories (figure 1) :
Figure 1. Classification des cardiomyopathies restrictives selon l’histologie, la génétique, et la nature permanente ou occasionnelle du profil restrictif (d’après(3)).
Les maladies infiltratives, qui affectent l’interstitium, dont l’archétype est l’amylose, et qui comprennent également la sarcoïdose.
Les maladies de surcharge, dans lesquelles il existe une accumulation de produits non dégradés au sein du cardiomyocyte, comme dans la maladie de Fabry, les glycogénoses, l’hémochromatose…
Des maladies liées à une fibrose interstitielle avec dysfonction myocytaire intrinsèque, qui concernent notamment les mutations sarcomériques, ainsi que des causes toxiques (radio, chimiothérapie…).
Enfin, des maladies de l’endocarde : fibrose éosinophilique ou tropicale, carcinoïde…
Parmi ces étiologies diverses, on peut distinguer les CMR « vraies » avec un profil restrictif systématique, et des pathologies pouvant occasionnellement présenter une physiologie restrictive ou des phénotypes mixtes(3).
Échocardiographie
L’échocardiographie est véritablement la pierre angulaire du diagnostic.
Elle permet tout d’abord de constater des caractéristiques morphologiques et fonctionnelles relativement constantes et communes : 1) une cavité ventriculaire gauche normale ou petite < 40 ml/m2 ; 2) une FEVG généralement préservée, sauf dans les formes très évoluées ; 3) des épaisseurs ventriculaires pouvant être normales ou modérément augmentées ; 4) des oreillettes généralement fortement dilatées ; 5) une fonction diastolique toujours anormale, mais pas toujours restrictive.
C’est là un des paradoxes de cette catégorie de cardiomyopathie : la présence d’un profil restrictif n’est pas indispensable au diagnostic Des patients ayant une véritable CMR peuvent présenter initialement un profil de grade I et évoluer progressivement vers des grades plus sévères. Le profil restrictif typique comporte un rapport E/A > 2,5, un temps de décélération de l’onde E mitrale < 150 ms, un temps de relaxation isovolumique < 50 ms, et des pressions de remplissage élevées se traduisant par une dilatation des structures d’amont, oreillettes et veine cave inférieure (figure 2). Ce type de profil est associé à un moins bon pronostic.
Figure 2. Progression du profil mitral en fonction de la pression atriale gauche, de l’altération de la relaxation au profil restrictif associé à une dilatation atriale et veineuse.
DT : temps de décélération ; IVRT : temps de relaxation isovolumique ; PV : veine pulmonaire
L’échocardiographie est aussi un outil précieux pour balayer le spectre étiologique.
Parmi les maladies infiltratives, l’exemple le plus classique est celui de l’amylose : épaississement diffus de toutes les structures, altération de la fonction longitudinale avec classique préservation apicale et gradient apex-base en 2D strain (figure 3), échogénicité particulière dite « scintillante » ou « granitée » qui n’est toutefois ni systématique ni spécifique.
Figure 3. Amylose cardiaque typique : épaississement global de toutes les structures cardiaques (ventricules, valves, septum interatrial), altération du strain longitudinal avec gradient apex-base.
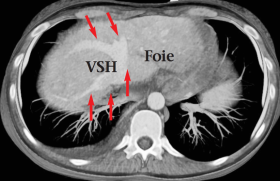
Dans les anomalies intrinsèques du fonctionnement du cardiomyocyte, comme dans les mutations sarcomériques ou les CMR idiopathiques, on visualise généralement un petit ventricule gauche non ou modérément hypertrophié, une dilatation sévère des oreillettes, un flux mitral typiquement restrictif, et une veine cave dilatée (figure 4).
Figure 4. Cardiomyopathie restrictive sur mutation sarcomérique (MYBPC3) : petit ventricule gauche, énormes oreillettes, dilatation de la veine cave inférieure, profil mitral restrictif.
OD : oreillette droite ; OG : oreillette gauche ; VD : ventricule droit ; VG : ventricule gauche ; VCI : veine cave inférieure ; VSH : veine sus-hépatique
Parmi les maladies de surcharge, la maladie de Fabry est la moins rare. L’aspect est généralement celui d’une HVG concentrique (des formes apicales ou asymétriques et obstructives étant possibles), avec profil restrictif dans les formes évoluées, et strain longitudinal altéré typiquement prédominant sur la paroi postérolatéro-basale (figure 5).
Figure 5. Maladie de Fabry, cardiomyopathie hypertrophique prédominante sur la paroi postérieure et l’apex, altération du strain longitudinal plus marquée sur la paroi postéro-latérale.
Enfin, dans la fibrose endomyocardique la forme classique est celle d’une oblitération bi-apicale, avec profil mitral caricatural évoquant le dip-plateau hémodynamique (figure 6). Des formes avec atteintes basales ou valvulaires sont également possibles.
Figure 6. Fibrose endomyocardique hyperéosinophilique dans sa forme typique avec oblitération bi-apicale ; flux mitral enregistré en ETO (en haut à droite), restrictif avec brève inversion mésodiastolique (flèche), superposable au dip-plateau hémodynamique (en bas à droite).
Imagerie par résonance magnétique nucléaire (IRM)
L’IRM avec toutes ses modalités est un outil essentiel : ciné IRM pour les études volumétriques et fonctionnelles, séquences statiques pondérées en T1, T2, T2* pour la caractérisation tissulaire, et étude du rehaussement tardif après injection de Gadolinium.
Dans l’amylose, l’IRM est d’un grand intérêt. La difficulté à déterminer le temps d’inversion est un premier indice évocateur. Le rehaussement tardif, qui traduit l’infiltration interstitielle et l’expansion du volume extracellulaire, peut prendre plusieurs aspects : global transmural, sous-endocardique diffus, ou encore patchy (figure 7). Le T1 mapping est aujourd’hui un outil fondamental (figure 8). Le T1 natif est fortement augmenté (en moyenne 1 100 ms vs 960 ms chez le sujet normal) (figure 8B), il s’agit d’un marqueur précoce(4) très utile chez les patients chez qui le gadolinium est contre-indiqué. Le T1 mapping post-contraste permet de calculer un volume extra-cellulaire (généralement > 45-50 % dans l’amylose) qui possède une excellente valeur diagnostique et pronostique, supérieure à celle du contraste seul(5,6).
Figure 7. IRM et amylose, étude de rehaussement tardif. À gauche, rehaussement transmural des deux ventricules. À droite, rehaussement sous-endocardique diffus (flèches).
A
B
C
Figure 8. IRM, étude de rehaussement tardif (à gauche), étude du T1 natif (à droite). A. Sujet suspect de cardiomyopathie hypertrophique familiale, hypertrophie septale minime, prise punctiforme de gadolinium septo-basale, valeurs de T1 natif normales. B. Amylose cardiaque, rehaussement tardif transmural, augmentation diffuse du T1 natif prédominant dans les zones basales. C. Maladie de Fabry, hypertrophie à prédominance apicale, prise de contraste septo- et latéro-médiane, diminution diffuse des valeurs du T1 mapping prédominant sur les segments apicaux et septaux.
Dans la maladie de Fabry, l’IRM montre une hypertrophie concentrique dans 80 % des cas, mais une hypertrophie septale asymétrique ou apicale est possible. L’étude de rehaussement tardif peut mettre en évidence une fibrose, qui siège préférentiellement dans la paroi inféro-latérobasale (figure 9), et qui est associée à une moindre réponse au traitement. Le signal T1 natif, contrairement à l’amylose, est abaissé et reflète l’accumulation de sphingolipides (figure 8C). Un T1 abaissé est considéré comme le meilleur paramètre IRM pour différencier le Fabry du sujet normal ou d’autres causes de CMH(7). Quant au T2 mapping, il reflète l’inflammation et l’œdème. L’élévation du T2 est fortement corrélée au taux de troponine, et à l’aggravation clinique(8). Une diminution du T2 sous traitement est associée à une réduction de la masse myocardique(9).
Figure 9. IRM et Fabry. À gauche et au centre, séquences en ciné-IRM montrant l’hypertrophie concentrique prédominant sur la paroi postérieure. À droite, rehaussement tardif au niveau de la paroi postéro-latérale (flèche).
Quant à l’hémochromatose, les propriétés paramagnétiques du fer peuvent être mises en évidence par le temps de relaxation T2* qui est diminué (valeur normale voisine de 40 ms). Une sidérose myo-cardique (T2* < 20 ms) est présente chez 1/3 des patients avec hémochromatose et ferritine > 100 μg/l et s’accompagne d’une baisse de la FEVG(10).
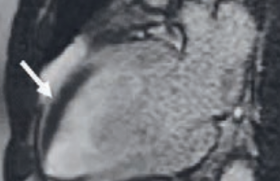
En ce qui concerne la fibrose endomyocardique, les séquences de ciné-IRM montrent l’oblitération de l’apex du VG ou des 2 ventricules et la dilatation des oreillettes. Les images de rehaussement tardif objectivent l’atteinte fibrotique sous-endocardique, non dépendante d’un territoire coronaire. La présence d’un thrombus apparaît en hyposignal superposé à l’hypersignal de la fibrose apicale (signe du « double V ») (figure 10). On peut également visualiser une fibrose des muscles papillaires, l’atteinte des valves auriculo-ventriculaires, ou celle des autres tuniques en cas de myocardite ou péricardite.
Figure 10. IRM et fibrose endomyocardique. Rehaussement tardif biventriculaire de tout l’endocarde, présence d’un thrombus apical (signe du « double-V »).
L’IRM peut aussi être utile pour explorer des atteintes extra-cardiaques, comme en cas de myocardiopathie mitochondriale dans le cadre d’un syndrome MELAS (« Mitochondrial Encephalopathy with Lactic Acidosis and Stroke-like episodes »), et qui peut s’accompagner d’une CMR associée à des épisodes déficitaires neurologiques. L’IRM cérébrale montre des lésions ne suivant pas une topographie vasculaire (figure 11).
Figure 11. Syndrome MELAS. ETT (2 images de gauche, remerciements à C. Denis) : cardiomyopathie hypertrophique modérée, flux mitral restrictif. IRM cérébrale (3 images de droite) : multiples lésions corticales en hypersignal, temporo-occipitales bilatérales et frontales droites.
Scanner cardiaque
Cette modalité est limitée par son caractère irradiant et le fait qu’elle ne procure que des analyses statiques. Son intérêt réside dans sa haute résolution spatiale, il est utile dans le diagnostic différentiel (constriction péricardique), pour étudier les atteintes extracardiaques dans des situations spécifiques comme la sarcoïdose, ou pour des analyses morphologiques lorsque l’IRM est contreindiquée.
Imagerie nucléaire
Enfin, l’imagerie nucléaire possède des atouts dans certaines étiologies spécifiques.
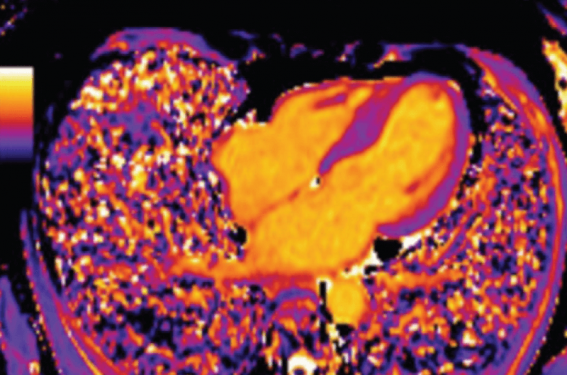
La scintigraphie osseuse est aujourd’hui incontournable dans le bilan d’amylose. En bref, on réalise, après injection d’un marqueur technétié couplé à un diphosphonate, une scintigraphie planaire, autant que possible une tomoscintigraphie (figure 12), et on évalue de façon visuelle l’intensité de la captation cardiaque comparativement à celle de l’os (score de Perugini, de 0 à 3). Ces marqueurs osseux ont une affinité pour les microcalcifications induites par la présence de transthyrétine et permettent d’affirmer le diagnostic d’amylose TTR en cas de score 2-3 en l’absence de gammapathie monoclonale.
Figure 12. Scintigraphie aux biphosphonates et amylose TTR. À gauche, scan corps entier montrant une hyperfixation cardiaque intense avec « extinction » du squelette (score 3 de Perugini). À droite, tomoscintigraphie montrant l’hyperfixation prédominant dans les régions basales.
La scintigraphie au MIBG permet d’étudier la dénervation cardiaque et peut avoir un intérêt dans l’amylose dans la détection précoce et le pronostic. La tomographie par émission de positons est utile dans certaines situations :
Toujours dans l’amylose, certains traceurs spécifiques des fibres amyloïdes, comme le 18F-florbetapir, le 18F Florbetapan et le 18F-NaF, semblent prometteurs pour le diagnostic précoce, la quantification de la charge amyloïde, la distinction entre amylose AL et TTR, et la réponse au traitement(11).
Dans la sarcoïdose, les granulomes contiennent des lymphocytes CD4+ et des macrophages activés qui expriment sur leur membrane des transporteurs de glucose. Le 18Fluorodéoxyglucose s’accumule dans les cellules inflammatoires, objectivant les zones hypermétaboliques, comme les adénopathies, mais aussi l’infiltration myocardique. Il est recommandé de coupler une imagerie de perfusion, qui est réduite à la phase inflammatoire et au stade de fibrose, dans les zones qui typiquement matchent avec la zone hypermétabolique. La présence conjointe d’un foyer hypermétabolique et d’un trouble perfusionnel est prédictive d’événements avec un HR à 3,9(12).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :