Vasculaire
Publié le 25 sep 2019Lecture 12 min
Cardiovalves 2019 : l’actualité dans l’insuffisance mitrale primaire
Christophe TRIBOUILLOY, Yohann BOHBOT, CHU d’Amiens
La session inaugurale du congrès Cardiovalves 2019 a eu pour thème l’insuffisance mitrale sévère par prolapsus. Elle s’est concentrée sur la problématique des troubles du rythme ventriculaire développée par Jean-François Aviérinos, sur les indications de MitraClip traitées par Catherine Sportouch, et enfin sur les indications chirurgicales chez les patients asymptomatiques discutées par Jean-Louis Vanoverschelde. Nous vous proposons dans cet article une synthèse de ces trois thèmes qui ont suscité de nombreux échanges entre les orateurs, les modérateurs et les congressistes.
PVM mitral et mort subite : la longue histoire inachevée d’une controverse
La responsabilité du prolapsus valvulaire mitral (PVM) dans la survenue de morts subites rythmiques nourrit une longue controverse qui remonte au début des années 1980. Après une dizaine d’années de silence, nous avons assisté dans les années 2010 à un regain d’intérêt pour cette association et au développement de concepts nouveaux.
Les nouvelles données
Au début des années 2010, une première étude a porté sur 1 200 cas de morts subites rythmiques extrahospitalières dont 24 restaient inexpliquées au terme d’un bilan excluant coronaropathie, cardiomyopathie ou canalopathie(1). Un prolapsus valvulaire mitral était présent chez 10 de ces 24 patients soit 1 % de l’ensemble des morts subites extrahospitalières et 42 % des morts subites inexpliquées. Tous ces patients étaient porteurs d’un PVM bivalvulaire, un seul d’entre eux avait une fuite mitrale sévère ; 90 % étaient des femmes. Des ondes T négatives en dérivations inférieures et des arythmies ventriculaires complexes étaient documentées chez la majorité de ces patients émanant de la voie de sortie ventriculaire gauche ou des muscles papillaires. Une seconde étude conduite à partir du registre des morts subites d’Italie du Nord a identifié, parmi 650 autopsies après mort subite, 43 patients porteurs d’un PVM sans autre cardiopathie soit une prévalence du PVM parmi l’ensemble des morts subites de 7 %(2). L’âge moyen lors du décès était de 32 ans, 60 % des patients étaient des femmes et 70 % étaient porteurs d’un prolapsus bivalvulaire. Tous présentaient une fibrose de remplacement au niveau des zones d’insertion des muscles papillaires et de la paroi inférieure du ventricule gauche sous le feuillet mitral postérieur. Au total, 21 % étaient traités par bêtabloquants au moment de la mort subite suggérant l’absence d’efficacité de ce type de traitement. Les auteurs ont par ailleurs étudié les caractéristiques de 30 patients admis pour arythmie ventriculaire complexe et prolapsus valvulaire mitral incluant 2 patients avec mort subite récupérée sur fibrillation ventriculaire.
L’âge moyen de ces patients était de 41 ans, 2/3 d’entre eux étaient des femmes, 70 % étaient porteurs d’un PVM bivalvulaire et 93 % d’un rehaussement tardif documenté par IRM au niveau des muscles papillaires et sous le feuillet postérieur mitral suggérant la présence de fibrose pariétale localisée.
Ces auteurs ont proposé le concept de prolapsus « arythmogène » pour les PVM remplissant ces critères. Dans un autre travail comparant 36 patients avec PVM « arythmogène » et rehaussement tardif ventriculaire gauche documenté par IRM sans IM significative à 16 patients avec PVM sans rehaussement tardif(3), cette équipe a rapporté que la présence d’une disjonction annulaire (définie comme une solution de continuité fibreuse entre le mur ventriculaire gauche inféro-latéral et la portion postérieure de l’anneau mitral, figures 1 et 2) était constante chez les patients avec fibrose ventriculaire gauche. La présence d’un mouvement de « curling », défini comme un enroulement systolique postérieur du segment inféro-latérobasal, était corrélée à la disjonction annulaire et à l’étendue de la fibrose. L’hypothèse physiopathologique proposée place la disjonction annulaire au centre de la physiopathologie de la mort subite associée au PVM, en générant un mouvement d’enroulement systolique et une traction anormale sur la paroi ventriculaire gauche postérieure, notamment au niveau de la zone d’insertion du muscle papillaire postérieur créant la fibrose pariétale et le substrat des arythmies ventriculaires. Cette hypothèse est cohérente avec la présence fréquente d’ondes T négatives dans les dérivations inférieures chez ces patients.
Figure 1. Mesure de la disjonction annulaire mitrale en IRM, depuis la jonction entre mur atrial et feuillet mitral postérieur jusqu’au sommet du segment inféro-latéro-basal.
Figure 2. Aspect de maladie myxoïde sévère (PVM complexe) en coupe échographique long axe, associant prolapsus bivalvulaire mitral profond, épaississement des feuillets et disjonction annulaire.
Enfin, une dernière étude multicentrique cas-témoin a inclus 42 patients ayant bénéficié de l’implantation d’un défibrillateur automatique en prévention secondaire d’une mort subite rythmique ressuscitée, présentant par ailleurs un PVM sans autre cardiopathie(4). Ces patients ont été comparés à un groupe contrôle apparié sur l’âge, le sexe, le degré d’insuffisance mitrale, la présence d’une fibrillation atriale et la fraction d’éjection ventriculaire gauche. L’âge moyen lors de la mort subite était de 44 ans, 70 % des patients étaient des femmes, tous avaient une fraction d’éjection normale et 37/42 présentaient une IM minime. Un antécédent de syncope ou de lipothymie était significativement plus fréquent chez les cas. La fréquence et la complexité des extrasystoles ventriculaires étaient supérieures chez les cas, émanant en règle du muscle papillaire postérieur (aspect de retard droit axe gauche) avec un épisode de tachycardie ventriculaire non soutenue documentée chez 50 % des cas pour aucun des contrôles. Sur le plan échographique, le phénotype du PVM était plus marqué chez les cas avec un PVM plus profond, une fréquence supérieure de PVM bivalvulaire, d’épaississement des feuillets et de disjonction annulaire.
Trois variables apparaissaient indépendamment associées à l’antécédent de mort subite : une histoire personnelle de syncope, la charge en extrasystoles ventriculaires émanant du muscle papillaire postérieur et la présence d’une maladie myxoïde sévère définie par un prolapsus bivalvulaire profond, des feuillets mitraux épaissis et une disjonction annulaire (figures 1 et 2).
Que retenir ?
Il semble qu’un petit groupe de patients avec PVM soit à risque de mort subite malgré l’absence fréquente de fuite mitrale sévère. Il s’agit typiquement de femmes jeunes dont l’histoire personnelle est émaillée de palpitations, de syncopes et de fréquentes extrasystoles ventriculaires émanant du muscle papillaire postérieur ; leur prolapsus est en règle bivalvulaire profond avec feuillets épaissis, disjonction annulaire et mouvement d’enroulement de la paroi ventriculaire gauche postérieure, méritant l’appellation de PVM complexe ou de maladie myxoïde sévère.
Une hypothèse physiopathologique préliminaire pourrait placer la maladie myxoïde sévère, et notamment la disjonction annulaire au centre du schéma, générant un stress mécanique sur le mur ventriculaire postérieur, responsable du développement d’une fibrose de remplacement, notamment au niveau de la zone d’insertion du muscle papillaire postérieur, constituant le substrat des arythmies ventriculaires complexes.
À ce stade, les éléments caractérisant ce petit sous-groupe à risque rythmique ventriculaire sont imparfaits et nécessitent d’être complétée par de nouveaux critères encore à identifier. La prise en charge thérapeutique préventive des patients avec prolapsus considéré comme « arythmogène » n’est pas clairement définie et justifie une discussion en Heart Team.
Place du MitraClip dans l’insuffisance mitrale primaire
Le MitraClip est la première technique de plastie mitrale percutanée bord à bord (figure 3). Depuis environ 10 ans, plus de 60 000 patients dans le monde ont pu bénéficier de cette intervention qui mime l’intervention d’Alfieri et qui est maintenant prise en charge par l’Assurance maladie pour les patients présentant une « insuffisance mitrale (IM) sévère, d’origine dégénérative (organique), symptomatique malgré une prise en charge médicale optimale, non éligibles à la chirurgie et répondant aux critères échocardiographiques d’éligibilité(5) ». La procédure nécessite un guidage échocardiographique très précis permis par le développement de l’échocardiographie transœsophagienne (ETO) 3D.
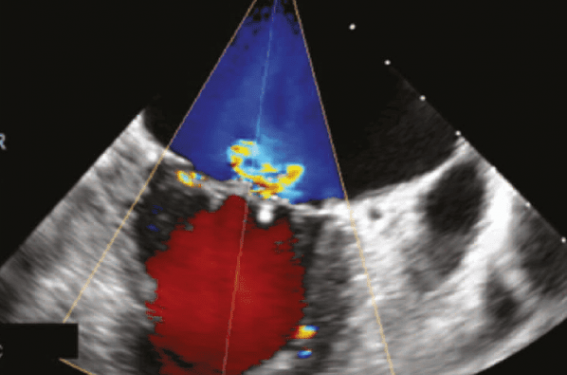
Figure 3. ETO 3D avec vue chirurgicale « en face » de la valve mitrale après pose d’un clip. Aspect de double orifice mitral mimant la technique d’Alfieri.
L’échocardiographiste a un rôle clé dans la procédure et la communication entre échocardiographistes et cardiologues interventionnels est indispensable. L’ETO 3D permet de confirmer le mécanisme et la localisation de l’IM, de mesurer la hauteur et la largeur du prolapsus et de détecter d’éventuelles indentations profondes (clefts).
L’analyse fine de la valve mitrale en ETO est possible grâce à plusieurs modalités : le mode biplan centré sur la coupe bicommissurale (figure 4A) qui permet de balayer la valve mitrale avec analyse simultanée dans 2 plans orthogonaux en temps réel de la partie latérale (A1-P1) vers la partie médiale (A3-P3) et qui permet de localiser l’origine de la fuite lorsqu’il est couplé au Doppler couleur (figure 4B), le mode Zoom 3D permettant de visualiser la valve mitrale en vue chirurgicale « en face » et la reconstruction multicoupe. Le cas idéal est une pathologie centrale (A2-P2), sur une valve mitrale non calcifiée, avec une ouverture mitrale > 4 cm2, une longueur de la partie mobile de la petite valve > 10 mm, sur des prolapsus de moins de 15 mm de largeur (figure 5) et de 10 mm de hauteur(6).
Figure 4. Coupe bicommissurale ETO en mode biplan sans (A) et avec couleur (B) retrouvant un prolapsus de P2 avec rupture de cordage.
Figure 5. ETO 3D avec vue chirurgicale « en face » de la valve mitrale et mesure de la largeur du prolapsus de P2.
Cependant, avec l’expérience des équipes, des fuites anatomiquement plus complexes (prolapsus commissuraux par exemple) peuvent être corrigées avec succès(7). Les maladies de Barlow avec excès tissulaire important sont maintenant traitées avec de bons résultats depuis l’apparition de la nouvelle génération de clip XTR. Certains cas restent bien sûr déconseillés, voire contre-indiqués, notamment les formes avec calcifications extensives des feuillets en zone de grasping, les valves postérieures très courtes (< 7 mm) et les formes sténosantes (gradient moyen > 5 mmHg, surface < 3,5 cm2) (tableau 1). Lorsque les critères échocardiographiques d’éligibilité sont respectés, le taux de succès de la procédure est excellent, de l’ordre de 96 % avec très peu de complications(7), ce qui pose la question de son indication chez les patients à haut risque chirurgical, mais non contre-indiqués par la Heart Team, dont la fragilité est parfois mal reflétée par les scores de risques classiques. Le PHRC en cours MITRA-HR nous permettra de répondre à cette question dans un futur proche.
Faut-il opérer toutes les insuffisances mitrales sévères asymptomatiques par prolapsus ?
Ces 30 dernières années ont été marquées par une évolution des profils étiologiques des insuffisances mitrales (IM) primaires.
Ainsi, le prolapsus valvulaire mitral (PVM) associé ou non à une rupture de cordage est devenu la 1re cause d’IM primaire sévère dans les pays occidentaux.
Parallèlement, l’avènement des nouvelles méthodes échographiques de quantification, la connaissance de l’histoire naturelle et surtout les progrès de la chirurgie reconstructrice ont progressivement modifié la prise en charge qui a évolué d’une attitude conservatrice vers des indications chirurgicales de plus en plus précoces chez des patients parfois asymptomatiques.
Il est clairement admis que l’apparition d’une symptomatologie fonctionnelle à type de dyspnée d’effort est un tournant évolutif majeur.
Cette symptomatologie signifie un risque important d’insuffisance cardiaque et de surmortalité qui doit conduire à retenir une indication chirurgicale rapide en l’absence de contreindication. Chez les patients asymptomatiques, des indications chirurgicales basées essentiellement sur des facteurs rythmiques et échographiques sont admises par la Société européenne de cardiologie. Par contre, certains auteurs défendent une chirurgie plus « précoce » chez des patients strictement asymptomatiques, en rythme sinusal, avec fraction d’éjection (FE) préservée, ventricule gauche peu dilaté, quand le risque opératoire est faible et la plastie quasi certaine. Cette attitude chirurgicale appelée « early surgery » par les Anglo-Saxons ne fait pas l’unanimité(8). Elle est d’ailleurs régulièrement l’objet de controverses animées dans les grands congrès internationaux de cardiologie.
Les indications classiques de chirurgie
La plastie mitrale quand elle est possible avec une haute probabilité de bons résultats à distance est actuellement le traitement de référence de l’IM primaire. Les procédures percutanées comme le MitraClip ne sont envisagées qu’en cas de risque opératoire élevé ou de contre-indication à la chirurgie, uniquement chez des patients symptomatiques. Les indications classiques de la chirurgie chez les patients asymptomatiques sont basées sur des données d’histoire naturelle et les déterminants pronostiques essentiellement recueillis chez des patients atteints de PVM. Le tableau 2 résume les indications de chirurgie (recommandations européennes de 2017) chez ces patients asymptomatiques(8). Ainsi, l’apparition chez les patients asymptomatiques de troubles du rythme supraventriculaire, de critères échocardiographiques en faveur d’une dysfonction ventriculaire gauche (fraction d’éjection < 60 %, DTS > 40 mm ou > 45 mm), d’une hypertension pulmonaire (PAPs > 50 mmHg vérifiée par cathétérisme droit) et d’une dilatation de l’oreillette gauche (> 60 ml/m2) conduisent à discuter d’une chirurgie en tenant compte de l’âge, des comorbidités, du risque opératoire et de la probabilité de réaliser une plastie de qualité. Cette chirurgie doit être réalisée dans un centre chirurgical de référence pour la plastie mitrale.
La controverse
Le choix entre chirurgie et surveillance attentive dans l’IM sévère par prolapsus chez les patients asymptomatiques encore en rythme sinusal avec fonction VG « préservée » (FEVG > 60 %, DTS < 40 mm), PAP systolique < 50 mmHg, et volume OG < 60 ml/m2 est controversée.
Une chirurgie « préventive » ou « précoce » dans ce type ne peut se discuter que si la réparation valvulaire est réalisable de façon quasi certaine avec un bon résultat à long terme et un risque opératoire très faible, ce qui est le cas dans la majorité des IM par PVM.
Les recommandations européennes(8) préconisent clairement une surveillance clinique et échocardiographique semestrielle de ces patients asymptomatiques. Elles se basent sur les travaux de l’équipe de Vienne qui a récemment rapporté les résultats à long terme de leur série prospective de 280 patients asymptomatiques (âge moyen 58 ans) atteints d’une IM par prolapsus, suivis régulièrement cliniquement et échocardiographiquement dans un centre expert en valvulopathies, pendant une durée médiane de 93 mois(9). Une indication chirurgicale était retenue devant l’apparition d’une symptomatologie fonctionnelle, de troubles du rythme supraventriculaire, d’une PAPS > 50 mmHg ou de signe de dysfonction ventriculaire gauche (FEVG < 60 %, diamètre télésystolique VG > 40 mm). La survie est excellente (85,6 % à 10 ans et 74,5 % à 15 ans), similaire à celle de la population témoin autrichienne de 2012 appariée sur l’âge et le sexe. Environ 20 % des patients ont développé dans cette série une indication chirurgicale (essentiellement apparition de symptômes) à 2 ans, 50 % à 6 ans 65 % à 10 ans et 80 % à 15 ans.
Cette stratégie « attentiste » impose une surveillance rigoureuse et donc des patients « compliants » au sein d’une filière structurée, afin d’éviter qu’ils ne soient perdus de vue et que les « triggers » classiques d’intervention ne soient identifiés trop tardivement.
Inversement, certaines équipes défendent une chirurgie plus précoce(10,11). Des séries prospectives et rétrospectives observationnelles de PVM sont en faveur de cette attitude « plus agressive », le succès de la plastie à long terme étant le plus souvent prévisible et le risque opératoire faible (inférieur à 2 %). D’après ces travaux, la mortalité et la morbidité cardiovasculaires à long terme seraient nettement moindres en cas de chirurgie précoce. Cette dernière réduirait le risque de survenue d’insuffisance cardiaque, de FA et de dysfonction VG, par comparaison à la surveillance médicale classique. Les recommandations américaines AHA/ACC(12) penchent plutôt dans ce sens et retiennent une indication de classe IIa (niveau de preuve C) dans un contexte d’IM sévère asymptomatique en rythme sinusal, sans dysfonction VG, mais uniquement si les conditions suivantes qui sont exigeantes sont respectées : risque opératoire très faible et plastie quasi certaine réalisée dans un centre expert avec une haute probabilité de bon résultat à long terme.
Comme nous l’avons vu, les recommandations européennes préconisent clairement pour ces patients une surveillance médicale clinique et échographique rigoureuse semestrielle. Elles soulignent que seul un essai randomisé pourra résoudre cette controverse et répondre à cette question importante, et qu’en son absence, le suivi médical doit être conseillé. Dans ce sens, un PHRC national (« REVERSE MR ») coordonné par l’équipe d’Amiens a débuté dans plus de 20 centres experts français. Il s’agit d’une étude prospective, randomisée, multicentrique en ouvert comparant la chirurgie précoce (« early surgery ») à la surveillance classique (« watchful waiting ») dans les IM sévères asymptomatiques par PVM, sans indication chirurgicale classique (tableau 1), à faible risque opératoire et haute probabilité de plastie. L’objectif principal est de comparer la chirurgie conservatrice mitrale précoce à une prise en charge initiale médicale (chirurgie différée) en termes de mortalité totale et de morbidité cardiovasculaire sur un suivi de 5 ans et d’établir quelle est la meilleure stratégie.
Nous vous donnons rendez-vous à la prochaine édition de Cardiovalves, qui aura lieu à Tours les 12 et 13 mars 2021. Une fois de plus, les meilleurs experts français et internationaux seront présents pour discuter des dernières avancées scientifiques dans le domaine des valvulopathies. Les échanges, les partages d’expériences, la convivialité et l’interactivité seront une nouvelle fois privilégiés.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :