Publié le 14 mai 2015Lecture 17 min
Diagnostic et prise en charge de l’embolie pulmonaire - À propos des dernières recommandations de l’ESC
É. FERRARI, Service de cardiologie, CHU de Nice

L’ESC 2014 a mis à jour les recommandations sur l’embolie pulmonaire (EP), son diagnostic et sa gestion. Les dernières recommandations dataient en effet de 2008. Ces nouvelles directives sont là pour aider le praticien dans la prise de décision d’une pathologie fréquente, grave et trompeuse, mais elle ne nous affranchissent pas de notre analyse personnelle au cas par cas et de notre responsabilité.
Épidémiologie : des données importantes
La maladie thromboembolique veineuse est la 3e pathologie cardiovasculaire en termes de fréquence. L’incidence annuelle moyenne est de 100 à 200 pour 100 000 soit 1 pour 1 000 avec un risque qui double pour chaque décennie supplémentaire. L’incidence annuelle chez l’enfant est de 1 à 5 pour 100 000. Sur une étude européenne publiée en 2004 concernant 6 pays et une population totale de 450 millions d’habitants, 317 000 décès étaient rapportés à une TVP-EP, chiffre clairement sous-estimé quand on sait la difficulté diagnostique d’une EP.
Les facteurs de risque sont connus, on peut insister cependant sur la situation de la grossesse où l’EP représente la 1re cause de mortalité non obstétricale, les fécondations in vitro, la contraception orale et le traitement substitutif hormonal de la ménopause toutes causes qui devraient engendrer un sexe ratio féminin si les femmes ne récidivaient moins que les hommes.
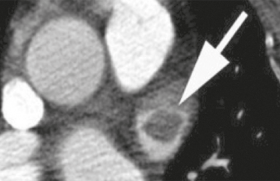
Image scannographique évidente d’EP.
Image scannographique un peu moins évidente d’EP.
On a pu penser pendant longtemps qu’il n’y avait que peu de liens entre la thrombose veineuse et la thrombose artérielle. Depuis quelques années on sait que des facteurs de risque communs existent : obésité, hypercholestérolémie, hypertension artérielle, diabète. On sait aussi qu’un patient qui a présenté une TVPEP, surtout non provoquée, est un patient à risque ultérieur de coronaropathie ou d’événement athéro-thrombotique.
Récurrence : le taux de récurrence sous traitement n’est pas nul et n’est pas synonyme de cancer évolutif sous-jacent. Il a été rapporté à 2 % lors des 2 premières semaines et jusqu’à 8 % à 6 mois mais ces chiffres surestiment largement le risque si le traitement est bien conduit.
Le taux de récurrence à l’arrêt d’un traitement anticoagulant (AC) a été rapporté à 13 % à 1 an (taux qui paraît là aussi plus élevé que dans des données récentes et dans la vraie vie), 23 % à 5 ans 30 % à 10 ans). Ces récurrences sont d’autant plus importantes que la TVP-EP n’est pas provoquée et que le patient est déjà un récidiviste, a fortiori si les facteurs de risque persistent. En revanche ces récurrences ne dépendent pas de la gravité initiale du tableau. Enfin la règle est que dans 80 % des cas les récidives de TVP seront des TVP alors que les récidives d’EP seront des EP.
Un taux élevé de D-dimères pendant ou après la fin d’un traitement AC est en faveur d’un taux de récurrence plus élevé mais il n’est pas démontré que cela justifie un traitement au long cours. Les thrombophilies isolées ont une faible valeur prédictive de récurrence.
Après une EP, le risque d’évolution vers une HTAP postembolique est de 2 à 3 % à 3 ans et n’est pas dépendant de la gravité du tableau initial. Cette évolution défavorable peut se voir malgré une totale normalisation des pressions pulmonaires sur des contrôles précoces.
Les recommandations
Le diagnostic et la prise en charge reposent sur une abondante littérature qui permet de graduer les recommandations et qui est celle usuellement utilisée en cardiologie. Pour rappel :
- classe I : le poids de la recommandation est fort et il pourrait s’agir d’une grave erreur de ne pas la suivre.
- classe II : les résultats de l’« evidence based medecine » sont divergents :
• classe II a : ils sont en faveur du conseil donné,
• classe II b : ils laissent un doute sur l’utilité de la mesure conseillée ;
- classe III : les résultats de l’« evidence based medecine » sont clairement en défaveur d’une attitude indiquée. Celle-ci peut être délétère si elle est prise. Il est donc recommandé de ne pas faire.
Ces grades de recommandations sont pondérés du « niveau d’évidence » :
- niveau A quand les résultats découlent de plusieurs essais randomisés ou de métaanalyses ;
- niveau B quand les résultats découlent d’une seule étude randomisée ou d’un large essai non randomisé ;
- niveau C quand il n’y a pas d’essai randomisé pour soutenir la proposition. Celle-ci ne découlant que d’avis d’experts, de petits essais, d’études rétrospectives ou de registres.
Le diagnostic d’embolie pulmonaire
Le diagnostic d’EP est un problème majeur. Il est important de savoir que sur 100 patients chez lesquels on suspecte une EP, 10 à 35 % seulement en auront effectivement une. Cela sous-entend que l’on prescrit des examens « inutiles » chez 60 à 65 % des patients suspects d’EP. Un « triage » correct ainsi qu’une bonne évaluation de la probabilité pré-test sont donc indispensables afin d’éviter, autant que faire se peut, des examens inutiles avec leurs désagréments, leurs complications, leur coût, mais aussi leur risque de faux positifs qui peut conduire à la mise en route de traitements anticoagulants inutiles mais dangereux.
Le tableau 1 montre la similitude des présentations cliniques entre une cohorte de patients qui sont pris en charge pour une authentique EP et une autre où les patients sont pris en charge pour une suspicion d’EP qui finalement n’en est pas une. La similitude est explicite.
De l’autre côté, le taux de mortalité de l’EP initiale non traitée est élevée, proche de 10-15 %, voire plus et impose de ne pas passer à côté d’une EP.
Comme pour le diagnostic de coronaropathie, la circonstance de survenue et le terrain sont des éléments majeurs à considérer. Pour l’orientation diagnostique d’une EP, une dyspnée brutale n’a pas la même valeur chez un patient présentant une cardiopathie connue que chez un autre sans antécédent pulmonaire traité pour un cancer de la prostate sous hormonothérapie et qui aura été immobilisé 10 jours pour une dorsalgie.
Scores de probabilité
Le « jugement » clinique est donc capital dans le diagnostic et a été validé dans d’anciennes études mais, tous les médecins n’ayant pas le même bagage et les mêmes connaissances de l’EP, des scores de probabilité diagnostique ont été créés pour aider tout le monde.
Ainsi, malgré la pauvre sensibilité- spécificité des signes cliniques, leur combinaison prend un poids différent et est à la base de la construction des scores de probabilité pré-tests. Le score de Wells et le score de Genève (tableaux 2 et 3) sont d’utilisation plutôt facile surtout dans leur version simplifiée. Ils ont été validés dans des études prospectives. Ils sont d’une grande aide pour l’urgentiste dont l’EP n’est pas forcément la tasse de thé. Ils ne prennent en compte que l’examen clinique (dont l’interrogatoire fait partie) et à ce titre sont très faciles à mettre en œuvre.
Le système n’est pas binaire. Une faible probabilité d’EP pré-test évaluée par ces scores correspondra tout de même à une incidence d’EP de 10 %. Une probabilité intermédiaire ou modérée correspondra à une incidence de 30 %. Et en cas de probabilité forte l’incidence de l’EP sera de 65 %.
L’exemple ou le contre-exemple classique est la jeune femme de 26 ans qui prend une pilule estroprogestative depuis 3 mois et se plaint brusquement d’une dyspnée pour des efforts modérés avec une tachycardie au repos à moins de 100/min, l’absence de signe de TVP ou d’hémoptysie. Ses scores de Wells et de Genève seront à 0. Comment pourtant ne pas évoquer une EP ?
Utilisation des D-dimères
Excepté pour un risque pré-test très élevé, condition dans laquelle leur dosage n’est pas utile, les D-dimères sont l’examen biologique de débrouillage facile qui peut permettre d’éviter des examens complémentaires lourds.
Leur négativité en cas de suspicion faible ou modérée d’EP doit faire remettre en cause le diagnostic. C’est donc bien leur valeur prédictive négative qui est utilisée. Pas question de traduire une positivité des D-dimères comme un argument évocateur d’ EP.
L’utilisation des D-dimères comme élément de triage permet d’éviter l’enchaînement d’examens lourds dans 30 % des cas. C’est bien le but recherché.
De nombreuses études ont montré qu’il était « sûr » d’oublier l’hypothèse de l’EP lorsque les D-dimères étaient négatifs avec un taux d’événement à 3 mois < 1 %.
Les recommandations insistent sur l’interprétation des D-dimères en fonction de l’âge. En effet, la valeur normale des D-dimères augmente avec l’âge. On considère qu’après 50 ans, on peut incrémenter de 10 % la valeur seuil par dizaine d’années.
Le scanner thoracique et son interprétation en fonction de la probabilité pré-test
Grâce aux progrès techniques de l’imagerie le scanner est clairement devenu l’examen clé pour le diagnostic d’une EP. Il permet une visualisation fiable au moins jusqu’aux branches segmentaires.
La sensibilité et la spécificité du meilleur scanner n’est pourtant pas de 100 % et il est important d’intégrer la probabilité clinique pré-test comme pondérateur de la décision finale.
L’étude PIOPED II avait montré que pour le même résultat scannographique « en faveur » d’une EP, une probabilité clinique prétest non faible correspondait à un diagnostic final d’EP de 95 % mais de seulement 58 % en présence d’une probabilité clinique pré-test faible.
Écho-Doppler veineux : la visualisation du thrombus n’est pas indispensable.
Cela signifie que, pour peu qu’il connaisse l’EP, le clinicien doit garder « la main » sur le diagnostic final et ne pas se laisser guider uniquement par un résultat d’imagerie. Cette règle est quotidiennement appliquée et confirmée dans notre pratique. La mauvaise interprétation d’un scanner peut être due à un radiologue inexpérimenté (d’où l’intérêt d’apprendre à interpréter le scanner pour les centres qui voient beaucoup d’EP), mais aussi à un examen mal fait en particulier une injection du produit de contraste trop rapide ou trop tardive ou un patient qui n’aura pu garder l’apnée.
Par ailleurs, l’utilisation large de scanners injectés permet avec une fréquence croissante de découvrir des EP chez des patients sans symptômes chez lesquels le scanner était demandé pour un autre problème. Ceci nous confirme que l’histoire naturelle de l’EP garde des mystères.
L’angiographie n’est plus recommandée.
La scintigraphie ventilation-perfusion
Selon les recommandations, cet examen qui épargne une injection d’iode pourrait être privilégié chez les sujets non hospitalisés, sans antécédents pulmonaires, jeunes, ceux avec une probabilité pré-test faible, chez les femmes enceintes, les allergiques à l’iode, les insuffisants rénaux et les myélomes. Le problème de la scintigraphie est l’interprétation des résultats. Contrairement au scanner, les caillots ne sont pas vus et on ne peut donc parler que de probabilité (cette fois-ci post-test) d’EP.
Aux anciennes formulations des résultats utilisés par les scintigraphistes : examen normal ou proche de la normale, probabilité faible, intermédiaire ou élevée, les derniers guidelines recommandent de substituer une formulat ion de résul tat en 3 niveaux : scintigraphie normale (qui exclura l’EP), forte probabilité, et scintigraphie non contributive. Ceci revient à dire que seules les scintigraphies normales ou très en faveur d’une EP seront utiles au clinicien. Ces 2 situations ne sont pas les plus fréquentes. Et le souci du clinicien doit être d’éviter de demander une scintigraphie lorsque des antécédents, en particulier emphysème ou bronchite chronique rendront son interprétation difficile. L’angiographie n’est plus recommandée et l’IRM n’est pas encore au point dans le diagnostic d’EP.
L’écho-Doppler veineux
Une thrombose veineuse profonde (TVP) est retrouvée dans 30 à 50 % des EP. La sensibilité de l’échographie pour le diagnostic de TVP est > 90 % chez les patients symptomatiques.
La mise en évidence d’une TVP chez un patient suspect d’EP suffit pour confirmer le diagnostic.
Cette possibilité dans l’algorithme décisionnel est trop souvent oubliée.
Le critère de non compressibilité de la veine reste le signe séméiologique le plus important. La recherche de ce signe échographique au niveau des seuls « 4 points » : fémorales communes et poplitées, est une solution pratique mais moins sensible que le contrôle de tous les axes veineux.
Le tableau 4 montre les différentes situations possibles obtenues en fonction des résultats d’examens diagnostiques non invasifs. Certaines permettent un diagnostic d’EP formel (à condition que l’interprétation du résultat soit sans équivoque) d’autres ne suffisent pas ou doivent laisser le doute.
Algorithme de prise en charge
Les algorithmes de prise en charge recommandés par l’ESC distinguent 2 situations cliniques bien distinctes. Ces 2 situations n’ont pas la même prévalence mais nécessitent une réactivité différente.
La suspicion d’EP chez un patient en hypotension ou en choc
(figure 1)
Dans cette situation, sauf si un scanner est disponible tout de suite sans prise de risque pour le patient, l’échocardiographie est l’examen de référence et permet de confirmer ou non une EP mais aussi d’éliminer d’autres étiologies qui peuvent mimer une EP. Le scanner pourra être fait après stabilisation hémodynamique.
Figure 1. Prise en charge chez un patient suspect d’EP avec hémodynamique instable.
La suspicion d’EP chez un patient qui n’est pas instable
(figure 2)
Si la suspicion d’EP survient chez un sujet qui n’est pas en situation hémodynamique précaire. Il faut :
- établir la probabilité clinique pré-test ;
- doser les D-dimères si cette probabilité n’est pas forte ;
- penser à un autre diagnostic si les D-dimères sont normaux ;
- et envisager une imagerie si les D-dimères ne permettent pas d’exclure l’EP.
La plupart des praticiens qui ont retenu ce dernier algorithme vont ensuite faire appel au scanner. Ceci n’est pas une faute et correspond d’ailleurs à une pratique très répandue dans les services d’urgence, mais il ne faut pas oublier que la mise en évidence d’une TVP chez un patient suspect d’EP suffit à conforter le diagnostic et à mettre en route le traitement nécessaire. Cette option est utile chez un patient insuffisant rénal ou allergique à l’iode chez lequel le scanner est contre-indiqué a fortiori si des antécédents pulmonaires rendent la pertinence d’une scintigraphie faible.
Mais cela nécessite de s’affranchir stricto sensu de l’imagerie pulmonaire, ce qui pour certains semble une démarche intellectuelle très compliquée.
Figure 2. Prise en charge chez un patient suspect d’EP sans hémodynamique instable.
Stratification du risque
Une fois le diagnostic posé, l’évaluation du pronostic est devenu un moment très important. Elle permet d’adapter le traitement, la surveillance, la nécessité et le lieu d’une hospitalisation.
Le score PESI (Pulmonary Embolism Severity Index) (tableau 5) est le plus utilisé et le mieux validé. A fortiori la version simplifiée de ce score est par définition facile d’utilisation. Un âge > 80 ans, un cancer, une insuffisance cardiaque ou respiratoire, une FC > 110, une PAS < 100 mmHg, une saturation < 90 % sont les 7 critères retenus. La présence d’au moins 1 de ces critères fait passer la mortalité à 30 jours de 1 % à 30 %.
Les recommandations de l’ESC permettent d’évaluer le niveau de gravité et d’évaluer la mortalité à J30 par le score PESI mais aussi la mortalité immédiate (tableau 6) sur la clinique, la présence d’une dysfonction VD et les biomarqueurs.
La distinction de 2 strates dans le risque intermédiaire est une des ajouts des recommandations.
- Les « Haut risque » sont les EP en hypotension ou en choc dont le score PESI simplifié est > 1 avec une dysfonction VD sur l’écho et des biomarqueurs positifs.
- Les risques « intermédiaires » ne sont pas en hypotension mais ont un PESI > 1 ; ils présenteront une dysfonction VD et des biomarqueurs positifs pour la strate « risques intermédiaires élevés » et un seul de ces 2 derniers critères pour les « risques intermédiaires faibles ».
- Enfin les « bas risque » ne doivent présenter aucun de ces 4 critères.
En pratique, les « haut risque » doivent être gérés dans une ambiance de soins intensifs ou de réanimation, alors que chez les « bas risque » peut se discuter un traitement ambulatoire. Les recommandations ne disent pas en revanche quelle peut être l’utilité de distinguer les risques intermédiaires. Mais dans notre expérience il est préférable que ces patients dont la tolérance hémodynamique de l’EP n’est pas bonne soient surveillés dans une structure de soins intensifs.
Précisons que si l’évaluation de la situation hémodynamique initiale est une étape évidente (classe IB), la stratification du risque par le score PESI ou la recherche des critères de dysfonction VD et les biomarqueurs sont une recommandation de niveau IIaB.
Diagnostic d’EP chez la femme enceinte
La grossesse peut induire une dyspnée « physiologique », induire une tachycardie, une hypoxie, des oedèmes des membres inférieurs et une élévation du taux des D-dimères, toutes modifications qu’il faut avoir à l’esprit pour interpréter un tableau clinique évoquant une EP.
La suspicion d’EP chez la femme enceinte est un dilemme, en effet, la demande d’examens complémentaires ne doit pas être galvaudée compte tenu du risque d’irradiation ou de dysthyroïdie chez le foetus mais le diagnostic ne peut rester incertain compte tenu de la gravité de l’EP chez la femme enceinte.
Le tableau 7 montre les irradiations attendues par le foetus en fonction des examens prescrits. On voit qu’une radio thoracique entraîne une faible irradiation et que la scintigraphie est moins irradiante que le scanner. Mais là encore, l’écho-Doppler non irradiante peut sauver de nombreuses situations.
Traitement
En dehors des situations de choc ou d’hypotension sévère qui peuvent nécessiter un support par des drogues vasoconstrictrices et l’adaptation d’un éventuel remplissage, le traitement de base d’une EP reste l’anticoagulation. Bien que non discutée dans les recommandations de l’ESC, celleci peut débuter avant confirmation diagnostique si la probabilité est élevée, à condition que ça ne retarde pas la confirmation diagnostique.
Le tableau 8 montre les héparines qui ont une AMM en Europe et leur posologie. L’héparine non fractionnée est bien sûr utilisable, mais compte tenu de la difficulté d’obtention d’un TCA dans la cible et de la nécessité d’une seringue autopousseuse, elle est de plus en plus réservée aux patients insuffisants rénaux. Après institution de l’héparinothérapie, le relais peut se faire de façon conventionnelle, précoce par les AVK avec INR cible à 2,5.
Une des nouveautés de la prise en charge de l’EP est la prise en compte des anticoagulants oraux directs (AOD) qui ont légitimement trouvé une place de choix dans ces recommandations.
Basés sur les études de la littérature, les 4 AOD connus en France (mais pas tous commercialisés à ce jour dans cette indication) sont recommandés avec un grade IB (le B parce qu’il n’y a eu qu’une étude randomisée pour chaque AOD). Attention à leur bonne utilisation et leur posologie.
Ainsi sont recommandés :
- le rivaroxaban à la dose de 15 mg x 2 pendant 21 jours puis 20 mg/j sans nécessité d’héparine préalable ;
- l’apixaban à la dose de 10 mg/j pendant 7 jours puis 5 mg/j sans nécessité d’héparine préalable ;
- le dabigatran à la dose de 150 mg ou 110 mg x 2 après 7 jours d’héparine ;
- l’edoxaban (la dose est non précisée dans les recommandations car le dossier d’autorisation était en instance au moment de leur écriture).
Il faut bien intégrer que le rivaroxaban et l’apixaban peuvent être utilisés sans héparine préalable mais que leur administration comporte une « dose charge », pour compenser cette absence d’héparine. Alors que le dabigatran et bientôt l’edoxaban seront utilisables après une durée minimale d’héparinothérapie mais sans dose charge. Ceci n’est que la conséquence des conditions dans lesquelles ces AOD ont été testés dans les études.
Comme avec les HBPM, les AOD sont contre-indiqués dès lors que la clairance de la créatinine est en dessous de 30 ml/min pour le rivaroxaban le dabigatran et l’edoxaban et < 25 ml/min pour l’apixaban.
Durée du traitement
La durée du traitement est toujours propice à de grandes discussions.
Les données de la littérature sont pourtant conséquentes et érigent de grands principes qui servent de base à l’élaboration des recommandations.
• Sauf cas de force majeure, un minimum de 3 mois de traitement anticoagulant est requis pour toute EP.
• La gravité initiale de l’EP n’est pas un critère de choix pour la durée du traitement.
• Quelle que soit leur durée d’utilisation, les anticoagulants ne permettent pas d’éviter les récidives après leur arrêt.
• Les récidives sont plus importantes lorsque l’EP était non provoquée au départ ou bien lorsque l’EP était provoquée mais que la cause n’a pu être exclue :
- 2,5 % de récidive annuelle après une EP provoquée de cause réversible ;
- 4,5 % de récidive annuelle mais jusqu’à 10 % lors de la première année après une EP provoquée.
Un traitement au long cours réduit de 90 % le risque de récidive mais entraîne, chez des patients sélectionnés, un risque d’hémorragie grave > 1 % par an.
Si bien que les recommandations (tableau 9) nous disent en particulier que :
- les EP provoquées ne doivent pas être traitées plus de 3 mois lorsque le facteur causal a disparu ;
- les 1ers épisodes d’EP survenant sur des thrombophilies majeures : syndrome des APL, déficit en protéine C ou S, facteur V ou II homozygote pourraient justifier d’un traitement prolongé. « Pourraient justifier », ce qui signifie que ces décisions doivent se prendre au cas par cas et ne doivent pas être systématiques ;
- il n’y a aucun résultat qui justifie de proposer un traitement au long cours sur des hétérozygoties en facteur V ou II ;
- en revanche, les récidivistes vrais (attention aux allégations de plusieurs épisodes) peuvent légitimer un traitement au « long cours ». « Au long cours » ne signifiant pas à vie. Le bénéfice/risque de ce traitement devant être régulièrement réévalué. Le risque hémorragique qui augmente avec l’âge ou avec l’apparition de comorbidités doit faire rediscuter le traitement même chez un récidiviste.
Des études d’extension de traitement avec les AOD ou l’aspirine ont été faites, d’autres sont encore en cours. Ces études ont cherché à évaluer le bénéfice/risque d’une extension du traitement AC après la phase initiale de 6 mois. Comme avec les AVK, leurs résultats (chez des patients sélectionnés qui n’auront pas saigné durant les 6 premiers mois) montrent une baisse importante des récidives, mais ici avec un taux de saignement « acceptable » en particulier lorsque la dose de l’AOD est diminuée (tableau 10). Avec l’aspirine les résultats sont moins convaincants. Les recommandations n’envisagent les AOD en traitement d’extension qu’en alternative aux AVK, c’est-à-dire quand la nécessité d’un traitement au long cours est argumenté, avec une force relativement faible IIaB.
Évolution vers un CPC
En dehors du risque de récidive et du saignement, le risque évolutif plus tardif d’une EP est celui de l’évolution vers une HTAP postembolique (tableau 11). L’incidence de cet événement a été rappelée en introduction. Une dyspnée persistante doit évoquer cette possibilité au-delà de 3 mois. Une écho qui montre un flux d’insuffisance tricuspide > 2,8 m/s doit alors faire pratiquer une scintigraphie. SI celle-ci n’est pas normale, un KT droit et une imagerie de l’arbre artériel pulmonaire peuvent être envisagés (figure 3).
La confirmation d’une HTAP postembolique est importante puisqu’elle peut légitimer un traitement de fond spécifique, une endartériectomie pulmonaire, voire une angioplastie des artères pulmonaires. Décisions qui doivent être prises par les équipes gérant les HTAP en France.
Figure 3. CAT en cas de suspicion d’HTAP postembolique. CPPE : coeur pulmonaire postembolique
Source : Task force members: 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. Site ESC Guidelines.
En pratique
L’embolie pulmonaire est une pathologie fréquente, grave, dont la prise en charge tant pour son diagnostic que pour son traitement et son suivi est parfaitement définie.
Les recommandations de l’ESC qui résument l’état de l’art actuel sont très bien faites, bien documentées et devraient restées utiles pendant de nombreuses années.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :