Cardiologie interventionnelle
Publié le 22 juin 2004Lecture 4 min
Physiopathologie de la resténose intrastent
O. VARENNE, hôpital Cochin, Paris
Les procédures de revascularisation percutanée par angioplastie se développent très rapidement dans le monde depuis les premiers cas réalisés par A. Gruentzig. Ces dernières années, l’amélioration des endoprothèses coronaires et de l’environnement pharmacologique anticoagulant et antiplaquettaire a permis de réaliser des actes de plus en plus complexes dans un environnement de plus en plus sûr. Malgré de nombreux essais thérapeutiques testant d’innombrables molécules, la survenue d’une resténose est la complication la plus fréquente des actes de cardiologie interventionnelle.
La resténose est généralement définie sur des critères angiographiques tels qu’une perte du gain de plus de 50 % ou la survenue d’une sténose intra-stent > 50 % après angioplastie.
Chez les patients qui n’ont pas bénéficié d’une angiographie systématique, la resténose est parfois définie par la récurrence angineuse après angioplastie, conduisant à une nouvelle revascularisation de l’artère cible.
Mécanismes de la resténose
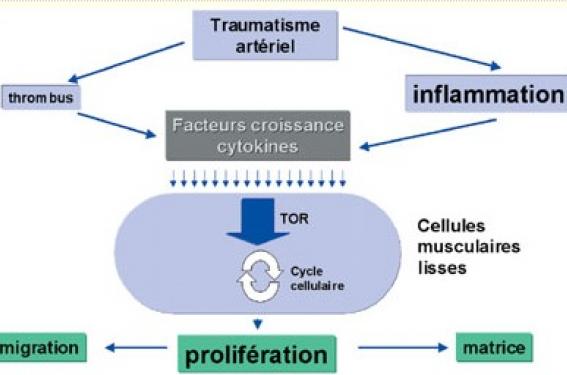
Après angioplastie au ballon seul, la resténose a été décrite dès les premières années de la technique et était liée à un phénomène de remodelage négatif aboli par la mise en place d’endoprothèses coronaires. La mise en place de stents endocoronaires permet d’éliminer le phénomène de remodelage négatif, mais elle s’associe à une stimulation de la prolifération des cellules musculaires lisses de la média, responsable d’une hyperplasie néo-intimale aboutissant à la resténose intrastent (figure).
Figure 1. Mécanismes de la resténose intrastent. TOR : Target of rapamycin.
La mise en place d’une endoprothèse coronaire produit un barotraumatisme responsable d’une déendothélialisation et d’une dissection plus ou moins étendue de la média. L’épaisseur de néo-intima est directement proportionnelle au degré de traumatisme infligé à la paroi. De plus, le traumatisme induit la formation d’un thrombus constitué en partie de plaquettes, dont l’activation conduit à la sécrétion de médiateurs biochimiques tels que le PDGF (platelet growth factor) et TGFa (transforming growth factor a) favorisant la prolifération des cellules musculaires lisses de la média et de l’adventice et leur migration vers l’intima à l’intérieur du vaisseau.
La mise en place d’une structure métallique en intravasculaire induit également une profonde réaction inflammatoire dès les premières heures après l’implantation du stent. Dans les premiers jours, les polynucléaires neutrophiles prédominent au niveau des mailles des stents. Après 30 jours, les lymphocytes sont présents dans 85 % des sections observées en histologie (Farb et al. Circulation 1999). Le degré d’inflammation est positivement et fortement corrélé à la réaction néo-intimale réactionnelle conduisant à la resténose.
L’inflammation et le traumatisme artériel induisent un effet additif sur la stimulation de la formation néo-intimale (Kornowski et al. JACC 1998). Les facteurs de croissance et les cytokines sécrétées par les leucocytes stimulent les protéines responsables de la prolifération cellulaire. Le pic de prolifération cellulaire évalué dans différents modèles animaux survient environ au septième jour après angioplastie coronaire, puis régresse pour devenir nul 28 jours après le barotraumatisme.
Une approche combinée, anti-inflammatoire et antiproliférative
Ainsi, si la prolifération cellulaire, et en particulier la prolifération des cellules musculaires lisses de la média, représente un acteur clé de la resténose intra-stent, elle n’en est pas seule responsable. Après avoir proliféré, les cellules musculaires lisses, sous l’action des médiateurs présents au site du traumatisme artériel, migrent sous l’action de métalloprotéases et sécrètent dans l’intima une abondante matrice extracellulaire impliquée dans l’encombrement volumétrique intrastent réalisé par la resténose.
La lutte contre une seule des étapes conduisant à la resténose ne permet pas une réduction efficace de celle-ci, qui nécessite une approche combinée antiproliférative et anti-inflammatoire, comme le réalisent les stents actifs au sirolimus et au paclitaxel.
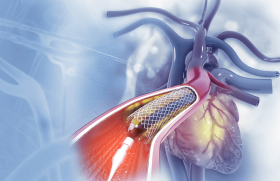
Si les études cliniques utilisant des médicaments par voie orale ont échoué à résoudre efficacement le problème de la resténose, c’est en partie en raison des concentrations locales nécessaires à l’obtention d’effets biologiques validés expérimentalement. Le stent, au contact de la paroi artérielle, est le plus à même de délivrer le produit actif au site précis du traumatisme infligé (figure 2) et ce, en permettant des concentrations locales très importantes, sans effet systémique délétère. Les modes d’action précis des produits efficaces seront détaillés dans les articles de E. Salengro et A. Ohanessian.
Figure 2. Stent actif intracoronaire libérant la drogue dans la paroi artérielle. Une fois déployé dans l’artère coronaire sténosée, le stent actif permet de délivrer le produit actif contenu dans la couche de polymère le recouvrant dans la paroi artérielle, siège des phénomènes conduisant à la resténose. Cette action ciblée, locale, permet d’éviter les fortes concentrations de produit actif dans la circulation générale et de limiter ainsi le risque d’effet secondaire (Boston Scientific).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :