Cardiologie interventionnelle
Publié le 01 oct 2020Lecture 8 min
La place de l’Impella® en salle de cathétérisme
Vassili PANAGIDES*/**, Marc LAINÉ*/**, Franck PAGANELLI*, Laurent BONELLO*/**, *Aix-Marseille université, service de cardiologie, AP-HM, Hôpital Nord, Marseille **MARS Cardio, Intensive Care Unit, CHU Nord Marseille
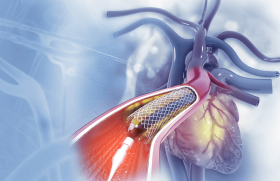
Les progrès technologiques ont permis un essor et une multiplication des outils thérapeutiques utilisés en cardiologie et implantés par voie percutanée. Parmi ces innovations, l’Impella® est un système d’assistance circulatoire qui pompe le sang de la cavité ventriculaire gauche et l’éjecte dans l’aorte de manière continue pouvant ainsi fournir un débit allant de 2,5 à 5 l/min selon le cathéter utilisé. Son utilisation, de plus en plus répandue en France et dans le monde, prend une place importante dans la stratégie thérapeutique des centres qui en disposent.
Dispositifs disponibles – caractéristiques – monitoring
Le système d’assistance ventriculaire Impella® comprend une famille de 4 pompes cardiaques :
– 3 dispositifs d’assistance ventriculaire gauche : l’Impella 2.5®, l’Impella CP® implanté par voie percutanée, et l’Impella 5.0® mise en place par abord chirurgical ;
– 1 dispositif d’assistance ventriculaire droite : l’Impella RP®.
Il s’agit d’une micropompe axiale correspondant à une vis d’Archimède montée sur un cathéter. Elle aspire le sang via un orifice d’aspiration dans le ventricule gauche vers l’orifice d’éjection dans l’aorte ascendante. La turbine d’aspiration est protégée de la formation de thrombus pas une infusion continue de sérum glucosé hépariné délivré de manière automatique. L’Impella CP® de plus gros calibre que l’Impella 2.5®, permet de fournir un débit continu de sang allant jusqu’à 4 l/min contre 2,5 l/min. Le diamètre du cathéter est de 9 Fr et celui du corps de pompe est de 14 Fr. En pratique, l’insertion du cathéter est réalisée après ponction de l’artère fémorale et mise en place d’un introducteur 14 Fr. Après franchissement de l’orifice aortique, l’opérateur y amène un guide 0,018’’ sur lequel sera montée la pompe. Elle est centrée sur l’orifice aortique sous scopie.
L’assistance par le dispositif Impella® permet une véritable décharge du ventricule gauche qui résulte de l’extraction active du sang de la cavité ventriculaire ce qui réduit à la fois le volume et la pression télédiastoliques ventriculaires gauches (VTDVG et PTDVG), la consommation myocardique et augmente le débit coronaire maximal(1).
La surveillance en soins intensifs est simplifiée par rapport à une ECMO et peut se résumer en « 3 P » : Pansement : cathéter verrouillé, surveillance du point de ponction, Purge : surveillance horaire du débit et de la pression de purge, Position : surveillance quotidienne échographique, radiographique, biologique ainsi que des courbes du courant moteur et de pression.
Pour quel patient ?
La disponibilité de cette assistance circulatoire, sa rapidité, sa facilité d’implantation et de surveillance ainsi que le débit généré en font un outil intéressant pour réduire les délais d’implantation et assurer la prise en charge des chocs cardiogéniques post-infarctus du myocarde. En particulier, sa mise à disposition dans les centres d’angioplastie permettrait de proposer sans délai une assistance circulatoire précoce et mieux répartie géographiquement dans cette indication. Il est essentiel compte tenu des complications associées, de son coût et des circonstances cliniques de sa pause de déterminer précocement si un patient est éligible.
Son utilisation doit dont s’inscrire dans des réseaux de soins experts en se basant sur des protocoles préétablis en collaboration avec les centres tertiaires.
Quelles indications ?
Choc cardiogénique compliquant un infarctus du myocarde
Le choc cardiogénique est un enjeu majeur, car le taux de mortalité reste élevé, compris entre 40 et 50 % à un mois(2,3). La première ligne thérapeutique concernant la prise en charge de ces patients est l’utilisation de médicamentsinotropes et/ou vasopresseurs afin d’augmenter la pression systémique en augmentant la contractilité myocardique (inotropes) ou le tonus vasculaire (vasopresseurs). Malheureusement, l’amélioration des paramètres hémodynamiques se fait au prix d’une augmentation de la consommation myocardique en oxygène et de la souffrance myocytaire.
La revascularisation coronaire de ces patients est à très haut risque puisqu’elle ajoute une instabilité hémodynamique supplémentaire à un tableau déjà précaire.
Une étude pilote menée par Seyfarth et coll. en 2008 (ISARSHOCK) a voulu comparer l’utilisation de l’Impella 2.5® au ballon de contrepulsion chez les patients en choc cardiogénique secondaire à un infarctus du myocarde. Cette étude portant sur 25 patients, a permis de démontrer la sécurité d’utilisation du dispositif et surtout une amélioration notable des paramètres hémodynamiques (augmentation de l’index cardiaque de 0,53 l/min vs 0,11 l/ min ; p = 0,02) en comparaison avec le ballon de contrepulsion intra-aortique(4).
L’étude randomisée prospective IMPRESS parue en 2017 a cherché à comparer deux populations en choc cardiogénique post-infarctus assistées soit par une Impella CP®, soit par un ballon de contrepulsion. Il n’existait pas, au terme de l’étude, de différence significative sur la mortalité entre les deux stratégies (mortalité 50 % dans le bras contrepulsion vs 46 % dans le bras Impella® ; p = 0,92). Il existe néanmoins de nombreuses limites à cette étude. Tout d’abord, 92 % des patients avaient présenté un ar rêt cardiaque récupéré impliquant un nombre important de lésions post-anoxiques non quantifiables. De plus, l’étude manquait de puissance avec seulement 48 patients inclus, expliquant peut-être l’absence de différence significative observée(5).
Les données du registre USpella portant sur 154 patients implantés d’une Impella 2.5® dans le cadre d’un choc cardiogénique post-infarctus du myocarde sont encourageantes puisqu’elles montrent sur des données de vraie vie une amélioration de la mortalité à 30 jours du groupe de patients assistés précocement par rapport au groupe de patients ayant bénéficié de l’Impella® post-revascularisation (65,1 vs 40,7 % ; p = 0,03)(6).
Ainsi, les données préliminaires sont en faveur de l’utilisation de cet outil dans le choc cardiogénique post-infarctus du myocarde. Cependant une étude randomisée est indispensable pour valider son utilisation.
Ces résultats prometteurs ont d’ailleurs amené le groupe USIC de la Société française de cardiologie à proposer un papier de consensus(7) sur l’utilisation des systèmes d’assistance circulatoire courte durée ainsi qu’un algorithme de prise en charge du choc cardiogénique en lien avec un infarctus du myocarde (figure 1). L’emploi de l’Impella® doit donc s’intégrer dans une stratégie thérapeutique protocolisée avec le centre tertiaire de référence. L’existence d’une « équipe choc cardiogénique » et de critères prédéfinis de sélection des patients est essentielle.
Figure 1. Algorithme proposé pour la prise en charge du choc cardiogénique sur infarctus du myocarde.
Bridge to…
Dans le choc cardiogénique toutvenant comprenant d’autres étiologiques que l’infarctus du myocarde, l’évolutivité des patients est hétérogène.
Une des classifications fonctionnelles utilisées est la classification INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support) (tableau 1).
Deux cas de figure nécessitant une assistance sont rencontrés :
– l’évolution rapidement péjorative (INTERMACS I) nécessitant la mise en place rapide d’une assistance circulatoire dont le choix dépendra de la disponibilité du centre ;
– l’évolution lentement défavorable (INTERMACS II et III) ou l’installation d’une assistance dépendra alors du projet thérapeutique.
La mise en place d’une assistance circulatoire peut alors être un « pont » vers plusieurs options :
– « bridge to recovery » en cas de défaillance cardiaque pouvant être réversible (myocardite, cardiopathie du post-partum, etc.) ;
– « bridge to destination therapy » lorsqu’on envisage une assistance longue durée (Heart Mate III® en cas de dysfonction ventriculaire gauche isolée) ;
– « bridge to transplant » lorsqu’on attend un greffon ;
– « bridge to decision » en cas d’évolution fulminante ;
– « bridge to bridge » vers une autre modalité d’assistance par exemple de l’Impella® vers une ECMO veino artérielle.
Angioplastie à très haut risque
La définition d’une procédure d’angioplastie à très haut risque n’est pas consensuelle(8). Les trois catégories généralement retenues de facteurs prédictifs d’instabilité hémodynamique sont les suivantes : le risque anatomique (territoire coronaire important), le risque procédural (lésions complexes, lésions diffuses, occlusions coronaires, utilisation de l’athérectomie rotationnelle) et enfin le risque lié au patient (dysfonction cardiaque, instabilité hémodynamique).
L’étude randomisée PROTECT II comprenant 452 patients a voulu comparer le ballon de contrepulsion à l’Impella 2.5® chez les patients présentant une angioplastie à très haut risque avec dysfonction ventriculaire gauche sévère. Le nombre de patient requis n’a pas été atteint, car l’étude a été arrêtée précocement pour cause de futilité. L’analyse en intention de traiter n’a pas montré de différence significative à 30 jours avec 69 % des inclusions prévues, mais une tendance significative a été observée à 90 jours chez les patients revascularisés sous Impella®.
L’ensemble de ces résultats encourageants ont amené le groupe GACI de la Société française de cardiologie à proposer un algorithme pour guider l’utilisation d’une assistance circulatoire en cas d’angioplastie à haut risque (figure 2)(11).
Figure 2. Algorithme proposé concernant le support hémodynamique des procédures d’angioplastie à très haut risque.
Utilisation conjointe avec l’ECMO
L’ECMO veino-artérielle est implantée par voie percutanée ou chirurgicale. Le sang est aspiré via une canule veineuse (23-29 Fr) de l’oreillette droite et est réinjecté via une canule artérielle (15-19 Fr) dans l’artère fémorale (parfois axillaire) après oxygénation et décarboxylation par la combinaison d’une pompe centrifuge et d’un oxygénateur. L’ECMO permet d’instaurer un débit rétrograde de 5 l/min.
Cette méthode d’assistance permet une diminution de la précharge, mais augmente également la postcharge et ainsi le travail cardiaque et la consommation en oxygène.
Ce débit rétrograde et l’augmentation de la post-charge qui en découle se complique parfois d’œdème aigu pulmonaire ou de la formation de thrombus intracardiaque. C’est ainsi qu’il est parfois proposé l’utilisation conjointe de l’Impella® et de l’ECMO pour prévenir ce type de complication.
Plusieurs petites études montrent des résultats prometteurs avec une meilleure récupération cardiaque lors de l’utilisation conjointe de ces deux méthodes(12–14). L’étude randomisée REVERSE (NCT03431467) nous apportera probablement des précisions supplémentaires.
Complications et limites
L’utilisation de ce dispositif n’est pas sans risque et le nombre de complications est important. Voici les complications les plus courantes et leur proportion rapportées dans le registre USpella(6) :
– réparation vasculaire chirurgicale : 9,7 % ;
– transfusion sanguine : 17,5 % ;
– ischémie aiguë de membre : 3,9 % ;
– hémolyse : 10,3 % (pouvant être prévenue par un positionnement optimal du dispositif).
Il existe également certaines contre-indications à l’utilisation de ce matériel :
– atteinte athéromateuse sévère des membres inférieurs ne permettant pas un abord percutané ;
– pathologie valvulaire aortique sévère ;
– cardiomyopathie hypertrophique obstructive ;
– thrombus intraventriculaire ;
– présence d’une valve mécanique aortique ou mitrale ;
– communication interventriculaire incluant celles postinfarctus ;
– tamponnade ;
– rupture en paroi libre.
En pratique
▸ L’Impella® est une méthode d’assistance circulatoire pouvant être mise en place par voie percutanée et pouvant débiter jusqu’à 4 l/min en assurant une décharge ventriculaire.
▸ Malgré des indications potentielles multiples, un des enjeux majeurs de l’utilisation de ce matériel est la bonne sélection des patients pouvant en bénéficier au sein de réseaux de soins constitués d’équipes dédiées avec des protocoles préétablis.
▸ Le PHRC national ULYSS va débuter pour tenter de répondre à la question de la place de l'Impella® dans le choc cardiogénique post-infarctus du myocarde.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :