Rythmologie et rythmo interventionnelle
Publié le 15 nov 2019Lecture 8 min
Tachycardie atriale focale péri-sinusale responsable d’une tachy-cardiomyopathie chez un jeune adulte - Quel est l’oeuf, quelle est la poule ?
Séverine PHILIBERT, service de cardiologie, Groupe hospitalier Saint-Joseph, Paris
La cardiomyopathie induite par une tachycardie (CIT) est une atteinte myocardique avec hypokinésie globale due à la tachyarythmie elle-même. Ces anomalies de la contraction sont réversibles, la première description de ce phénomène a été publiée en 1986 par Packer et coll.(1). La normalisation des symptômes est obtenue après correction du trouble du rythme(2). Il existe peu de données concernant les CIT dues à une tachycardie atriale (TA) focale.
Cas clinique
Un homme de 19 ans a été admis dans notre centre avec une dyspnée croissante et une tachycardie depuis plusieurs mois. Il s’est plaint de tachycardie aux alentours de 120 battements par minute (bpm) au repos sans modification hémodynamique ni dyspnée. L’examen clinique était normal, sans souffle cardiaque ni symptômes d’insuffisance cardiaque. Aucun antécédent de maladie cardiaque familiale ni de mort subite n’a été noté.
L’électrocardiogramme (ECG) a montré une tachycardie atriale à 120 bpm avec un QRS fin (96 ms), un axe normal, un intervalle QT normal et des ondes P’ négatives dans les dérivations inférieures et antérieures (figure 1A).
Figure 1. Électrocardiogramme (ECG) aux urgences. A. Tachycardie à complexes fins à 120 battements par minute avec onde P' négative dans les dérivations antérieures et inférieures
Sur l’échocardiogramme transthoracique (ETT), la fraction d’éjection ventriculaire gauche (FEVG) a été estimée à 30 % sans dilatation du ventricule gauche (diamètre télédiastolique) (DTDVG à 48 mm). La biologie, y compris la fonction thyroïdienne, le NTproBNP, l’ionogramme, la troponine et les D-dimères étaient normaux. L’imagerie par résonance magnétique cardiaque (IRMc) a confirmé un dysfonctionnement biventriculaire grave sans dilatation, respectivement pour la FEVG et le volume telediastolique (VTD) : 28 % et 84 ml/m-2 pour le ventricule gauche et 32 % et 66 ml.m-2 pour le ventricule droit, sans rehaussement myocardique tardif.
La perfusion intraveineuse directe (IVD) de 12 mg d’adénosine a confirmé le diagnostic de TA entraînant un arrêt de la tachycardie sur un seul battement sinusal avant le retour immédiat de la TA (figure 1B). De faibles doses de bêtabloquants cardiosélectifs (métoprolol 25 mg deux fois par jour) n’ont eu aucune efficacité pour ralentir la tachycardie.
Figure 1. Électrocardiogramme (ECG) aux urgences. B. Test à l’adénosine pendant la tachycardie : retour en rythme sinusal sur un battement montrant une morphologie différente de l’onde P (positives dans les dérivations inférieures).
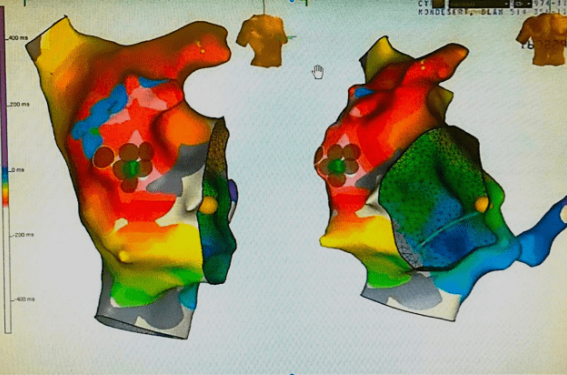
Après une information complète et éclairée, le patient a accepté de subir une exploration électrophysiologique. Le cycle de tachycardie était de 450 ms avec des ondes P’ négatives dans les dérivations antérieures et inférieures précédemment décrites (figure 2). Une cartographie d’activation avec le système de navigation 3D NAV’X (St. Jude Medical, St. Paul, Minneapolis, É.-U.) en tachycardie a montré une activation focale dont l’origine se trouvait en haut et en avant de la crista terminalis, avec une précocité de 26 ms par rapport l’onde P’ de surface (figure 3).
Figure 2. Étude électrophysiologique, enregistrement à 100 mm/s :
– enregistrements électrocardiographiques avec électrode I, II, avF et V1
– électrogrammes de l’oreillette droite enregistrés avec un cathéter décapolaire placé sur le mur latéral de l’oreillette droite (OD) (Inquiry 7F, St. Jude Medical, St. Paul, Minnesota, É.-U.) (RA 1-2 à RA 9-10)
– électrogrammes du His proximal et distal enregistrés avec un cathéter bipolaire (Josephson 5F, St. Jude Medical, St. Paul, Minnesota, É.-U.)
– électrogrammes du sinus coronaire (CS) enregistrés avec un cathéter décapolaire (Inquiry 7F, St. Jude Medical, St. Paul, Minnesota, É.-U.) placé dans le SC (CS 1-2 à CS 9-10)
– électrogrammes du ventricule droit (VD) enregistrés avec un cathéter bipolaire (Josephson 5F, St. Jude Medical, St. Paul, Minnesota, É.-U.) placé à l’apex du VD (RVA).
L’ECG de surface et les électrogrammes intracardiaques montrent une tachycardie à QRS fins, stable, avec un cycle de 450 ms (CL) et une onde P’ négative en inférieur et en V1.
Nous avons noté une activation légèrement excentrique sur la sonde décapolaire placée dans l’OD (RA), plaidant pour une activation proche du noeud sinusal (SN), et précédant l’activation atriale sur les cathéters du His et SC.
Le site d’activation le plus précoce se trouve sur le cathéter de cartographie à - 26 ms de l’onde P de surface.
La tachycardie s’est arrêtée après l’administration de 12 mg d’adénosine IV, et l’oreillette la plus précoce devient RA 9-10.
Figure 3. A. Vue de face (à gauche de l’image) et en oblique antérieur gauche (OAG 45°) (à droite de l’image) de la cartographie d’activation 3D de la TA (Nav'X Velocity, St. Jude Medical, St. Paul, Minnesota, É.-U.). Le signal atrial sur le cathéter proximal du sinus coronaire (CS 1-2) a été choisi comme référence temporelle. La carte d’activation montre une activation la plus précoce (en rouge) dans la paroi latérale de l’oreillette droite. Les sites d’ablation efficace sont tagués en bleu (succès transitoire) et en marron (succès permanent). B. Schéma montrant une projection de l’origine de la TA dans notre observation (points rouges), les points noirs représentent les autres endroits habituellement identifiés chez l’adulte et l’enfant dans l’oreillette droite.
SVC = veine cave supérieure, IVC = veine cave inférieure, RA = oreillette droite, LA = oreillette gauche,
RAA = auricule droit, CT = crista terminalis, LAA = auricule gauche, AT = anneau tricuspide,
SC = sinus coronaire, SN = nœud sinusal, AVN = noeud atrioventriculaire
En raison de la proximité du noeud sinusal, il a été décidé d’utiliser une sonde de cryothérapie (Cryocatheter Freezor 6mm courbe bleue, Medtronic, Minneapolis, États-Unis). Lors de l’administration d’adénosine à 12 mg, la séquence d’activation en rythme sinusal est différente. En TA, la sonde d’ablation distale (MAP 1-2) enregistrait un potentiel qui précédait l’onde P’ de surface de 26 ms. En rythme sinusal, le potentiel sur la sonde MAP 1-2 est en retard sur l’onde P de surface de 12 ms figure 2). Pour éviter les lésions phréniques pendant l’ablation, nous avons effectué une stimulation (20V-2ms) via le cryocathéter juste avant l’application. Après 23 secondes de cryoablation, un ralentissement puis un arrêt de la tachycardie ont été observés. Au total 2 applications cryothérapie de 240 s ont été effectuées pour renforcer l’effet. Plusieurs récidives de TA non soutenues ont pu être provoquées lors de la stimulation par bursts atriaux sous isoprotérénol à 2 mg/h. La nouvelle carte d’activation de cette TA a permis d’identifier une précocité située en haut de l’oreillette droite près du noeud sinusal. D’autres applications de cryothérapie ont été réalisées avec succès à ce niveau. Aucune récidive de TA n’a été observée dans les suites malgré l’administration de burst atriaux sous perfusion d’isoprotérénol (2 mg/h).
72 heures après l’ablation, l’ETT a mis en évidence une normalisation partielle de la FEVG (45 %) associée à une légère hypokinésie diffuse. Pendant l’hospitalisation, le traitement de l’insuffisance cardiaque a été introduit avec bisoprolol 2,5 mg/j et ramipril 2,5 mg/j.
Une ETT et une IRM trois mois après l’ablation ont montré une normalisation des FEVG et FEVD avec respectivement : 52 % 47 %, sans modification des volumes ventriculaires.
Discussion
À notre connaissance, nous rapportons ici le premier cas décrivant une cardiomyopathie bi-ventriculaire induite par une TA focale péri-sinusale, non contrôlée médicalement chez un jeune adulte. L’ablation a réussi à normaliser la fonction myocardique des deux ventricules dans les 3 mois. Le mécanisme automatique est suggéré par une légère variation de la longueur du cycle, la sensibilité à l’adénosine et le caractère focal identifié par la carte d’activation. Les TA les plus sensibles à l’adénosine sont généralement périnodales ou autour de l’anneau atrio-ventriculaire chez les adultes. Dans notre cas, deux origines ont été retrouvées ; en avant de la CT et au pied de l’auricule droit.
Les tachycardies supraventriculaires, y compris la fibrillation atriale (FA) paroxystique ou persistante, les tachycardies jonctionnelles réciproques permanentes (PJRT)(2) ou même les tachycardies par réentréeintra-nodale et les tachycardies jonctionnelles sur syndrome de Wolff Parkinson et White (WPW) peuvent être associées à une dysfonction myocardique réversible(3,4). Cependant, il y a peu de cas décrits de CIT à l’occasion de TA focale. Weizhu Ju et coll. ont tout de même constaté que 8,3 % des patients atteints de TA focale pouvaient présenter une CIT(5). Le jeune âge (22 ans ou moins) et la nature persistante des arythmies étaient des facteurs de risque indépendants du développement d’une CIT.
Le diagnostic de TA focale peut s’avérer difficile, surtout si la fréquence est peu élevée, et si l’origine du foyer est proche du nœud sinusal. Dans notre cas, la tachycardie a été considérée par erreur comme une tachycardie sinusale réactionnelle et « appropriée » à la dysfonction ventriculaire gauche. En cas de TA paradoxale incessante et relativement lente, la prévalence des CIT serait plus élevée en raison de l’absence de symptômes. En effet, une TA plus rapide est en général diagnostiquée plus tôt, sans confusion avec une tachycardie sinusale. Les patients sont ainsi traités plus rapidement avant qu’une CIT n’ait le temps d’apparaître. Dans l’étude australienne de Medi et coll., 345 patients atteints de TA focale incessante ont été étudiés, le développement d’une dysfonction ventriculaire gauche qui pourrait s’expliquer par la nature incessante du foyer plutôt que par son origine anatomique. Dans cette étude, la durée des symptômes, l’âge à la présentation et le sexe ne sont pas prédictifs(6).
L’analyse morphologique précise de l’onde P de surface peut aider à exclure une tachycardie sinusale physiologique. Kistler et coll. ont rapporté un algorithme d’analyse détaillée de la morphologie de l’onde P (PWM) qui permet de prédire le site anatomique d’émergence de la TA avec une prédiction de 93 %.
Nous rapportons sur la figure 2B, les différentes localisations de foyers de TA automatiques qui ont été décrits dans la littérature, ainsi que ceux qui ont été identifiés dans notre cas clinique. De nombreuses zones de l’oreillette droite peuvent être impliquées chez l’adulte : le long de crista terminalis, de l’anneau tricuspide, de l’ostium du sinus coronaire ou de la région périsinusale et péri-nodale, alors que chez les enfants, l’origine la plus fréquemment retrouvée est l’auricule droit (figure 2B)(7).
Le mécanisme exact des CIT reste flou. Deshmukh et coll. ont comparé des patients souffrant d’arythmie atriale, avec et sans cardiomyopathie(8). Dans le groupe avec CIT, ils ont noté une prévalence plus élevée (50 % vs 15 %) de délétion du génotype de l’enzyme de conversion de l’angiotensine (ECA), comparé au groupe sans CIT. Le polymorphisme génétique de l’ECA est connu pour être associé à la présence de cardiomyopathies idiopathiques et ischémiques(9). L’angiotensine II favorise la fibrose atriale et stimule les facteurs de croissance, les cellules cardiaques et les fibroblastes, induit une augmentation du stress de la paroi. Moduler l’action de l’ECA en association à un contrôle proactif du rythme ou de la fréquence chez les patients atteints de polymorphisme du gène codant pour l’ECA pourrait peut-être prévenir l’aggravation de l’atteinte myocardique.
En pratique
Nous rapportons ici un cas de cardiomyopathie induite par une TA chez un jeune homme chez qui la TA focale péri-sinusale a été confondue avec une tachycardie sinusale réactionnelle à l’insuffisance cardiaque.
Même si le mécanisme des CIT reste flou, le diagnostic et le traitement précoce de cette tachycardie sont importants, car une amélioration et une normalisation de la fonction ventriculaire peuvent être obtenues après le rétablissement du rythme sinusal.
Références sur demande à : biblio@axis-sante.com
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :