Cardiologie générale
Publié le 01 mar 2019Lecture 13 min
Hilario NUNES(1,2) et coll.*, Service de pneumologie, Centre de référence des maladies pulmonaires rares (site constitutif) et Centre de compétences des maladies systémiques et auto-immunes rares, Hôpital Avicenne, AP-HP, Bobigny
L’atteinte cardiaque est une manifestation rare mais potentiellement grave de la sarcoïdose, dont la prise en charge diagnostique et thérapeutique est un défi pour le pneumologue et le cardiologue qui doivent travailler en étroite collaboration. Ce sujet a donné lieu à de nombreuses études et d’importants progrès ces dernières années, concernant notamment la place des nouvelles investigations par imagerie par résonance magnétique (IRM) cardiaque et tomographie par émission de positons (TEP) cardiaque et les indications de dispositifs cardiaques implantables. Cette revue générale est une mise au point pratique sur la sarcoïdose cardiaque. Nous n’aborderons pas l’hypertension pulmonaire, qui est une complication à part de la sarcoïdose.
Épidémiologie
La sarcoïdose est une granulomatose systémique de cause inconnue caractérisée par la formation de granulomes dans les organes atteints. Il s’agit d’une maladie rare dont l’incidence, estimée à 15-25/100 000/an varie selon l’âge, le sexe, et l’origine ethnique/géographique des patients. Un pic d’incidence est observé entre 25 et 45 ans (2e autour de 60 ans chez les femmes d’Europe du Nord et du Japon), avec une légère prédominance féminine et des formes plus fréquentes, disséminées et sévères, chez les patients de peau noire. Le phénotype et le pronostic de la sarcoïdose sont très variables. L’atteinte médiastino-pulmonaire concerne 90 à 95 % des patients. Aux États-Unis, alors que jusqu’à 30 % des patients ayant une sarcoïdose ont une atteinte cardiaque histologique dans les séries autopsiques, 5-10 % ont classiquement une atteinte clinique patente.
L’atteinte cardiaque est responsable de 13-25 % de l’ensemble des décès liés à la sarcoïdose. Au Japon, la prévalence est bien plus élevée, atteignant jusqu’à 58 % des patients ayant une sarcoïdose.
Cette manifestation affecte surtout les femmes âgées de plus de 50 ans et elle est responsable de 80 % des causes de mortalité.
Histologie
D’un point de vue histologique, le processus inflammatoire granulomateux et la fibrose résultante ont une distribution hétérogène au sein du cœur. La topographie des lésions et leur étendue va rendre compte des diverses présentations cliniques et électriques. Le myocarde est plus volontiers touché, avec une prédilection pour la base du septum interventriculaire où circule le système conductif particulièrement vulnérable, et la paroi libre du ventricule gauche (VG) avec le risque de formation de foyers ectopiques ou de phénomènes de réentrées à l’origine d’arythmies ventriculaires et, en cas d’infiltration massive, de développement d’une cardiomyopathie, puis les muscles papillaires et plus rarement la paroi du ventricule droit (VD) et les oreillettes. L’atteinte du péricarde est beaucoup plus rare et quasiment toujours associée à une atteinte du myocarde.
Manifestations révélatrices
Schématiquement, trois situations vont révéler une sarcoïdose cardiaque :
– la première, la plus fréquente pour le pneumologue, est la découverte d’anomalies ECG et/ou l’apparition de symptômes cardiaques chez un patient suivi pour une sarcoïdose. Le délai est variable, même si l’atteinte cardiaque est plus fréquemment associée à une forme chronique multi-viscérale de la maladie, en particulier à la présence d’une atteinte encéphalique ;
– la deuxième, à laquelle le cardiologue est le plus souvent confronté et plus difficile, est la cardiomyopathie inaugurale (jusqu’à 30 % des cas). L’insuffisance cardiaque se développe alors généralement de façon subaiguë en quelques semaines à quelques mois et elle s’accompagne souvent d’arythmies ventriculaires ;
– la troisième, la plus redoutable, est l’arrêt cardiaque inaugural par bloc auriculo-ventriculaire (BAV) complet, tachycardie ventriculaire (TV) ou fibrillation ventriculaire, qui pourrait représenter 17 % des cas.
La sarcoïdose cardiaque est une complication rare mais potentiellement grave de la sarcoïdose, la menace principale étant la mort subite par BAV complet ou arythmies ventriculaires. Les troubles du rythme peuvent se développer sur un processus granulomateux ou fibreux.
Investigations diagnostiques
ECG de repos/holter ECG
Les anomalies électriques sont principalement des troubles de conduction auriculo-ventriculaires ou intraventriculaires et les troubles du rythme ventriculaires. Le bloc de branche droit a peu de valeur, sauf s’il est avec certitude acquis. Les troubles du rythme supra-ventriculaires sont classiquement plus rares, mais il est possible qu’ils soient en fait sous-estimés (tableau 1).
Le Selvester scoring system a été évalué dans la sarcoïdose cardiaque, avec des résultats intéressants, mais la méthode est difficilement applicable en routine.
BAV : bloc auriculo-ventriculaire ; BB : bloc de branche ; FC : fréquence cardiaque ; VG : ventricule gauche
Échographie cardiaque transthoracique (ETT)
L’ETT est souvent normale à un stade précoce. Les anomalies les plus évocatrices sont les troubles de la motilité ventriculaire régionale et l’épaississement ou l’amincissement segmentaire, notamment de la portion basale du septum interventriculaire, et une cardiopathie dilatée avec dysfonction systolique. La cardiopathie hypertrophique avec dysfonction diastolique est probablement sous-estimée. Un aspect hyper-scintillant du septum a été décrit, mais cela reste anecdotique. Les anévrismes ventriculaires, exceptionnels, peuvent donner des troubles du rythme réfractaires. L’épanchement péricardique est généralement modéré.
Malgré plusieurs publications intéressantes, l’apport d’une étude du strain n’est pas validé dans la sarcoïdose cardiaque.
IRM cardiaque
L’IRM cardiaque est l’examen de choix en cas de suspicion de sarcoïdose cardiaque, mais il faut savoir interpréter les anomalies qui dépendent du stade évolutif de la maladie. À un stade d’inflammation granulomateuse, on peut noter un épaississement myocardique avec trouble de contraction focale, un hypersignal T2 dû à l’oedème et un rehaussement tardif au gadolinium. À un stade de fibrose, on peut noter un amincissement myocardique avec trouble de contraction focale et là aussi un rehaussement tardif au gadolinium.
Le rehaussement tardif est donc le signe clef, mais il ne distingue pas une atteinte cardiaque active ou cicatricielle. Il peut prendre différents aspects (sous-épicardique, médiocardique, sous-endocardique ou transmural), mais le plus caricatural est un rehaussement linéaire arciforme sous-épicardique prédominant dans la paroi libre du VG et la base ou le versant VD du septum (figures 1 et 2). Il ne délimite jamais un territoire coronarien, ce qui est important si la localisation est sous-endocardique, qui suggère beaucoup plus une coronaropathie.
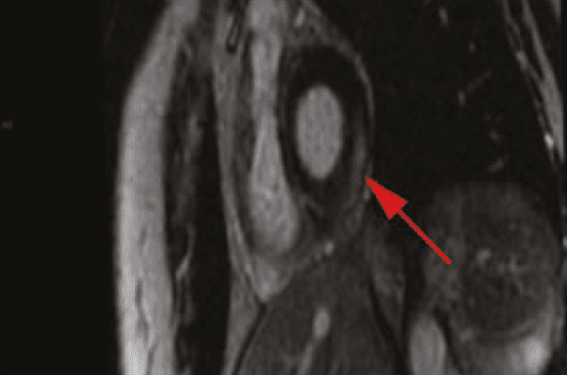
Figure 1. IRM cardiaque d’un patient de 45 ans ayant présenté des troubles du rythme ventriculaire (tachycardie ventriculaire non soutenue). Cette coupe en petit axe montre un rehaussement tardif en T1 antérolatéral (flèche rouge).
Figure 2. IRM cardiaque d’une patiente de 57 ans aux antécédents de troubles de la repolarisation associés à une insuffisance cardiaque gauche. Cette coupe montre une prise de contraste arciforme sous-épicardique inféro-latérobasale séquellaire (flèche rouge).
Une technique de mapping T2 pourrait améliorer les performances de l’IRM, mais elle n’est pas disponible dans tous les appareils. L’IRM a également une valeur pronostique, avec une association au risque d’événement cardiovasculaire sérieux en cours de suivi.
L’IRM cardiaque est un examen diagnostique très sensible. Le rehaussement tardif au gadolinium est le signe clef, mais il ne permet pas de distinguer une atteinte cardiaque active ou cicatricielle.
TEP au 18-fluorodesoxyglucose (18FDG) cardiaque
Plusieurs protocoles ont été proposés pour supprimer la captation cardiaque physiologique, le plus utilisé en France étant un régime riche en graisses et pauvre en hydrates de carbone (régime sans glucides la veille de l’examen pour les repas du midi et du soir, suivi d’un jeûne d’environ 12 heures jusqu’à la réalisation de l’examen). Plusieurs aspects d’hyperfixation ont été décrits. L’hyperfixation focale ou focale sur un fond diffus témoigne, après avoir exclu une coronaropathie, d’une atteinte cardiaque active (figure 3). L’hyperfixation diffuse ou diffuse avec un renforcement basal est en rapport avec une suppression du métabolisme physiologique non optimale (figure 4).
Figure 3. TEP scanner en faveur d’une atteinte active montrant une anomalie de fixation antérolatérale (flèches verte et rouge) concordante avec les anomalies de l’IRM de la figure 1.
Figure 4. TEP scanner ne montrant pas de fixation cardiaque pathologique (flèches verte et rouge), en faveur d’une atteinte séquellaire des anomalies visualisées sur l’IRM de la figure 2.
En plus de l’étude du métabolisme au 18FDG, une étude concomitante de la perfusion au 82Rubidium pourrait améliorer les performances du TEP cardiaque, mais elle n’est pas faite en routine. Le TEP cardiaque a également une valeur pronostique, avec une association au risque d’événement cardiovasculaire sérieux en cours de suivi.
Le 18FDG TEP cardiaque dédié permet de distinguer une atteinte active ou cicatricielle et de guider au mieux les décisions thérapeutiques concernant le traitement de la sarcoïdose.
Autres investigations cardiaques
La scintigraphie myocardique, notamment au 99mTechnetium sestamibi, peut montrer des défects de perfusion patchy au repos disparaissant après dipyridamole, contrairement à la coronaropathie, mais son utilisation pour le diagnostic de sarcoïdose cardiaque a été presque abandonnée.
Une épreuve d’effort ou une étude électrophysiologique endocavitaire peuvent être très utiles en cas de sarcoïdose cardiaque, notamment pour comprendre les mécanismes d’un malaise. Enfin, les explorations coronariennes sont cruciales pour éliminer un diagnostic différentiel.
Diagnostic positif : approche multimodale
Le diagnostic de sarcoïdose cardiaque est compliqué. En effet, il n’y a pas de gold standard, la biopsie endomyocardique étant peu rentable dans ce contexte du fait de la nature hétérogène du processus lésionnel. Plusieurs critères diagnostiques ont été proposés, notamment par le ministère de la Santé japonais, mais les mieux adaptés sont probablement ceux des recommandations d’experts américaines récentes (tableau 2).
FEVG : fraction d’éjection ventriculaire gauche ; 18FDG TEP : tomographie par émission de positons au 18-fluorodesoxyglucose ; IRM : imagerie par résonance magnétique
*La biopsie endomyocardique est exceptionnellement effectuée du fait de sa faible rentabilité.
**Une atteinte probable est suffisante pour retenir le diagnostic clinique de sarcoïdose cardiaque.
***La scintigraphie au gallium est un examen qui a été très largement abandonné en France.
Lorsque l’atteinte cardiaque est inaugurale, le problème pour le cardiologue est de penser à la sarcoïdose et de faire appel à un pneumologue pour confirmer le diagnostic.
Il devra l’évoquer en particulier devant un trouble de conduction inexpliqué (bloc de second degré de type Mobitz II ou de troisième degré) chez un patient jeune (< 60 ans). Le diagnostic différentiel avec la dysplasie arythmogène du VD peut être difficile. La sarcoïdose cardiaque est rarement strictement isolée, il existe une atteinte extracardiaque dans environ 75 % des cas, notamment médiastinopulmonaire. Une radiographie et un scanner thoracique sont indispensables et, si ceux-ci sont normaux, la réalisation d’un TEP scanner peut aider à identifier des localisations infracliniques biopsiables.
En cas de sarcoïdose préalablement connue, le dépistage d’une atteinte cardiaque doit être systématique par un interrogatoire, un examen physique et un ECG régulier, tous les 6 à 12 mois. Les palpitations, les syncopes ou malaises pré-syncopaux et les signes d’insuffisance cardiaque sont les plus suggestifs. La réalisation systématique d’une ETT reste discutée. Il n’est pas justifié d’aller plus loin si ce premier bilan est normal, dans la mesure où la signification clinique et les implications thérapeutiques d’anomalies IRM découvertes chez des patients asymptomatiques avec un ECG normal est débattue. Certains auteurs préconisent néanmoins de poursuivre les investigations en cas de forme chronique multi-viscérale et encéphalique de la sarcoïdose.
La sensibilité et la spécificité des symptômes cardiaques, de l’ECG, de l’ETT et du holter ECG seuls ou en combinaison pour le diagnostic de sarcoïdose cardiaque ont été diversement estimées dans la littérature en fonction du mode de recrutement pneumologique ou cardiologique des patients et des critères diagnostiques utilisés.
Néanmoins, même s’ils peuvent être normaux en présence d’une authentique atteinte cardiaque, l’ETT et l’holter ECG gardent une place centrale, car le risque de survenue d’un événement cardiovasculaire sérieux évolutif est alors faible.
Les principaux avantages et inconvénients de l’IRM et du TEP cardiaque sont résumés dans le tableau 3. L’IRM a une très forte sensibilité, allant jusqu’à 100 % et une spécificité variable entre 58 et 83 %. Une atteinte cardiaque peut donc être écartée si elle est normale. La sensibilité du TEP cardiaque est de 89 % et sa spécificité de 78 %. Son intérêt principal est de déterminer le caractère actif ou cicatriciel du rehaussement tardif à l’IRM et ainsi d’orienter les décisions thérapeutiques, d’évaluer au mieux la réponse thérapeutique et de détecter les rechutes (figures 1 à 3, et 5). Ces deux examens évaluent donc des composantes différentes de l’atteinte cardiaque de la sarcoïdose, et certaines machines couplant IRM et TEP scanner pourraient faciliter cette approche multimodale dans l’avenir.
IRM : imagerie par résonance magnétique ; 18FDG TEP : tomographie par émission de positons au 18-fluorodesoxyglucose ; FEVG : fraction d’éjection ventriculaire gauche
Figure 5. TEP scanner sans extinction complète de la fixation myocardique en rapport avec un échec du régime (flèches rouges).
Le diagnostic de sarcoïdose cardiaque est difficile et devrait être posé lors d’une discussion multidisciplinaire rassemblant pneumologue, cardiologue, radiologue et spécialiste en médecine nucléaire. Il nécessite d’exclure les autres causes cardiaques, notamment une coronaropathie.
Facteurs pronostiques : stratification du risque
Une fois le diagnostic de sarcoïdose cardiaque posé, une étape essentielle est de stratifier le risque d’événement cardiovasculaire sérieux, notamment de troubles du rythme ventriculaires. Les facteurs pronostiques sont indiqués dans le tableau 4. Les plus puissants facteurs prédictifs de mortalité sont la classe fonctionnelle NYHA, l’existence d’une TV soutenue, le diamètre télédiastolique du VG, une FEVG < 35 % et la présence de signes d’insuffisance cardiaque. Bien que la place de la recherche d’une TV induite par stimulation électrique programmée soit mal évaluée, sa réalisation est préconisée par certains auteurs chez tous les patients ayant une FEVG < 35 % malgré le traitement.
L’évaluation clinique, l’ETT et le holter ECG ont un rôle central pour stratifier le risque de survenue d’un événement cardiovasculaire sérieux ou d’un décès.
Traitement
Une coopération entre le pneumologue et le cardiologue est décisive pour initier le traitement et assurer le suivi.
Traitement spécifique de la sarcoïdose
Le traitement ne doit pas être retardé. La corticothérapie générale est le traitement de référence, initialement à la posologie de 1 mg/kg/j. Des bolus de méthylprednisolone peuvent se justifier dans les formes sévères. La durée du traitement devra être d’au moins 24 mois, une petite dose entre 5 et 10 mg étant parfois nécessaire à vie.
Plus de la moitié des patients nécessiteront l’association à un agent immunosuppresseur et son introduction précoce pourrait être bénéfique. Son choix suit les modalités classiques au cours de la sarcoïdose : le méthotrexate ou l’azathioprine sont privilégiés en première intention ; le cyclophosphamide a un effet plus rapide, mais ses complications sont plus fréquentes et sévères ; l’infliximab a été utilisé avec succès dans de rares observations de sarcoïdose cardiaque, en sachant que les anti-TNF� sont contre-indiqués en cas de classe fonctionnelle NYHA III/IV.
Traitement symptomatique cardiaque
Le traitement à visée cardiaque est primordial et ses indications sont globalement les mêmes que celles en dehors du contexte de sarcoïdose, avec toutefois quelques spécificités. En effet, la sarcoïdose cardiaque, peut-être du fait du processus inflammatoire actif persistant et de l’atteinte possible des deux ventricules, a un comportement différent des autres cardiomyopathies non ischémiques en termes de risque accru de détérioration de la FEVG, d’arythmies ventriculaires et de mort subite.
Les indications d’implantation d’un défibrillateur implantable sont plus larges et notées dans le tableau 5. Si l’implantation permanente d’un pacemaker pour un BAV est décidée, il est préférable de mettre un place un défibrillateur implantable qui protégera le patient contre les arythmies ventriculaires qui peuvent survenir ultérieurement, même si la sarcoïdose est bien contrôlée. Une ablation peut être utile en cas d’arythmies ventriculaires réfractaires au traitement immunosuppresseur et antiarythmique. Le recours à la transplantation cardiaque est exceptionnel et réservé aux cas de cardiomyopathie dilatée avec insuffisance cardiaque terminale malgré le traitement immunosuppresseur et cardiaque.
La prise en charge thérapeutique de la sarcoïdose cardiaque repose à la fois sur un traitement spécifique de la sarcoïdose à base de corticoïdes qui ne doit pas être retardé et un traitement symptomatique cardiaque.
Évolution et mortalité
Un double suivi rapproché est indispensable, avec une évaluation 3 mois après le début du traitement puis tous les 3 à 6 mois, avec un interrogatoire, un examen physique, un ECG, une ETT, un holter ECG et une IRM cardiaque. S’il y avait des anomalies morphologiques sur le TEP cardiaque, celui-ci peut être renouvelé pour évaluer la réponse thérapeutique et détecter une éventuelle rechute.
Le BAV va s’améliorer avec le traitement spécifique de la sarcoïdose dans environ la moitié des cas. Il faut retenir que la survenue d’arythmies ventriculaires reste possible malgré un traitement de la sarcoïdose efficace, car elles sont souvent secondaires à des phénomènes de réentrées dans des zones de fibrose. De même, il est important de s’assurer lors de la surveillance de l’absence de détérioration de la FEVG. En effet, le traitement spécifique permet de maintenir la FEVG si valeur initiale est normale et de l’améliorer en cas de dysfonction ventriculaire gauche modérée (FEVG > 30-35 %), mais habituellement pas en cas de dysfonction sévère (FEVG 30-35 %).
L’évolution du rehaussement tardif à l’IRM est très variable, selon qu’il est en rapport avec une maladie active ou cicatricielle. Par contre, la corrélation est bonne entre l’hyperfixation au TEP cardiaque et la réponse thérapeutique, notamment la variation de la FEVG.
La mortalité des patients ayant une sarcoïdose cardiaque a franchement diminué ces dernières décennies, probablement grâce à un meilleur diagnostic, plus précoce, et à l’avènement des dispositifs cardiaques implantables. La survie a été estimée récemment à 97 % à 1 an, 90 % à 5 ans et 83 % à 10 ans. Elle est moins bonne en cas de sarcoïdose cardiaque isolée.
En pratique
L’atteinte cardiaque est une complication rare mais potentiellement grave de la sarcoïdose.
Une approche multimodale par IRM et 18FDG TEP cardiaque est déterminante pour le diagnostic, les décisions thérapeutiques et le suivi.
L’évaluation clinique et les examens simples (ECG, holter ECG et ETT) restent importants, en particulier pour stratifier le risque. Idéalement, la prise en charge diagnostique et thérapeutique des patients ayant une sarcoïdose cardiaque devrait être multidisciplinaire dans un centre expert et impliquer un pneumologue spécialiste de la sarcoïdose, un cardiologue expérimenté en rythmologie, un radiologue et un spécialiste en médecine nucléaire.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :