Cardiologie interventionnelle
Publié le 01 sep 2017Lecture 7 min
L’échographie interventionnelle en 2017
Éric BROCHET, département de cardiologie, Hôpital Bichat, Paris
Le congrès PARIS ÉCHO 2017 a illustré dans de nombreuses sessions la place croissante de l’échocardiographie en cardiologie interventionnelle. L’essor considérable des interventions percutanées structurelles observé ces dernières années n’a en effet été possible que grâce aux progrès conjoints de l’imagerie, et notamment du guidage échographique. Citons notamment les procédures valvulaires (TAVI, MitraClip, et autres interventions mitrales percutanées, annuloplastie, implantation de prothèse, occlusion de fuite paraprothétique, etc.), mais aussi l’occlusion de l’auricule gauche, les interventions percutanées en cardiologie pédiatrique, etc. Un facteur majeur de ce progrès a été l’introduction de l’échographie tridimensionnelle transœsophagienne (ETO 3D), apportant une visualisation réellement anatomique des structures anatomiques et des cathéters, un guidage beaucoup plus précis et surtout une facilitation de la communication entre échocardiographiste et cardiologue interventionnel.
Échographie interventionnelle, une nouvelle spécialité
La nécessité d’une collaboration étroite et une bonne communication entre échographiste et cardiologue interventionnel a été rappelée dans plusieurs sessions et est l’une des conditions essentielles du succès de ces procédures(1-3). Ceci nécessite une formation commune des deux intervenants aux principes et besoins en imagerie de chaque procédure, à l’utilisation d’un langage commun et à l’utilisation de protocoles d’imagerie standardisés. Pour une communication optimale, l’échographiste et le cardiologue interventionnel doivent pouvoir suivre simultanément les images de fluoroscopie et d’échographie. L’utilisation des différentes modalités d’imagerie échographique ETO 2D et 3D, ETO biplan ou multiplan, et plus récemment l’imagerie de fusion permettent un guidage très précis à partir d’un nombre limité d’incidences avec une orientation anatomique bien définie.
Imagerie avant la procédure : place de l’imagerie multimodale
La complexité croissante des procédures interventionnelles impose une planification du geste, individualisé pour chaque patient selon les caractéristiques anatomiques et les spécificités des techniques d’implantation. C’est le cas notamment pour les occlusions d’auricule gauche, l’implantation de prothèses valvulaires aortiques ou mitrales, les techniques d’annuloplastie mitrale percutanée, ou encore l’occlusion des fuites paraprothétiques(1).
Le scanner cardiaque et l’ETO 3D sont les techniques les plus utilisées pour l’analyse des structures anatomiques complexes (auricule gauche, valve et anneau mitral) et la localisation précise des lésions (fuites paraprothétiques)(1).
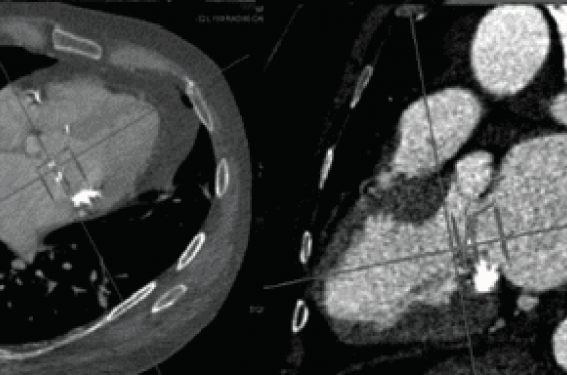
L’analyse permet de prédire le type et la taille des dispositifs à implanter et d’identifier des contre-indications ou possibles difficultés techniques du geste interventionnel. Le scanner cardiaque est particulièrement important pour les implantations percutanées de valve mitrale (valve-in-valve ou valve-in-ring, ou encore dans les anneaux mitraux calcifiés [MAC]) (figure 1). Un risque particulier de ces techniques est l’obstruction intraventriculaire gauche, pouvant être prédit par des mesures anatomiques spécifiques au scanner (angle aortomitral, taille de la chambre de chasse) et par des techniques de simulation d’implantation sur les images de reconstruction. L’impression 3D à partir des images obtenues en scanner est une autre technique en plein essor, permettant de simuler et préparer la procédure percutanée.
Figure 1. Procédure d’implantation de prothèse valvulaire mitrale dans un anneau mitral calcifié (MAC). À gauche, le scanner injecté permet une analyse anatomique précise avant la procédure (dimensions de l’anneau, importance et caractère circonférentiel des calcifications, angle aorto-mitral et dimensions ventriculaires gauches, simulation d’implantation de la prothèse. À droite, rôle de l’ETO 3D et biplan pour le positionnement de la prothèse.
Remerciements au Dr Marina Urena et Dr Dominique Himbert, CHU Bichat
Échocardiographie pendant la procédure
Des progrès importants en ETO 3D ont été observés chez tous les constructeurs (Philips, General Electric, Siemens) en termes de qualité et de cadence image (ETO 3D Doppler couleur) ainsi que des progrès dans les logiciels de modélisation, notamment valvulaires, disponibles en « live » pendant l’intervention.
Une session entière a été consacrée à la fusion d’images, permettant de coupler une technique d’imagerie des tissus (ETO ou scanner) à l’image fluoroscopique.
Le système EchoNavigator, développé par Philips, permet ainsi la synchronisation et la superposition de l’image 3D et de l’image par rayons X, apportant un gain important pour le guidage des procédures complexes. Des marqueurs peuvent être positionnés sur les structures anatomiques de l’image échographique, visualisés simultanément sur l’écran de scopie(2). Ceci permet d’augmenter la précision de certains gestes techniques comme la ponction transseptale, le traitement percutané des CIA complexes, le franchissement de fuite paraprothétique, l’occlusion de l’auricule gauche ou la mise en place de clip mitral (figure 2). Les évolutions récentes de cette technique permettent de superposer une représentation des cavités cardiaques (Heart Model) à l’image fluoroscopique, augmentant encore la précision du guidage.
Figure 2. Procédure de fermeture percutanée de communication interauriculaire guidée par EchoNavigator®.
Remerciements au Dr Khaled Hadeed et Philippe Acar, Hôpital des Enfants, Toulouse
Traitement percutané de l’insuffisance mitrale : le triomphe du Mitraclip
La technique Mitraclip est de loin la technique de réparation mitrale percutanée la plus employée (plus de 45 000 patients traités dans le monde). Elle s’adresse aussi bien aux insuffisances mitrales (IM) dégénératives, par prolapsus qu’aux insuffisances mitrales fonctionnelles, chez les patients à haut risque ou contre-indiqués pour la chirurgie.
Les résultats à 5 ans de l’étude randomisée EVEREST, comparant MitraClip et chirurgie montrent une stabilité des résultats avec le maintien des bons résultats en termes de réduction du degré de l’IM et de l’amélioration de l’état fonctionnel.
En France, le remboursement de cette technique a été obtenu en janvier 2017 pour l’IM dégénérative chez les patients contre-indiqués pour la chirurgie. Si l’IM secondaire reste l’indication la plus fréquente de cette technique en Europe, le bénéfice réel de cette technique dans cette population reste encore non démontré et il faudra attendre les résultats des études randomisées (étude multicentrique française MITRA FR, récemment terminée, étude COAPT aux États-Unis, étude européenne RESHAPE 2).
Plusieurs sessions ont rappelé l’importance de l’échocardiographie dans la sélection des patients, et son rôle majeur pour le guidage de la procédure(3) (figure 3).
Si les critères échographiques de sélection classiques proposés dans l’étude EVEREST restent les garants d’un bon résultat, l’expérience joue un rôle important et de formes anatomiques moins favorables (prolapsus larges ou non centraux) peuvent actuellement être traités avec succès dans les centres expérimentés. Les contre-indications restent les valves calcifiées ou sténosantes, les séquelles d’endocardite ou les prolapsus multiples des maladies de Barlow.
D’autres techniques de réparation mitrale percutanée se développent (néocordages [Neochord], annuloplastie [Cardioband]) et certains centres européens commencent à combiner ces différentes procédures entre elles afin d’optimiser le résultat (annuloplastie et MitraClip ou annuloplastie et néocordages).
Figure 3. Guidage échographique (ETO 3D) de la procédure MitraClip. En haut, bilan lésionnel mettant en évidence une fuite mitrale sévère par prolapsus du segment P2. En bas, introduction et positionnement du clip dans l’oreillette gauche, puis capture des feuillets.
Dr Éric Brochet, Hôpital Bichat
La valve tricuspide, nouvel enjeu des techniques percutanées
L’insuffisance tricuspide fonctionnelle sévère est l’un des nouveaux champs d’application des techniques percutanées. La chirurgie est souvent contre-indiquée ou à très haut risque chez ces patients et le pronostic sombre en l’absence de traitement. De multiples interventions percutanées tricuspides sont actuellement en cours de validation. Parmi celles-ci, citons les techniques de « bicuspidisation » de la valve tricuspide par implantation de vis (4 Tech) ou de pledget (Trialign), la technique « bord à bord » (MitraClip), l’annuloplastie percutanée (Cardioband) ou le système FORMA (ballon d’occlusion amarré à l’apex du ventricule droit) (figure 4). Enfin, une implantation percutanée de prothèse tricuspide a été réalisée pour la première fois cette année à la Cleveland Clinic(4).
Plusieurs sessions ont insisté sur l’importance d’une étude échocardiographique systématique des mécanismes, de l’anatomie et de la sévérité de la fuite tricuspide pour la sélection des candidats à ces techniques. Concernant le guidage des procédures, celui-ci est plus complexe que pour la valve mitrale. Le recours à de multiples techniques échographiques (ETO biplan et 3D, mais aussi échographie intracardiaque et même transthoracique) est souvent nécessaire.
Figure 4. Procédures percutanées tricuspides en développement. Techniques d’annuloplastie type Cardioband®. Technique « bord à bord » type MitraClip® appliqué à la valve tricuspide. Techniques de réduction annulaire par l’implantation de vis (4 Tech) ou de pledgets (Mitralign). Ballon d’occlusion (Forma Edwards) ou implantation de prothèses valvulaires.
Remerciements au Dr Pascal Lim, CHU Henri Mondor, Créteil
Une autre difficulté réside dans l’évaluation des résultats des gestes percutanés, en raison des limites actuelles de la quantification de l’insuffisance tricuspide.
Pour affiner cette évaluation, une nouvelle échelle de quantification des fuites tricuspides en 5 grades (modérée, moyenne, sévère, massive et torrentielle !) a été récemment proposée par l’ASE, basée sur la mesure de la PISA et de la vena contracta en 3D. À suivre…
D’après les communications suivantes :
• Session DICE : l’échocardiographie en salle de cathétérisme, M. Swaans (Nieuwegein, Nederland) ; A. Delabays (Lausanne, Suisse) ; B. Cormier, (CH Jacques Cartier, Massy), É. Brochet (CHU Bichat, Paris).
• « La révolution EchoNavigator », K. Hadeed, P. Acar (Hôpital des enfants, Toulouse) et S. Hascoët (Centre chirurgical Marie Lannelongue, Le Plessis-Robinson).
• MitraClip : le contexte français en 2017. S. Lafitte (CHU de Bordeaux), C. Saint-Étienne (CHU de Tours), N. Piriou (CHU de Nantes), N. Dumonteil (Clinique Pasteur, Toulouse). MitraClip : résultats et perspectives, A. Vahanian (CHU Bichat, Paris).
• Insuffisance tricuspide : les techniques de correction percutanées - présent et futur, P. Lim (CHU Henri Mondor, Créteil).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :