Cardiologie interventionnelle
Publié le 14 juin 2014Lecture 6 min
Comment surveiller un patient après TAVI ?
B. D’HÉRÉ, D. STEPOWSKI, F. BAUER, Unité d’insuffisance cardiaque et d’échographie cardiaque, Hôpital Charles-Nicolle, Rouen
L’implantation de valve aortique percutanée représente un traitement de choix des rétrécissements aortiques symptomatiques chez les patients inopérables ou à très haut risque chirurgical (EuroSCORE > 20 ; STS PROM > 10 %), permettant une amélioration significative de la morbi-mortalité, et figure désormais dans les recommandations de l’ESC 2012. Le suivi comporte quelques particularités en raison des complications périopératoires potentielles, de la fragilité de la population cible, de la technicité du suivi échographique et de la gestion des traitements antithrombotiques.
Suivi hospitalier
La durée de séjour en unité de soins intensifs est comprise entre 1 et 5 jours(1). Cette surveillance est nécessaire en raison de la survenue possible de complications postopératoires précoces, telles que l’infarctus (0 et 5,6 %), les troubles conductifs (implantation d’un stimulateur cardiaque entre 3,4 et 16,3 % pour la valve Edwards SAPIEN et entre 15,4 et 26,9 % pour la CoreValve®), de complications cérébrovasculaires (1,7 et 13,5 % d’AVC à 1 mois) et surtout vasculaires (17 à 30,7 % à 1 mois), comme l’ischémie, la dissection ou la rupture iliofémorale. Enfin, environ 10 % des patients présenteront un saignement majeur, la quasi-totalité des saignements ayant lieu dans les premières 24 heures suivant l’intervention avec des taux moindres par rapport à la chirurgie conventionnelle.
Le séjour en unité conventionnelle permet la réautonomisation d’un sujet souvent âgé, aux nombreuses comorbidités et avec un score de fragilité élevé, prédisposé aux complications gériatriques (confusion, syndrome de glissement, rétention aiguë d’urine, etc.). Le suivi clinique consistera à surveiller les voies d’abord (principalement fémorales), à rechercher un hématome, une fistule artério veineuse, un abcès du Scarpa ou une éventuelle ischémie périphérique. On recherchera également un souffle d’insuffisance aortique et la présence de signes d’insuffisance cardiaque. La surveillance biologique de la fonction rénale est impérative, en raison du nombre non négligeable d’insuffisances rénales aiguës (2,3 à 11,6 %), ainsi que celle du taux d’hémoglobine à la recherche d’un saignement occulte. La durée de séjour globale est entre 8 et 14 jours. Une réadaptation cardiaque pourra être proposée au même titre que la chirurgie chez les patients valides.
Suivi échographique
Avant la sortie d’hospitalisation, une échographie transthoracique est réalisée. Elle permettra de confirmer le bon déploiement et le bon fonctionnement de la prothèse par la mesure de son diamètre externe, de la surface effective (équation de continuité) et du gradient moyen. Dans le registre FRANCE 2(2), on observe une diminution du gradient moyen de 48 mmHg à 10 mmHg et une augmentation de la surface valvulaire de 0,67 à 1,7 cm2.
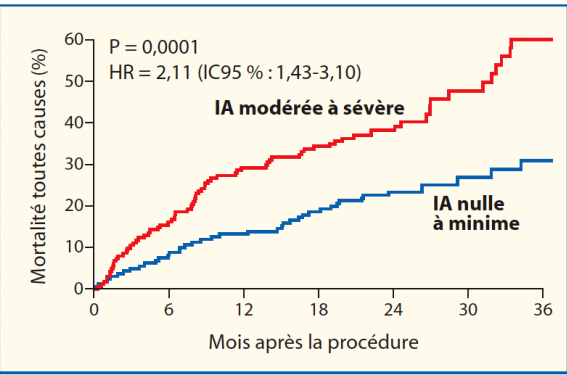
Mais la difficulté de cette échographie résidera surtout dans la recherche et la quantification de l’insuffisance aortique, qui peut être intraprothétique centrale (10 %) ou paraprothétique dans la grande majorité des cas. Dans le registre FRANCE 2, le suivi échographique à 1 mois ne révèle aucune fuite dans 39,3 % des cas, une fuite de grade 1 dans 44,6 % des cas, de grade 2 dans 15,7 % des cas, de grade 3 dans 0,5 % des cas et de grade 4 dans 0 % des cas. Les insuffisances aortiques sévères sont le plus souvent liées à un diamètre de valve inadapté par rapport à celui de l’anneau. Une régurgitation périprothétique initiale de grade 2 ou plus se révèle comme le facteur le plus étroitement associé à la mortalité à 1 an, la quantification étant souvent difficile en raison de la multitude des jets et de son caractère excentré (figure). Ainsi, outre les critères d’évaluation qualitatifs habituels (extension du jet dans le VG), semi-quantitatifs (vena contracta, diamètre du jet à l’origine, vitesse télédiastolique de l’isthme, PHT) et quantitatifs (volume régurgitant, surface de l’orifice régurgitant et fraction de régurgitation évaluable également en 3D), on ajoutera l’extension circonférentielle du jet en parasternal petit axe. En cas de suspicion de fuite sévère et notamment en cas d’hyperdébit inexpliqué, il sera parfois nécessaire de compléter l’examen par une échographie transœphagienne pour préciser le mécanisme de la fuite, voire par une IRM cardiaque pour mesurer la fraction de régurgitation grâce à l’imagerie en contraste de phase. En cas d’insuffisance aortique significative résiduelle, il est licite de se poser la question d’une dilatation de la prothèse en place pour les fuites paraprothétiques ou de la pose d’une valve-in-valve en cas de fuite centrale. On évaluera également les fonctions systoliques et diastoliques du ventricule gauche et on recherchera la présence d’une hypertension pulmonaire ou d’un épanchement péricardique. La présence d’une dysfonction ventriculaire gauche et/ou d’une hypertension pulmonaire persistante a également un impact sur le pronostic de ces patients.
Impact pronostique d’une insuffisance aortique 2 sur la mortalité toutes causes (d’après Kodali SK et al.(6)).
Suivi extrahospitalier
La HAS recommande également un suivi à 1 mois, 6 mois, 1 an puis une fois par an, avec la réalisation d’un bilan biologique et d’une échocardiographie. Les suivis à 1 mois et 1 an doivent être réalisés dans le centre implanteur avec une évaluation cardiaque et gériatrique.
Lors de sa sortie d’hospitalisation, il est habituellement conseillé au patient de revoir son cardiologue dans les 2 mois. Les échographies de contrôle auront pour but de réévaluer les paramètres précités et notamment l’évolution de la fraction d’éjection du ventricule gauche ainsi que l’importance d’une fuite aortique et son retentissement. En effet, on constate environ 20 % d’aggravation des insuffisances aortiques à 2 ans. Dans les différents registres, il n’existe aucun signe de détérioration structurelle de la valve avec des performances hémodynamiques du TAVI qui se maintiennent et sont superposables à la chirurgie.
Gestion des traitements antithrombotiques
Dans la cohorte B de l’étude PARTNER, on constate que le risque d’accidents neurologiques (AIT/AVC) à 2 ans est majoré comparé à la chirurgie (11,2 % vs 6,5 % ; p = 0,05)(3). La bioprothèse est en effet source d’embolie, d’une part, en raison de l’agrégation de plaquettes et de fibrine sur la prothèse dans les heures qui suivent l’implantation et, d’autre part, en raison du contact entre les mailles du stent et la valve native. La stratégie d’anticoagulation actuelle repose de façon empirique sur une bithérapie antiplaquettaire (aspirine + clopidogrel) pour une durée de 6 mois puis sur un seul antiagrégant à vie. Cette attitude est infirmée par Ussia et coll.(4), qui montrent, sur des effectifs certes limités (67 patients), l’absence de supériorité d’une bithérapie antiplaquettaire versus un traitement par aspirine seule sur le risque ischémique et hémorragique. Par ailleurs, environ 30 % des patients implantés ont des antécédents de fibrillation atriale et 10 à 15 % des patients implantés développeront une fibrillation auriculaire qui justifie théoriquement d’un traitement anticoagulant associé. Zeymer et coll.(5) ont démontré, à travers le registre GermanTAVI, qu’une trithérapie (aspirine, clopidogrel et antivitamine K) était associée avec une augmentation du critère composite « décès, AVC, embolie, hémorragie majeure ». La meilleure stratégie chez ces patients semble associer un seul antiagrégant aux AVK ou un traitement d’emblée par AVK seuls, mais cela mérite d’être étudié par des essais randomisés sur de plus larges effectifs.
Prophylaxie endocardite
Bien que les cas avérés d’endocardite sur TAVI restent anecdotiques, l’antibioprophylaxie est recommandée pour les patients porteurs de TAVI pour les gestes à haut risque.
Autres éléments du suivi, les facteurs comorbides
Si la mortalité à 30 jours est principalement d’origine cardiovasculaire, la mortalité à long terme (entre 20 et 30 % à 1 ans et 30 % à 2 ans) est en rapport avec les nombreuses comorbidités du patient qu’il est nécessaire de suivre.
Au travers des différents registres, les principaux facteurs prédictifs de mortalité à long terme sont la présence d’une bronchopneumopathie chronique obstructive, d’une insuffisance rénale chronique, d’une fragilité (syndrome gériatrique qui correspond à l’épuisement des réserves médico-psycho-sociales et une incapacité à répondre à un stress) et d’une fibrillation auriculaire permanente. C’est à ce titre que la prise en charge multidisciplinaire est indispensable pour que le bénéfice de l’implantation de ce type de prothèse soit renforcé par le dépistage et la prise en charge pneumologique, néphrologique et, de manière plus élargie, gériatrique.
En pratique
Le suivi des patients implantés d’une TAVI nécessite d’abord une prise en charge spécifiquement cardiologique en raison des complications cardiovasculaires initiales potentielles, puis une approche globale à plus long terme, compte tenu de l’âge du patient et des nombreuses comorbidités.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :