Publié le 30 avr 2014Lecture 11 min
Les valvulopathies médicamenteuses longtemps étiquetées « rhumatismales » - Vers un changement de paradigme
P.-V. ENNEZAT*, Y. JOBIC**, S. MARÉCHAUX***, C. TRIBOUILLOY**** *Service de cardiologie, CHU de Grenoble. **Service de cardiologie, CHU de Brest. ***Service de cardiologie, Groupement des Hôpitaux de l’Université Catholique de Lille ****Service de cardiol
Le rhumatisme articulaire aigu est une étiologie classique de valvulopathie par restriction des mouvements valvulaires (type III de la classification de Carpentier) devenue rare dans les pays développés et notamment en France. Les causes médicamenteuses et/ou toxiques doivent être connues et recherchées attentivement devant toute valvulopathie restrictive inexpliquée.
L’extinction du rhumatisme articulaire aigu dans les pays industrialisés
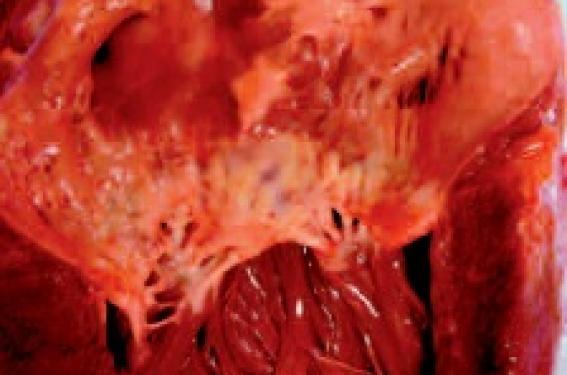
Maladie du pauvre et rare après l’âge de 25 ans, le rhumatisme articulaire aigu (RAA) est une réponse auto-immune tardive à une infection streptococcique (β-hémolytique groupe A) non traitée. Le RAA peut toucher les articulations (arthrite d’une ou de plusieurs articulations : symptôme présent dans 75 % des premiers épisodes), le système nerveux central (chorée de Sydenham), la peau (nodules sous-cutanés de Meynet, érythème marginé) et le cœur. En phase aiguë, une cardite peut être diagnostiquée associant de façon variable endocardite, péricardite et myocardite. Après des épisodes répétés de RAA, des maladies valvulaires chroniques avec épaississement des feuillets valvulaires, fusions commissurales et calcifications secondaires associées à une altération de l’appareil sous-valvulaire avec épaississement, fusion, rétraction des cordages peuvent se développer (figure 1).
Figure 1. Valvulopathie mitrale rhumatismale avec fusions commissurales, calcifications exubérantes, cordages rétractés et épaissis.
La valvule mitrale est affectée dans plus de 90 % des cas de maladie cardiaque rhumatismale. L’insuffisance mitrale sans sténose est prévalente chez les sujets jeunes surtout à la phase aiguë, associant dilatation annulaire, élongation des cordages et parfois prolapsus du feuillet antérieur ; la prévalence de la sténose mitrale, résultante d’une cardite chronique, augmente avec l’âge. L’atteinte (sténosante et/ou fuyante) de la valvule aortique est généralement associée à celle de la valve mitrale (figure 2). Les valvules tricuspides et pulmonaires sont rarement affectées. En raison de l’hyperdébit cardiaque, la grossesse est souvent un révélateur des maladies valvulaires.
Figure 2. Coupes parasternales grand axe (à gauche) et petit axe avec zoom sur la valvule aortique (au centre) et la valvule mitrale (à droite) mettant en évidence une valvulopathie mitro-aortique rhumatismale avec rétrécissement mitral modéré non calcifié et rétrécissement aortique serré (Vmax 4 m/s) et insuffisance aortique modérée avec fusions commissurales.
L’anatomopathologie des valves rhumatismales montre une fibrose avec néovascularisation, inflammation (corps d’Aschoff) et calcifications. Lorsque le diagnostic clinique est posé, une prophylaxie antibiotique est toujours recommandée : pénicilline G (1 200 000 U IM) toutes les 3 ou 4 semaines ou pénicilline V (250 mg x 2/j per os) ou sulfadiazine (0,5 à 1 g/j) ou érythromycine (250 mg x 2/j). Cette antibiothérapie devrait être poursuivie un minimum de 10 ans après la dernière crise fébrile, au moins jusqu’à l’âge de 40 ans, et parfois même à vie(1). L’incidence annuelle du RAA dans les pays développés a commencé à diminuer au XXe siècle, avec une diminution marquée après les années 1950 ; elle est actuellement inférieure à 1 par 100 000(2). Une enquête nationale menée de 1995 à 1997 dans les services français de pédiatrie a conclu que le RAA était devenu une maladie virtuelle dans l’hexagone. Ainsi, alors que le RAA était considéré comme la première cause de rétrécissement aortique (RAo) dans les années 1960 et affectait des patients de 60 ans, actuellement c’est le RAo dégénératif qui touche des patients d’âge moyen de 80 ans (processus physiopathologique partageant de nombreux points avec l’athérosclérose) et la bicuspidie qui sont de très loin les deux premières causes.
L’émergence des valvulopathies médicamenteuses
De façon parallèle à la disparition du RAA, ont émergé dès les années 1960 des valvulopathies restrictives d’origine médicamenteuse longtemps étiquetées « rhumatismales » car ayant des caractéristiques échographiques et macroscopiques relativement proches de celles de l’atteinte rhumatismale.
Au niveau mitral, on note dans ces atteintes médicamenteuses un mouvement restrictif type IIIa (en systole et en diastole) touchant préférentiellement la petite valve mitrale, lié à une rétraction de l’appareil sous-valvulaire avec épaississement, raccourcissement et fusion de cordages (figures 3 et 4). Les feuillets valvulaires sont plus ou moins épaissis avec parfois des fusions commissurales et des calcifications secondaires le plus souvent modestes. La dysfonction valvulaire se manifeste par des fuites centrales ou excentrées (en fonction du degré de restriction asymétrique des feuillets antérieur et postérieur) et plus rarement par des rétrécissements souvent modérés mais parfois sévères.
Figure 3. Coupe apicale 4 cavités mettant en évidence un épaississement et un aspect rigide (« baguettes de tambour ») de la grande valve et de la petite valve mitrale associée à une insuffisance mitrale sévère chez une patiente âgée de 54 ans traitée par benfluorex pendant 14 mois. Un double remplacement valvulaire mitro-aortique par valves mécaniques est réalisé. Une mort subite récupérée survient 2 ans après, nécessitant l’implantation d’un défibrillateur automatique.
Figure 4. Autopsie d’une patiente âgée de 50 ans décédée en période préopératoire d’un œdème aigu du poumon asphyxique lié à une insuffisance mitrale d’origine médicamenteuse (benfluorex durant 5 ans pour un syndrome métabolique) ; notez l’épaississement des feuillets et la rétraction majeure de l’appareil sous-valvulaire.
L’atteinte de la valvule aortique est plus fréquente que l’atteinte mitrale et se manifeste par une fuite centrale sur des sigmoïdes restrictives et parfois épaissies (figures 5 et 6) ; un gradient transvalvulaire aortique antérograde peut accompagner les fuites modérées à sévères. L’atteinte restrictive de la valvule tricuspide est aussi possible mais plus rare.
Figure 5. Aspect typique d’une fuite aortique centrale liée à la prise de benfluorex moyenne à sévère, centrale sur des cusps hyperéchogènes avec une ouverture en dôme et un bord libre ourlé.
Figure 6. Valvulopathie mitro-aortique médicamenteuse (7 années d’exposition au benfluorex) ayant nécessité un double remplacement valvulaire par valve mécanique chez une patiente âgée de 54 ans : ci-dessus notez l’épaississement, la fusion et la rétraction des cordages et ci-dessous l’épaississement du bord libre des cusps aortiques.
Les médicaments inducteurs de valvulopathies
Les principaux médicaments inducteurs de valvulopathies sont résumés ci-dessous par ordre chronologique.
• Les antimigraineux dérivés de l’ergot : méthysergide, ergotamine (antimigraineux).
• Les anorexigènes amphétaminiques : dexfenfluraminefenfluramine- benfluorex.
• Les agonistes dopaminergiques : cabergoline, pergolide.
• Le MDMA (ecstasy).
Le mécanisme physiopathologique est proche de celui du syndrome carcinoïde avec une stimulation des récepteurs sérotoninergiques 5-HT2B exprimés sur les fibroblastes des appareils valvulaires cardiaques. Cette stimulation produit une prolifération des fibroblastes, augmente la synthèse du collagène et des glycosaminoglycanes (GAG). Les lésions histologiques sont caractérisées par une fibrose endocardique non inflammatoire engainant valvules et cordages (figure 7).
Figure 7. Section de l’appareil sous-valvulaire mitral montrant le remaniement fibreux dense, non inflammatoire avec abondants dépôts de glycosaminoglycans (GAG) engainant et fusionnant les cordages chez une patiente âgée de 60 ans traitée par benfluorex durant 8 ans opérée d’un remplacement valvulaire mitral par valve mécanique et décédée 2 années plus tard pour un accident hémorragique sous anti-vitamine K. (photo Dr I. Quintin-Roué, anatomo-pathologie, CHU de Brest).
La fenfluramine (Pondéral®) et la dexfenfluramine (Isoméride®) ont été retirées du marché en 1997 ; c’est surtout l’hypertension artérielle pulmonaire mortelle liée à ces molécules qui a marqué les esprits. Néanmoins, plusieurs cas de valvulopathies ont été rapportés par H.M. Connolly et coll.(3) conduisant au retrait des fenfluraminiques du marché mondial. Le benfluorex (Modulator®) a été retiré du marché espagnol dès la publication d’un cas clinique en 2003 : une femme de 50 ans ayant pris du benfluorex durant 1 an de façon intermittente a eu une atteinte mitrale, aortique et tricuspide nécessitant un double remplacement valvulaire associé à une annuloplastie tricuspide.
Le benfluorex (Médiator®) a été retiré du marché français en 2009 à la suite de cas cliniques, de séries de cas contrôles et d’une étude majeure d’Alain Weill de la Caisse nationale d’assurance maladie exposés/non exposés mettant en évidence que la prescription de benfluorex en 2006 chez 43 004 patients diabétiques comparés à 1 005 129 patients diabétiques non exposés au benfluorex était statistiquement associée dans les deux années suivantes à des hospitalisations pour une cardiopathie valvulaire avec un risque relatif de 3,1 et pour chirurgie valvulaire (RR = 3,9)(4).
L’étude randomisée REGULATE a comparé pendant 1 an 310 patients diabétiques traités par benfluorex à 305 patients traités par pioglitazone. Au bout d’un an, une insuffisance aortique légère est apparue chez 14 % des patients sous benfluorex versus 1 % des patients sous pioglitazone (Odds Ratio [OR] : 15,5)(5). L’étude multicentrique transversale menée par C. Tribouilloy et coll. chez 376 patients diabétiques sans antécédent valvulaire, exposés au benfluorex comparés à 376 patients diabétiques non exposés révélait une plus grande fréquence de fuites valvulaires (grades 1 à 3) associée au benfluorex avec un OR de 5,3 pour la fuite aortique, un OR de 2,4 pour la fuite mitrale et un OR de 3,5 pour les doubles fuites mitro-aortiques(6). Il faut souligner que les fuites moyennes ou sévères faisant l’objet d’un suivi étaient exclues de cette étude.
Présentation clinique de l’atteinte valvulaire
L’atteinte valvulaire est éminemment variable : des polymorphismes génétiques au niveau de l’expression des récepteurs sérotoninergiques sont actuellement à l’étude (étude Médiagène en cours).
Sur le plan clinique, on peut observer différents aspects :
Les valvulopathies sévères avec rétraction importante de l’appareil sous-valvulaire au niveau mitral et dilatation secondaire du ventricule gauche, de l’oreillette gauche et de l’anneau mitral. Ces valvulopathies peuvent se développer en quelques mois après le début du traitement, conduisant à un essoufflement progressif, des œdèmes pulmonaires, des remplacements valvulaires par prothèses mécaniques ou biologiques (la réparation valvulaire par plastie étant le plus souvent vouée à l’échec) et parfois malheureusement au décès (prise en charge inadaptée d’une valvulopathie, mort subite sur œdème aigu du poumon « flash », accidents hémorragiques sous anti-vitamine K, complications thromboemboliques ou infectieuses des prothèses valvulaires, complications périopératoires, etc.).
Les valvulopathies mitrale et aortique de sévérité modérée ou moyenne, qui cumulées peuvent constituer une valvulopathie sévère avec une intolérance à l’effort et parfois une insuffisance cardiaque, conduisant parfois à pratiquer un double remplacement valvulaire.
Les atteintes monovalvulaires de sévérité modérée mais parfois symptomatiques, car survenant sur une cardiopathie sous-jacente liée à des comorbidités comme une hypertension artérielle, un diabète, une obésité. Le volume régurgité, même modeste, se surajoute à la dysfonction ventriculaire gauche diastolique, ce qui favorise l’émergence d’une symptomatologie fonctionnelle.
Les valvulopathies légères (grades 1-2, mild pour les Anglo-Saxons) qui forment le gros contingent des valvulopathies médicamenteuses. Elles sont souvent stables dans le temps, elles peuvent régresser à distance de l’arrêt du médicament en cause ou, à l’inverse, s’aggraver (suivi à 4 ans de l’étude REGULATE).
Le cardiologue se trouve donc face à des patients dont l’âge va de 18 à 85 ans (en moyenne, ils ont une soixantaine d’années, et sont le plus souvent des femmes), qui sont porteurs de petites fuites aortiques. L’analyse échographique de la valvule aortique ne permet pas toujours de détecter le mouvement restrictif ou l’épaississement des sigmoïdes en raison de modifications anatomiques mineures(7) ou d’une échogénicité insuffisante. L’imputabilité du médicament est établie alors sur la base de la chronologie, le caractère central de la fuite aortique, l’absence d’autres causes (bicuspidie, sclérose valvulaire dégénérative, dilatation de la racine aortique, irradiation médiastinale ou mammaire gauche, etc.) et sur les données épidémiologiques. Soulignons qu’une atteinte médicamenteuse peut aggraver la fuite déjà existante d’une valve aortique bicuspide ou irradiée ou associée à une racine aortique dilatée.
Au niveau mitral, la présence d’un mouvement restrictif des feuillets mitraux pouvant revêtir un aspect en baguette de tambour des deux valves, associé à un remaniement de l’appareil sous-valvulaire, est plus facile à reconnaître (surtout en coupe parasternale grand axe ou apicale 3 cavités), ce qui permet un diagnostic d’imputabilité plus spécifique.
Autres causes de valvulopathie restrictive
Il est important de bien connaître les aspects échocardiographiques des autres causes de valvulopathie restrictive.
Les valvulopathies carcinoïdes affectent essentiellement les valves tricuspide et pulmonaire, sauf en cas de foramen ovale perméable associé qui favorise les atteintes valvulaires gauches.
La radiothérapie médiastinale du sein ou du poumon gauche est également une cause tardive de valvulopathie restrictive souvent associée à d’autres atteintes cardiaques : coronaires, péricarde, myocarde, aorte porcelaine, tissu de conduction, etc. Sur le plan expérimental, on observe un mécanisme d’ostéogenèse et sur le plan échographique, un épaississement et un mouvement valvulaire restrictif et des calcifications valvulaires ou paravalvulaires chez 90 % des patients, ainsi que des calcifications marquées au niveau de la fibrose intervalvulaire chez 1/4 des patients avec fuite et/ou sténose aortique et/ou mitrale. Sur le plan histologique, on observe une fibrose endocardique associée à des microcalcifications.
L’insuffisance mitrale (IM) secondaire. Le remodelage ventriculaire gauche est une cause d’IM restrictive de type IIIb (en systole) fonctionnelle et/ou ischémique sur une valvule initialement normale par modification de l’alignement entre les muscles papillaires et les feuillets valvulaires et par réduction des forces de fermeture liée à la dysfonction ventriculaire gauche. Secondairement, apparaissent des modifications histologiques avec une augmentation du collagène, des glycosaminoglycans correspondant à un remodelage de l’appareil valvulaire mitral. De la même façon que pour l’IM secondaire, la dilatation de la racine aortique s’associe à une dysfonction valvulaire aortique secondaire par modification des rapports anatomiques entre la jonction aorto-ventriculaire et la jonction sino-tubulaire (qui constitue les extrémités entre le nadir de l’insertion des cusps et les commissures). Bien qu’amplement discutées, on retiendra comme normes de mesure du diamètre du sinus de Valsalva, de la jonction aortoventriculaire et de la jonction sinotubulaire les valeurs de 29-40 mm (< 21 mm/m2), 20-31 mm (13 ± 1 mm/m2) et 22-36 mm (15 ± 1 mm/m2) respectivement(8). En revanche, il n’y a pas de valeur seuil de dilatation de la racine aortique pour laquelle apparaît une fuite aortique ; par exemple, des dilatations isolées du sinus de Valsalva à 47 mm peuvent ne pas s’accompagner de fuite. En revanche, la fuite aortique peut être excentrée en cas de dilatation aortique asymétrique ou de petits prolapsus localisés.
Les maladies inflammatoires chroniques sont également à évoquer, mais la prévalence des valvulopathies est variable selon les études. On ne dispose en fait que de petites séries avec de nombreux biais de recrutement. Le contexte clinique oriente vers ce type d’étiologies.
La polyarthrite rhumatoïde est associée à des fuites valvulaires (insuffisance mitrale dans 30 à 80 % des cas, insuffisance aortique dans 9 à 33 % des cas) et à l’analyse anatomopathologique à une fibrose, une néovascularisation et une infiltration lymphocytaire des valves. La spondylarthrite ankylosante est associée à un épaississement des valves, le plus souvent sans fuite associée. Les autres causes classiques mais rares sont la maladie de Crohn, le lupus érythémateux disséminé (anomalies valvulaires évolutives dans le temps et d’autant plus fréquentes qu’il s’associe à des anticorps antiphospholipides avec épaississement valvulaire dans la moitié des cas, végétations dans 40 %, insuffisance valvulaire dans 1/4 et sténose dans moins de 5 % des cas), et la maladie de Takayasu.
Un point particulier : la sclérose valvulaire aortique
La sclérose valvulaire dégénérative, plus fréquente après 65 ans, est une cause fréquente de fuite minime. Elle est définie par un épaississement irrégulier sur le versant aortique des corps ou du bord libre des cusps avec de petites calcifications touchant souvent d’abord la sigmoïde aortique non coronaire. Il n’y a pas de fusion commissurale et les vélocités maximales transvalvulaires sont inférieures à 2,5 m/s. Il s’agit du premier stade de la sténose aortique.
En pratique
Les valvulopathies médicamenteuses sont désormais une entité bien définie.
Elles sont trop souvent rapportées à un hypothétique RAA dans l’enfance, alors qu’il n’y a pas eu d’antibioprophylaxie en prévention secondaire, que chez les femmes les grossesses se sont déroulées sans aucun symptôme, et que la valvulopathie s’est développée après 40-50 ans.
L’interrogatoire de tout patient atteint d’une fuite valvulaire de mécanisme restrictif doit désormais comporter une enquête médicamenteuse rigoureuse, à la recherche de produits inducteurs de valvulopathies.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :






