Trucs et astuces
Publié le 29 juin 2021Lecture 12 min
Les ruptures coronaires en cardiologie interventionnelle - La boîte à outils indispensable
Jean-Yves PAGNY, Hôpital Saint-Joseph ; Hôpital Européen Georges Pompidou, Paris
Le matériel de cardiologie interventionnelle progresse d’année en année autorisant des gestes de dilatation et recanalisation coronaire de plus en plus difficiles techniquement ce qui expose à une majoration des complications potentielles. Elles sont rares mais il est nécessaire de maîtriser quelques principes de réparation ainsi que le matériel adapté à chaque situation. Chaque matériel est adapté à une situation donnée et la connaissance de ces produits permet de s’adapter devant une situation inhabituelle.
Nous décrirons surtout les procédures à mettre en place en urgence devant une rupture coronaire puis par extension les procédures utilisées dans le traitement de fistules, faux anévrismes siégeant sur les coronaires.
Les ruptures coronaires
Il faut les distinguer selon leur siège.
Ruptures coronaires proximales
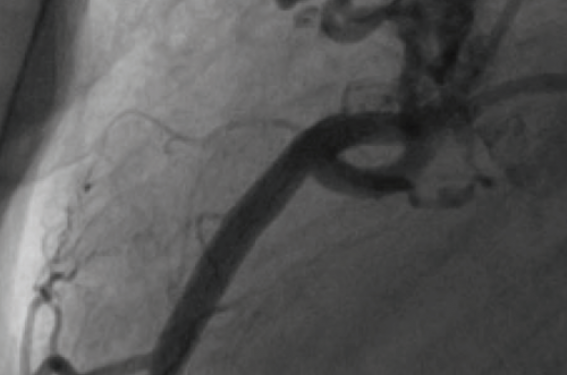
Elles sont liées en général à des inflations de ballon à pression élevée ou non sur de possibles « épines » calcaires. Elles peuvent concerner également une inflation à haute pression sur un stent déjà en place mais insuffisamment déployé. Enfin, n’importe quel ballon peut se rompre accidentellement suite à une pression élevée ou trop haute aidée ou non d’un relief intracoronaire anormal (figure 1). La rupture artérielle est dans ce cas consécutive à une lésion de jet. Toutes ces lésions surviennent sur une zone accessible à l’implantation d’un stent.
Figure 1. Angioplastie de l’IVA ; rupture du ballon et de l’IVA ; réparation avec un stent couvert BeGraft. (pontage mammaire – IVA non fonctionnelle).
Dès la fuite constatée, il faut regonfler immédiatement un ballon au niveau de celle-ci en contrôlant par une injection dans la sonde porteuse que la fuite est bien stoppée ballon gonflé. Ceci permet :
• D’analyser le type de fuite.
L’image d’extravasation de contraste peut correspondre à une simple myographie localisée (figure 2), le contraste reste proche de la rupture et se lave lentement ou au contraire fuite dans le péricarde avec une trainée de contraste (figure 3) qui se lave rapidement, manifestement en dehors de la paroi.
Figure 2. Suffusion intramyocardique postinflation à 25 bars. Péricarde sec ; traitement par stent actif standard.
Figure 3. Patient de 90 ans, rupture massive postinflation du ballon ; drainage péricardique et stent couvert.
• De préparer le matériel de « réparation ».
• De rechercher un hémopéricarde à l’échographie et mettre en route les mesures de réanimation éventuelle nécessaire.
Le traitement de choix est de colmater la brèche avec un stent couvert. La difficulté éventuelle de cette procédure est d’arriver à amener le stent couvert jusqu’au site de la fuite car le profil des stents couverts est nettement moins avantageux que celui des stents classiques (tableau).
Une extension de cathéter est parfois nécessaire. Le diamètre du stent est choisi pour qu’il soit parfaitement apposé à la paroi concernée et il doit recouvrir nettement (idéalement 10 mm) en amont et en aval de la fuite. En cas de doute sur le positionnement – il n’est pas toujours facile de voir le site exact de la rupture –, mieux vaut le décentrer vers la distalité pour se donner la possibilité de remettre un autre stent couvert en amont.
Une fois le stent posé si la fuite persiste, il est possible de regonfler le ballon du stent couvert jusqu’à sa pression maximale de rupture (en général 14- 15 atm). Si cela ne suffit pas il faudra rajouter un 2e stent couvert, en général immédiatement en amont du premier.
• Cas particulier : Si la rupture s’effectue sur un stent non couvert préalable, il est nécessaire de recouvrir une longueur plus longue que celle du stent car un stent couvert ne peut pas être parfaitement étanche sur la paroi coronaire du fait des struts du premier stent qui le « décollent » un peu de la paroi, lui faisant perdre en étanchéité. Idéalement pendant toute cette procédure de traitement de la brèche, il faut éviter d’antagoniser l’héparine qui risquerait d’occlure le stent couvert une fois implanté.
Ruptures coronaires distales
Elles sont liées à des lésions des petites branches causées par un guide « traumatique » et surviennent plus volontiers au cours de procédures qui nécessitent en simultané plusieurs guides. Ces ruptures ont le plus souvent la particularité de ne pas être reconnues immédiatement mais seulement plus tard dans la procédure car la fuite est moins importante et ses conséquences mettent plus de temps à apparaître.
Ici encore il faut analyser le type de fuite, myographie (figure 4) ou fuite dans le péricarde (figure 5) et dans tous les cas faire une échographie en urgence à la recherche d’un épanchement péricardique.
Figure 4. Effraction dans une microbranche d’une marginale par le guide du Rotablator® ; échec d’inflation prolongée devant la fuite ; mise en place d’un microcathéter et de 2 coils.
Figure 5. En fin de procédure d’angioplastie de bifurcation IVA-diagonale : fuite en distalité d’une diagonale (A) ; mise en place d’un microcathéter avec vérification de la localisation (B) ; insertion de coils avec occlusion complète distale de la diagonale (C).
La tentation est forte de gonfler un petit ballon en amont de la fuite pour diminuer le flux mais ceci ne sera que palliatif et n’empêche pas une circulation collatérale de s’établir en aval et réalimenter la fuite à contrecourant.
L’embolisation de la branche au contact de la fuite reste la méthode de choix.
• L’embolisation
– Un microcathéter effilé sur 0,014 ou 0,018’’ (2,4 ou 2,7 F). Le diamètre intérieur est important à connaître pour le choix de l’embole à insérer qui bien-sûr ne doit pas être d’un diamètre supérieur. Le microcathéter doit être amené au contact de la fuite sur un guide 0,014’’ non traumatique.
– Un embole à insérer dans le microcathéter : le but est de faire une oblitération complète du flux à partir du niveau de la fuite en ne lésant qu’une quantité la plus minime possible de myocarde. Deux types d’emboles sont à privilégier.
– Les coils à détachement contrôlé (figure 6) : ce sont de petits fils en acier/platine qui lorsqu’ils sont non contraints s’enroulent spontanément ; leur matériau – avec en plus pour certains des petites fibres à leur surface – sont très thrombogènes. Le coil est solidaire d’un filament métallique qui a un rôle de « pousseur ». L’ensemble est présenté dans un « microtube » plastique dans lequel le coil est contraint et donc allongé, toujours solidaire de son pousseur (figure 6A). La procédure de mise en place est d’amener au contact du microcathéter (déjà en place dans la coronaire rompue), le microtube puis de pousser l’ensemble pousseur-coil solidaires. Ceci fait donc entrer le coil dans le microcathéter où il est contraint par le diamètre du microcathéter et donc étiré. Quand on ne peut plus pousser cet ensemble pousseur-coil à l’intérieur de son microtube, on retire ce dernier et on continue de pousser l’ensemble jusqu’à ce que le coil sorte de l’extrémité distale du microcathéter. Là il s’enroule. Il est possible de le mobiliser pour mieux l’enrouler ou même le retirer en cas d’erreur de taille jusqu’à la manœuvre de largage. La partie coil est très radio-opaque alors que le pousseur qui lui est solidaire est très peu visible.
Plusieurs systèmes de largage sont possibles une fois le coil enroulé dans la branche coronaire : soit le coil se détache dès qu’il est sorti complètement du microcathéter (figure 6C), soit il existe une « poignée-pince » qui se met en place à l’extérieur au bout du pousseur et qui actionne le largage par une simple mobilisation d’un bouton (figure 6B). L’occlusion n’est pas toujours immédiate au largage du 1er coil d’autant que le patient est sous antiagrégant et héparine. Un deuxième coil peut être nécessaire.
Figure 6. Présentation de 2 types de coils à détachement contrôlé.
A : présentation en sortie d’emballage du coil à détachement contrôlé et de la poignée de largage ; coil à la sortie du cathéter ; coil en gros plan. B : un système de largage avec poignée une fois le coil positionné en bonne place et son mécanisme. C : autre système de largage par détachement spontané lorsque le coil est complètement libéré du microcathéter.
– Le choix des dimensions des coils est important
Ils sont répertoriés par le diamètre du microcathéter nécessaire, leur longueur une fois étirés, leur diamètre une fois non contraints et leur forme. Le diamètre doit être celui de l’artère à son site de largage (1 ou 2 mm) et la longueur « étiré » suffisamment courte pour ne pas trop remonter dans l’artère si le coil ne s’enroule pas bien (en général 20 mm maximum).
– Emboles d’éponges hémostatiques insolubles résorbables (CuraSpon®, CuraMedical ou GELITA-SPON, Novimed ; figure 7). Ce sont des éponges hémostatiques présentées en petits cubes ou en plaques fines découpables facilement avec un bistouri ou de petits ciseaux. Ces éponges vont oblitérer le flux coronaire une fois amenées à l’extrémité distale du microcathéter. Le matériau est résorbable en quelques jours à 3 semaines mais l’effraction sera traitée. Dans une seringue Luer Lock de 1 cc seulement un petit cube de GELITA-SPON de 2 à 4 mm est introduit une fois le piston retiré. La seringue est remplie de contraste, purgée de l’air et comme le GELITA-SPON flotte, il se positionne près de l’embout Luer Lock. Il faut être prudent pour le pousser dans le microcathéter avec des impulsions sèches successives sur le piston mais de seulement 0,05 cc. Le GELITA-SPON est responsable d’une résistance dans le microcathéter, mais au moment où il va être libéré du microcathéter dans la coronaire, il n’y aura plus de résistance. Le risque est de le pousser avec trop de contraste ce qui va le faire refluer en amont. L’occlusion est immédiate et si elle ne l’est pas, il faut remettre un autre morceau un peu plus gros.
Figure 7. GELITA-SPON : éponge hémostatique insoluble, résorbable et sa préparation.
– coils ou GELITA-SPON ? Les deux techniques sont efficaces. Le coil à détachement contrôlé est plus facile à mettre en place, le risque avec le GELITA-SPONest de faire refluer en amont l’embole de gélatine. Cependant, les coils sont plus chers et dans tous les cas il faut avoir dans son laboratoire du GELITA-SPON qui pourra servir en l’absence de coil de la bonne dimension voire en complément d’un premier coil incomplètement efficace. Sur ce même principe, des emboles de graisse prélevés sur le patient ont été proposés mais le GELITA-SPON est plus propre pour la même efficacité.
– Les microbilles sont à proscrire dans cette situation du fait de leur mauvais contrôle de largage avec un risque de reflux important en amont du micro-cathéter. Les injecter avec un ballon coaxial gonflé en amont expose au moment du dégonflage à ce même risque. En dehors de l’urgence, il peut y avoir des indications que nous verrons plus loin.
Des embolisations sont parfois indiquées
Des embolisations à partir des coronaires peuvent être nécessaires dans des situations de faux anévrisme coronaire, de fistules développées à partir des coronaires (le plus souvent vers le réseau artériel pulmonaire), de tumeurs, etc. Nous ne discuterons pas des indications mais des méthodes d’embolisation une fois l’indication retenue à partir d’images essentiellement.
Une fistule coronaire
Elle peut être embolisée avec des coils à détachement contrôlé (figure 8). Il faut mettre le microcathéter dans le pédicule qui alimente la fistule puis insérer les coils. La difficulté est de choisir la bonne taille en diamètre et longueur de coil : si le diamètre choisi est inférieur au diamètre de l’artère à emboliser, le coil va s’enrouler pour trouver sa forme non contrainte et migrer en aval.
Figure 8. Fistule coronaro-aortopulmonaire responsable d’une insuffisance cardiaque : embolisations avec des coils à partir du pédicule qui naît de l’IVA (B), puis coronaire droite après embolisation du pédicule de l’IVA (C) et contrôle final (D).
Un faux anévrisme
Un faux anévrisme développé à partir de l’IVA proximale (figure 9) aurait pu être traité par un stent couvert mais le pronostic à terme des stents couverts n’étant pas optimal, le choix se porte plutôt sur des coils dans le faux anévrisme puis un stent « standard » devant la porte d’entrée.
Figure 9. Faux anévrisme de l’IVA (A) de découverte fortuite sans sténose sur l’IVA : positionnement du microcathéter dans le faux anévrisme pour insérer les coils puis implantation d’un stent non couvert devant la porte d’entrée du faux anévrisme (B).
Un volumineux faux anévrisme
(figure 10)
D
Figure 10. Volumineux faux anévrisme au dépend de la RVG se drainant dans le sinus coronaire (A) ; mise en place d’un microcathéter (flèches rouges) dans le faux anévrisme et contrôle de sa position par injection (cercle bleu) (B) ; insertion de coils de grande longueur (C) ; contrôle final avec des coils supplémentaires sur la terminaison de la RVG dans le faux anévrisme (D).
Développé à partir de la rétroventriculaire droite et se drainant vers le sinus coronaire, il a été traité, d’une part, avec des coils de 30 cm de long, 20 à 30 mm de diamètre, s’enroulant en 3D et, d’autre part, des coils sur « la porte d’entrée ».
Une tumeur cardiaque en préopératoire hypervasculaire
(figure 11)
Figure 11. Tumeur cardiaque développée à partir de deux pédicules naissant de l’IVA et de la coronaire droite : possibilités d’embolisation avec des microbilles 500-700 μ en mettant le microcathéter dans le pédicule.
Découverte fortuitement à l’occasion de douleurs atypiques. Une décision opératoire est portée et pour faciliter l’intervention, comme cela est souvent fait en cancérologie (en préopératoire de tumeur hypervasculaire), une embolisation préopératoire est discutée mais non réalisée. Elle aurait été faite avec des micro-billes calibrées. Elles se présentent en flacons de billes non résorbables calibrées de 300 à 500 μ, 500-700 μ, 700-900 μ et 900-1 200 μ (figure 12). Pour une embolisation assez distale dans les vaisseaux, c’est la taille 700-900 μ qui est utilisée et qui ne passe pas la barrière capillaire. C’est ce qui aurait été utilisé dans le cas de cette tumeur. Les microbilles sont présentées dans des flacons ou des seringues dans un liquide où elles coulent. Ceci permet de remplacer une partie du liquide surnageant par du contraste iodé. L’injection se fait à partir d’un microcathéter avec les billes mélangées au contraste iodé à l’aide d’une seringue de 1 cc et de petites impulsions. Sous contrôle scopique, la progression des billes et de l’embolisation est surveillée, le risque étant un reflux en amont du microcathéter des billes qui emboliseraient des territoires sains.
Figure 12. Microbilles permettant par embolisation d’entraîner un infarctus capillaire.
Des saignements post drains péricardiques chirurgicaux Un patient fait plusieurs tamponnades avec des drains péricardiques chirurgicaux à répétition sur une période d’un an. Il a bénéficié d’une embolisation à partir d’une petite branche auriculaire (figure 13) responsable au scanner d’un saignement actif dans la zone du drain. L’embolisation est faite avec des micro-billes 500-700 μ à partir d’un microcathéter qui ne pouvait pas atteindre la zone immédiate du saignement. Elle est complétée par un micro-coil dans l’artère nourricière. Trois mois plus tard, le scanner identifiait une tumeur dans cette zone.
Figure 13. Scanner (A) montrant le saignement actif (flèche). Microcathéter préformé (type Swann) positionné avec un guide 0,014’’ dans une branche auriculaire (C) et contrôle du saignement actif (flèches) ; contrôle postembolisation avec des microbilles et un coil final (D).
Conclusion
▹ Chaque service de cardiologie interventionnelle doit posséder une boîte à outils permettant de traiter des ruptures coronaires en urgence, qu’elles soient proximales ou distales. Le matériel minimal comporte :
– des stents couverts avec une variété de diamètre et de longueur
– des coils à libération contrôlée (2 à 4 mm de diamètre de longueur 2 cm) avec les microcathéters adaptés au coils en termes de diamètre intérieur
– de l’éponge hémostatique type GELITA-SPON
– un kit de drainage péricardique
▹ Certaines embolisations sont réalisées en dehors de l’urgence comme des fistules développées à partir des coronaires, des faux anévrismes, des tumeurs, etc. Ces embolisations peuvent faire appel à des matériels différents avec des coils de tailles plus importantes mais aussi des microbilles calibrées.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


