Focus-Nouvelle technique
Publié le 30 nov 2008Lecture 8 min
Rôle de l’IRM cardiaque dans les SCA à « coronaires saines »
A. BAMMERT, Nouvelles Cliniques Nantaises, Nantes
Chez certains patients présentant un syndrome coronaire (SCA) aigu avec élévation de la troponine, la coronarographie ne retrouve pas de lésion causale évidente. Cette situation correspond à près de 10 % des SCA selon le répertoire CRUSADE (38 300 patients) publié en 2006(1). Les étiologies de ce type d’événement comptent les vrais SCA sans lésion coronaire significative qui sont soit de réels accidents coronaires athérothrombotiques (cas où la lésion coronaire s’est détergée avant la coronarographie), soit éventuellement thromboemboliques (foramen ovale perméable, thrombus intraventriculaire gauche, syndrome des antiphospholipides, etc.), soit enfin, les myocardites, les cardiopathies de stress ou… les fausses élévations de la troponinémie. Ces différentes pathologies sont actuellement mal diagnostiquées et le traitement instauré est parfois non adapté.
SCA à coronaires perméables : enjeux diagnostiques et thérapeutiques
Ces épisodes sont le plus souvent traités par excès comme une hypothétique « rupture de plaque », ou bien par défaut, étiquetés « probable myocardite virale ». L’administration d’un traitement prolongé, non adapté à l’étiologie fait probablement courir un risque à ces patients, principalement l’administration d’un ou deux traitement(s) antiagrégant(s) plaquettaire(s).
Dans le but d’établir un diagnostic étiologique précis chez ces patients, l’IRM cardiaque est particulièrement adaptée car elle met en évidence les zones de nécrose et les localise dans l’épaisseur de la paroi. Elle permet aussi de visualiser les plages d’inflammation dans le myocarde ventriculaire.
Technique d’acquisition et interprétation des images IRM
En dehors des contre-indications classiques de l’IRM (pacemaker, corps étrangers métalliques), il faut prendre conscience que l’IRM cardiaque nécessite la participation du patient : il doit faire des apnées pendant l’examen qui dure 30 minutes.
Le protocole d’IRM dans ce type de syndrome est standardisé et réalisé en routine. L’acquisition des images est synchronisée à l’ECG.
Trois types de séquences
Les séquences dynamiques dites « ciné » dans les plans de coupe classiques : 4 cavités, 3 cavités, long axe du ventricule gauche (VG), petit axe (coupes de 7 mm jointives) permettant d’estimer les volumes du VG et de calculer la fraction d’éjection du VG par la méthode de Simpson.
Les séquences T2 avec saturation de graisse (réalisées impérativement avant l’injection de produit de contraste) recherchent la présence d’un hypersignal en faveur d’une zone d’inflammation active au sein du myocarde.
Les séquences dites « de rehaussement tardif », séquences T1 réalisées 10 minutes après injection de gadolinium.
Ces dernières sont les plus informatives. Elles sont basées sur le principe que le gadolinium est très rapidement relargué par les myocytes normaux alors qu’il est capté pendant une vingtaine de minutes dans les zones de nécrose cellulaire, de fibrose ou d’inflammation. Les zones pathologiques apparaissent en hypersignal T1.
La très bonne résolution spatiale de l’IRM permet d’appréhender la localisation de ces hypersignaux : la présence d’une zone de rehaussement tardif sous-endocardique respectant la distribution coronaire est pathognomonique d’une pathologie coronaire(2) (figure 1).
Dans les processus myocarditiques, les zones de rehaussement tardif sont médioventriculaires ou sous-épicardiques, ou disséminées (« patchy »), ne respectant pas la distribution coronaire ou de forme plutôt nodulaires(3) (figure 2).
La présence de troubles de la cinétique segmentaire le plus souvent apicaux (mais de façon non exclusive) avec aspect de ballonisation sans hypersignal spontané T2 (pas d’œdème) ni rehaussement tardif correspond aux syndromes de dysfonction apicale transitoire ou syndrome de « takotsubo » (figure 3 et 4)(4-5).
Sans l’IRM, le diagnostic ne peut être retenu qu’en cas de normalisation complète spontanée de la cinétique segmentaire du VG dans un délai d’un mois.
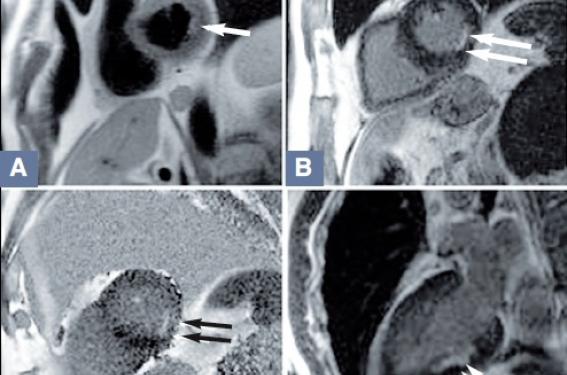
Figure 1. Patient de 59 ans. Syndrome douloureux thoracique avec élévation de la troponinémie. Coronaires angiographiquement saines. IRM cardiaque à J4. A : séquence T2, coupe petit axe basale : hypersignal sous-endocardique de la paroi inferolatérale. B : séquence T1 (TSE) tardive après gadolinium, coupe petit axe basale : rehaussement sous-endocardique de la paroi inférolatérale. C : séquence T1 (PSIR) tardive après gadolinium, coupe petit axe basale : rehaussement sous-endocardique de la paroi inférolatérale. D : séquence T1 (TSE) tardive après gadolinium, coupe long axe VG : rehaussement sous-endocardique de la paroi inférieure. Diagnostic IRM : infarctus du myocarde sous-endocardique inférolatéral.
Figure 2. Patiente de 39 ans. Syndrome douloureux thoracique avec élévation de la troponinémie. Coronaires angiographiquement saines. IRM à J3. A : séquence T2, coupe 4 cavités : hypersignal intramural dans le septum. B : séquence T1 tardive après gadolinium, coupe 4 cavités : rehaussement intramural linéaire au même niveau que l’hypersignal T2. C : séquence T2, coupe petit axe médioventriculaire : hypersignal sousépicardique dans les parois inférieure, inféroseptale et inférolatérale. D : séquence T1 tardive après gadolinium, coupe petit axe : rehaussement tardif en bande, sous-épicardique correspondant à l’hypersignal T2. Diagnostic IRM : myocardite aiguë en phase œdémateuse.
Figure 3. Patiente de 68 ans. Syndrome douloureux thoracique avec élévation de la troponinémie. Coronaires angiographiquement saines. Contexte de stress émotionnel intense. IRM cardiaque à J5. A et B : séquences ciné, coupe 4 cavités ; vaste akinésie apicale avec aspect de ballonisation. C : séquence T2 avec saturation de graisse, coupe 4 cavités : pas d’hypersignal. D : séquence T1 tardive après gadolinium, coupe 4 cavités : pas de rehaussement tardif. Diagnostic suspecté à l’IRM : syndrome de ballonisation apical transitoire.
Figure 4. Même patiente que figure 3. A et B : IRM à 3 mois, séquences ciné, coupe 4 cavités en diastole (A) et systole (B) : récupération d’une cinétique segmentaire normale. Diagnostic IRM : confirmation d’un syndrome de ballonisation apicale transitoire.
Pourquoi proposer une IRM à tous les patients présentant un SCA à coronaires perméables ?
L’élévation de la troponinémie reflète la nécrose myocardique. La grande majorité des patients présentant une douleur thoracique aiguë avec des anomalies ECG et une élévation de la troponine sont correctement diagnostiqués comme SCA car la coronarographie retrouve le plus souvent la ou les lésions coupables.
Cependant, dans le cas où l’examen coronarographique ne retrouve pas la lésion coupable, le clinicien se retrouve en face d’un véritable dilemme. Généralement, le diagnostic est établi par un faisceau d’arguments cliniques, anamnestiques et biologiques. L’échographie endocoronaire permet de rechercher une rupture de la continuité endothéliale coronaire (IVUS). La mise en évidence d’une « rupture de plaque » chez de tels patients aux coronaires « lisses » ou faiblement athéromateuses permet de relier le syndrome douloureux thoracique à l’étiologie coronaire et de les traiter comme il se doit. Il s’agit cependant d’une technique invasive, d’une part, et qui ne permet pas, d’autre part, de faire la lumière sur l’étiologie lorsque l’exploration se révèle négative.
L’IRM cardiaque est capable de fournir des informations sur le mécanisme étiologique de la nécrose reflétée par l’élévation de la troponinémie en déterminant notamment son origine ischémique ou inflammatoire.
Cette imagerie de rehaussement tardif est devenue le « gold standard » pour la détection in vivo de cicatrices myocardiques en rapport avec un processus ischémique ou inflammatoire(6). Cette résolution spatiale élevée et le contraste de l’IRM permettent la détection et l’analyse de la localisation de la nécrose myocardique. Les zones de nécrose sous-endocardiques sont en effet sous-diagnostiquées en scintigraphie monophotonique (SPECT) ou même en tomographie par émission de positrons (TEP). Seule l’IRM, par la mise en évidence d’hypersignaux T2 permet de mettre en évidence de façon précise et localisatrice les zones d’œdème au sein du myocarde.
Une grande capacité d’analyse tissulaire
L’application de cette technique non invasive qui possède une grande capacité d’analyse tissulaire dans les SCA avec élévation de la troponine et coronaires perméables paraît parfaitement justifiée.
L’IRM cardiaque a démontré sa capacité diagnostique dans les myocardites aiguës qui représente la première cause de SCA avec élévation de troponine et coronaires perméables(7). La présence de zones de rehaussement tardif en IRM est bien corrélée à l’anatomopathologie et l’IRM peut guider les prélèvements endomyocardiques pour en améliorer la rentabilité.
Quant au diagnostic de cardiopathie « de stress », l’apport de l’IRM est majeur pour le distinguer de l’infarctus apical à coronaires perméables(5).
Dans les cas où une plage d’infarctus du myocarde sous-endocardique est détectée malgré l’absence de lésion causale évidente en coronarographie, le mécanisme peut relever d’une recanalisation spontanée rapide survenue avant la coronarographie, d’un processus thromboembolique ou d’un spasme coronaire. Dans ce cadre, il est incontestable que les seules données de la coronarographie sont insuffisantes.
En apportant un diagnostic précis sur l’étiologie coronaire du syndrome présenté par le patient mais aussi un diagnostic de localisation, l’IRM est un outil fondamental qui va guider la poursuite des examens complémentaires que l’on peut utiliser dans ce cas : IVUS, éventuellement scanner coronaire pour identifier la « rupture de plaque » causale, échocardiographie transœsophagienne pour rechercher un mécanisme d’embolie à point de départ valvulaire gauche (endocardite, tumeurs) ou d’embolie paradoxale, bilan de thrombophilie.
Enfin, lorsque l’IRM ne retrouve aucune anomalie, faute d’affirmer qu’il s’agit d’une « fausse élévation de la troponine », il est licite de penser que le pronostic est plus favorable, mais des études sont nécessaires pour l’affirmer.
Conclusion
Le SCA avec élévation de la troponine sans lésion coronaire angiographique est relativement fréquent et pose un véritable dilemme au clinicien quant au diagnostic étiologique et surtout quant à la prise en charge thérapeutique.
L’IRM cardiaque est l’outil diagnostique de choix. Cet outil permet dans la majorité des cas de poser un diagnostic précis et fiable.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


