Publié le 02 oct 2007Lecture 6 min
Le bilan de thrombophilie
B. DAHMANI, J.-P. RINALDI, C. FISSORE, I. RISS et S. GABRIEL, Centre hospitalier Princesse Grace, Monaco
Dans le cadre des Journées monégasques « Thrombose et Hémostase » organisées par le centre hospitalier Princesse Grace de Monaco, plusieurs mises au point récentes ont été faites sur la thrombophilie. Celle-ci peut être définie comme une maladie multifactorielle parfois multigénique associant des thromboses veineuses d’apparition précoce, récidivantes ou de siège inhabituel, associées à un état d’hypercoagulabilité constitutionnel et/ou acquis.
Quand demander un bilan de thrombophilie ?
Il n’est pas indispensable de demander systématiquement un bilan de thrombophilie chez tout patient porteur d’une thrombose veineuse. Le nombre croissant des demandes, leur coût, leur signification clinique et leurs implications thérapeutiques pas toujours consensuelles, le réservent à une population de patients présentant des critères bien définis et à des sujets asymptomatiques dans des situations particulières.
On demandera un bilan d’hémostase chez :
- les sujets malades : en cas d’antécédents familiaux, de premier accident thrombotique confirmé avant 45 ans, de thrombose récidivante, de thrombose spontanée sans cause identifiable ou de siège inhabituel (mésentérique, cérébral, rénal...), de thrombose associée à des avortements spontanés ou associant une thrombose veineuse et artérielle, ou enfin de nécrose cutanée à l’introduction d’un traitement AVK ;
- les sujets asymptomatiques : s’il a été découvert une anomalie constitutionnelle chez un membre de la famille lors d’une enquête familiale, ou avant prescription d’estroprogestatifs, lorsqu’il existe une histoire familiale de thrombose.
Quels tests demander au laboratoire dans ce cas ?
L’antithrombine (AT)
L’antithrombine est le principal inhibiteur physiologique de la coagulation, cofacteur de l’héparine. Elle inhibe la thrombine, le facteur X activé, mais aussi d’autres facteurs de la cascade de la coagulation.
Héréditaires à transmission dominante, les déficits en antithrombine sont les plus thrombogènes des thrombophilies constitutionnelles, sauf pour le type II HBS.
Les déficits en antithrombine sont caractérisés par un taux d’antithrombine plasmatique souvent de l’ordre de 50 à 75 %. Chez le nouveau-né, ce taux rejoint les valeurs normales de l’adulte au cours de la première année.
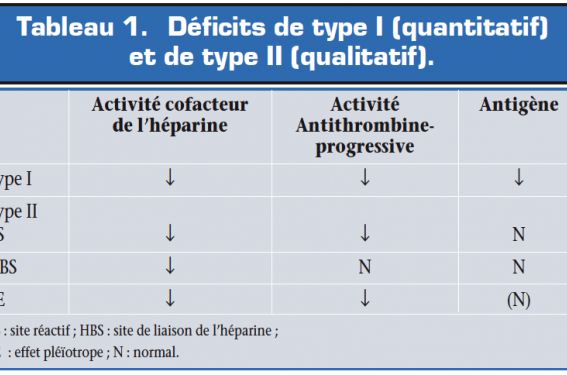
Deux types de déficit sont individualisés (tableau 1) :
- déficit de type I (quantitatif) : la protéine synthétisée est normale mais en quantité diminuée ;
- déficit de type II (qualitatif) : mutation au niveau des domaines fonctionnels.
Le système protéine C/protéine S
Les protéines C et S sont des facteurs vitamine K-dépendants, inhibiteurs physiologiques de la coagulation. La protéine S est le cofacteur de la protéine C activée (tableaux 2 et 3).
Les premiers accidents peuvent survenir le plus souvent après 30 ans, souvent spontanés, mais parfois à l’occasion d’un facteur déclenchant : estroprogestatifs, grossesse, immobilisation. Ces déficits peuvent se compliquer d’une nécrose cutanée à l’introduction des antivitamines K.
Pour ne pas porter de diagnostic par excès, une confirmation sur un deuxième prélèvement est impérative ainsi qu’une exclusion soigneuse de toute cause de déficit acquis. La grossesse et un éventuel traitement par AVK rendent l’interprétation impossible. De plus, les grandes variations chez l’enfant amènent souvent à interpréter avec prudence les dosages avant 10 ans, dans le cas d’enquêtes familiales.
La mutation G 202I0A de la prothrombine
L’anomalie est une transition G20210A dans la région 3’ non transcrite du gène de la prothrombine. Chez les sujets présentant une tendance thrombotique, la prévalence est de l’ordre de 5 à 7 %, selon les études récentes. Le risque relatif de thrombose veineuse serait augmenté de 3 à 5 fois, encore plus si le sujet présente un facteur V Leiden associé. Le diagnostic ne peut être réalisé que par technique de biologie moléculaire, sur l’ADN génomique, sur le même prélèvement que le facteur V Leiden.
La mutation du facteur V de Leiden
Cette anomalie est liée à une mutation dans le gène du facteur V, entraînant une substitution du résidu arginine en position 506 en glutamine. Le facteur V Leiden à l’état hétérozygote est présent chez 2 à 5 % des sujets d’origine caucasienne. Chez les sujets hétérozygotes, le risque de thrombose veineuse est multiplié par environ 5 à 7. Chez les homozygotes, le risque de thrombose veineuse semble important (x 20).
Le diagnostic de résistance à la protéine C activée (RPCa) peut être posé par un test de coagulation (test phénotypique biologique). Ce test est interprétable chez les patients sous antivitamines K et sous héparines. La recherche directe de la mutation est possible après consentement du patient par l’analyse de l’ADN par polymerase chain reaction (PCR), qui permet de distinguer les hétérozygotes des homozygotes.
Thrombophilie et facteurs de la coagulation
Leiden Thrombophilia Study
Facteur VIII > 150 % ; OR : 6,2 (3,4-11,0) ;
Facteur IX > 150 % ; OR : 4,8 (2,3-10,1) ;
Facteur XI > 120 % ; OR : 2,2 (1,5-3,2).
Fibrinogène
Taux > 5 g/l ; OR : 4,3 (1,7-10,3).
Le fibrinogène est un facteur de risque faible.
Homocystéine
L’homocystéine est un acide aminé soufré du métabolisme de la méthionine. L’hyperhomocystéinémie majeure avec homocystinurie est due à une mutation homozygote de la cystathionine-bêtasynthase (CBS). L’hyperhomocystéinémie modérée n’est pas rare dans la population générale, car elle est influencée par le mode de vie et de nombreuses variations physiopathologiques telles que, l’âge, le tabac, l’inflammation, les déficits en folates, vitamines B6 ou B12, l’insuffisance rénale, l’hypothyroïdie, ainsi que certains médicaments (méthotrexate, fénofibrate, carbamazépine, etc.).
La relation entre méthionine tetrahydrofolate réductase (MTHFR) et thrombose veineuse n’est pas établie et passe nécessairement par une hyperhomocystéinémie induite ; c’est la raison pour laquelle la recherche de l’hyperhomocystéinémie est préférable.
Quelles sont les conditions requises pour un prélèvement optimal ?
Dans l’idéal, le bilan biologique doit être réalisé à distance de tout événement thrombotique évolutif, 3 mois après le dernier épisode, 3 à 6 semaines après l’arrêt des traitements anticoagulants, car ces derniers peuvent modifier leur interprétation.
Diminution de l’antithrombine chez les patients traités par héparine non fractionnée (HNF), déficit de protéine C et protéine S chez ceux traités par AVK.
Éviter le prélèvement sur cathéter ; le garrot doit être modérément serré et maintenu très peu de temps, et l’examen doit être réalisé dans les 2 heures qui suivent le prélèvement.
Comment interpréter les résultats du laboratoire ?
Tout cardiologue doit connaître les différents types de réponse du laboratoire, prérequis indispensable pour éviter une erreur d’interprétation.
Cela met en avant le contact privilégié du clinicien avec le biologiste en charge de l’hémostase, avec qui il doit avoir des contacts réguliers (tableaux 4 et 5).
Antithrombine (AT)
Il convient d’éliminer un déficit acquis en AT, en général transitoire, comme une coagulation intravasculaire disséminée (CIVD), un sepsis sévère, un syndrome hémolytique urémique, un syndrome néphrotique, une hépatopathie sévère, une prééclampsie, une hémodialyse, un traitement hormonal estroprogestatif.
Protéine C
Les déficits acquis en protéine C doivent être recherchés en cas de : CIVD, maladie thromboembolique aiguë, maladie hépatique sévère, préeclampsie, purpura thrombotique thrombocytopénique, hépatopathie sévère, hémodialyse, chimiothérapie (méthotrexate, cyclophosphamide, 5FU).
Protéine S
Les déficits acquis en protéine S sont retrouvés en cas de : syndrome inflammatoire, VIH, tabagisme, hémodialyse, traitement AVK, lupus érythémateux disséminé, grossesse, traitements hormonaux, chimiothérapie du cancer du sein.
Les anti-phospholipides
La détermination du lupus anticoagulant (LA), selon les recommandations de l’ISTH (International Society on Thrombosis and Haemostasis) :
Lupus anticoagulant (anti-prothrombinase) :
– dépistage par l’allongement des tests phospholipides dépendants ;
– mise en évidence de l’effet inhibiteur du plasma sur un ensemble de plasmas normaux par un test de mélange ;
– tests de confirmation (utilisant différentes concentrations en phospholipides) ;
– élimination de la présence d’un inhibiteur antifacteur.
Anticardiolipines (aCL).
Anti-bêta 2-glycoprotéine I (abêta2 GPI).
En cas de positivité de l’un des trois paramètres, le résultat doit être confirmé à 3 mois d’intervalle.
En pratique
L’exploration d’un bilan de thrombophilie doit être une démarche réfléchie.
Son interprétation, souvent délicate, requiert une bonne connaissance de toutes les variations physiopathologiques et pharmacologiques induites, afin d’optimiser la prise en charge de la maladie thromboembolique en maîtrisant les ratios (bénéfice/risque et bénéfice/coût).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :