Explorations-Imagerie
Publié le 01 juin 2022Lecture 6 min
Amylose cardiaque : apport de l’imagerie multimodale en pratique
Martin NICOL, Mathilde BAUDET, Damien LOGEART, Hôpital Lariboisière Saint-Louis, université de Paris, Paris
La cardiomyopathie amyloïde peut être liée à l’amylose à transthyrétine (TTR) (sauvage ou mutée) ou à l’amylose AL liée à des dépôts de chaînes légères d’immunoglobulines monoclonales.
L’amylose à TTR représente 5 % des causes de cardiopathie hypertrophique, 13 % des causes d’insuffisance à FEVG préservée et serait associée à 10 % des patients présentant une sténose aortique avec indication à un remplacement valvulaire aortique(1). Depuis 2018 et l’essai ATTRACT, le traitement de l’amylose cardiaque à transthyrétine repose sur l’utilisation d’un stabilisateur du tétramère de transthyrétine : le tafamidis(2). D’autres traitements sont en cours d’études : les thérapies anti-sens, l’inotersen et le patisiran qui ont une indication dans les formes neurologiques.
Ľ amylose AL est une maladie rare. On compte environ sept cents nouveaux cas par an en France. Soixante-dix à quatre-vingts pour cent des patients ont une atteinte cardiaque au diagnostic. Le précurseur amyloïdogène dans l’amylose AL est le plasmocyte qui sécrète des chaînes légères d’immunoglobulines monoclonales capables de se polymériser en fibrilles amyloïdes. Le traitement repose sur une chimiothérapie antiplasmocytaire dont le but est d’éradiquer la production de chaînes légères. Actuellement en France, les patients ayant une amylose cardiaque AL sont traités par une chimiothérapie associant le daratumumab (anticorps monoclonal anti-CD38) et VCD (bortézomib, cyclophosphamide, dexaméthasone).
En cas de suspicion d’amylose cardiaque, les deux premiers examens à prescrire sont l’immuno-électrophorèse plasmatique et uri- naire et la scintigraphie osseuse au biphosphonate (figure 1, algorithme diagnostique).
• L’échocardiographie
L’échocardiographie demeure l’examen de première intention en cas de suspicion diagnostique, notamment devant des signes extracardiaques (canal carpien, canal lombaire rétréci, macroglossie, surdité, neuropathie périphérique sensitivo-motrice, ecchymoses périorbitaires, syndrome néphrotique), une insuffisance cardiaque à FEVG préservée associée à un microvoltage ou pseudo-onde q de nécrose sur l’ECG et à une élévation importante des taux plasmatiques de biomarqueurs cardiaques (NT-proBNP et troponine I ou T).
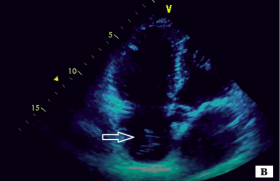
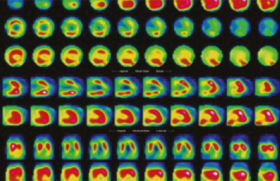
On recherche une augmentation de l’épaisseur myocardique liée à l’accumulation de dépôts amyloïdes au niveau du myocarde ou de l’endocarde, un épaississement valvulaire et/ou du septum interauriculaire. La pseudo-hypertrophie est accompagnée d’un remodelage concentrique fort avec rapport h/r > 0,6. Fréquemment, il existe une dysfonction diastolique avec au stade précoce un rapport E/A < 1 et une diminution des vitesses myocardiques de l’onde e’ en Doppler tissulaire expliquant un rapport E/e’ élevé. À un stade plus tardif, un flux mitral restrictif est souvent retrouvé. Les oreillettes sont modérément dilatées la plupart du temps. Une petite onde A et une altération du strain atrial (fonctions pompe et réservoir) sont des marqueurs de dysfonction atriale et probablement des marqueurs de risque thrombo embolique alors même que les patients sont en rythme sinusal. Précocement, on note une altération de la fonction systolique longitudinale du ventricule gauche évaluée par le strain avec un aspect de relative épargne des segments apicaux (appelé aussi « gradient base apex ») (figure 2).
La FEVG est souvent conservée jusqu’à un stade avancé. Le volume d’éjection systolique est fréquemment diminué et la mesure du débit cardiaque indexé est un marqueur de mauvais pronostic. Une augmentation de l’épaisseur du ventricule droit (> 6 mm) doit être recherchée. La fonction systolique ventriculaire droite peut également être altérée précocement dans cette population, notamment le TAPSE et le strain de la paroi libre du ventricule droit. Un épanchement péricardique est présent dans environ 50 % des cas.
Plusieurs scores d’échocardiographie ont été développés. En cas d’hypertrophie ventriculaire gauche, Boldrini et coll.(3) ont montré que les outils diagnostiques les plus performants étaient un rapport h/r > 0,6, un rapport E/Ea > 11, un TAPSE < 19 mm, un strain longitudinal global > -13 % et un gradient base apex avec rapport strain apical/basal > 2,9.
En cas d’amylose AL systémique prouvée, une atteinte cardiaque peut être diagnostiquée en cas de strain longitudinal > -17 %, un gradient base apex et une élévtion de la troponine T > 35 ng/l avec une excellente performance diagnostique(4).
• Imagerie nucléaire
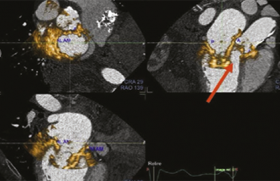
Depuis 2016(5), la scintigraphie osseuse au biphosphonate a transformé la stratégie diagnostique de l’amylose cardiaque à TTR reposant jusqu’alors sur une preuve histologique. En effet, en cas de fixation cardiaque (grade 2 à 3 de la classification de Perugini) du radiotraceur et en l’absence de composant monoclonal, le diagnostic d’amylose cardiaque à TTR est posé avec une spécificité et une valeur prédictive positive de 100 % (figure 3).
La dénervation cardiaque est fréquente en cas d’amylose cardiaque, liée à la dysautonomie par atteinte des fibres du sympathique et parasympathique. Plusieurs équipes ont déjà montré que cette dénervation identifiée par la scintigraphie cardiaque à la MIBG précédait l’infiltration myocardique amyloïde. De plus, un rapport cœur/médiastin < 1,43, 4 heures après l’injection du radio-traceur, serait un marqueur prédictif de mortalité.
De nouveaux radio-traceurs (florbétapir et F-18-florbétaben) ont montré une affinité importante pour les fibrilles amyloïdes. Leur indice de rétention myocardique semble plus important dans l’amylose AL que TTR ce qui permettrait de les différencier. Ces radio-traceurs permettraient également de détecter les dépôts dans l’ensemble des organes cibles. Ils sont encore en cours d’étude pour l’évaluation diagnostique et la réponse au traitement.
• L’IRM cardiaque
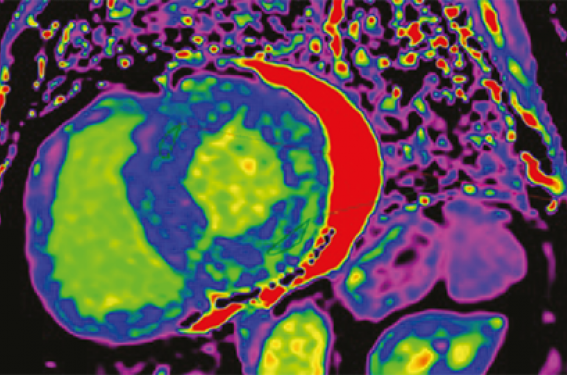
L’IRM cardiaque permet une caractérisation du tissu myocardique précise et est particulièrement intéressante en cas de suspicion de cardiomyopathie infiltrative. Celle-ci repose sur l’analyse des cartographies T1 et T2 mapping, de la mesure du volume extracellulaire et sur l’analyse du rehaussement tardif intramyocardique.
Pour rappel, les déterminants biologiques de l’augmentation du T1 sont l’œdème myocardique (en cas d’infarctus aigu ou de myocardite) ou l’augmentation du volume extracellulaire (fibrose interstitielle ou dense, dépôts d’amylose). L’augmentation du T2 est plus spécifique de l’œdème. Le volume extracellulaire est le reflet de l’espace interstitiel, sa mesure étant corrélée à la présence de collagène de type 1, l’élastine, des protéines non fibrillaires (laminine, fibronectine) et des protéines bioactives.
Une impossibilité à annuler le signal myocardique sur les séquences de TI-scouting ou une inversion du signal myocardique avant celui du pool sanguin est un outil sensible pour le diagnostic d’amylose cardiaque. Typiquement, on retrouve un rehaussement intra-myocardique diffus non systématisé à un territoire coronaire sur les séquences tardives 8 à 10 minutes après l’injection de gadolinium (figure 4). La présence d’un rehaussement tardif est prédictive de mortalité dans les deux types d’amylose. Les séquences de T1 mapping (pré-injection de gadolinium) révèlent une élévation de T1 dans les zones infiltrées de dépôts amyloïdes (ou en cas de fibrose diffuse). Dans l’amylose, les valeurs de T1 sont particulièrement élevées et cela est corrélé avec les indices de dysfonction diastolique et systolique ventriculaires. La principale limite du T1 est l’absence de valeur cut-off car celle-ci dépend du champ magnétique (plus basse sur une IRM 1,5 Tesla vs 3 Tesla) et de l’échantillonnage local. À titre indicatif, on peut donner comme cut-off une valeur de 1 100 ms sur IRM 1,5 Tesla et 1200 ms sur IRM 3 Tesla.La mesure du volume extracellulaire (post-injection de gadolinium) est plus reproductible. Une valeur > 35 % peut être retenue comme valeur anormale et donc évocatrice d’atteinte cardiaque amyloïde, mais n’est pas spécifique de cardiomyopathie amyloïde (peut se retrouver en cas de fibrose interstitielle ou fibrose dense, quelle que soit la cause). Il s’agit d’un outil pronostique plus robuste que le T1 mapping dans l’amylose cardiaque. Enfin, un œdème myocardique révélé par une augmentation du T2 mapping > 55 ms peut également être retrouvé dans l’amylose AL et serait lié à la toxicité des chaînes légères.
À ce jour, aucun examen d’imagerie ne permet de faire la différence entre les deux types d’amyloses.
• Réponse au traitement
L’amélioration du strain longitudinal global de plus de 2 % est associée à une amélioration du pronostic en sus de la classification pronostique de la Mayo Clinic basée sur les biomarqueurs cardiaques (troponine T, NT-proBNP et différentiel des chaînes légères).
L’IRM cardiaque pourrait permettre d’identifier une réponse cardiaque précoce en mesurant les variations de T1 et de volume extracellulaire.
Actuellement, la réponse au traitement repose sur une évaluation clinique (classe NYHA) et biologique (réponse cardiaque si diminution de plus de 30 % du NT-proBNP).
• Conclusion
Le cardiologue doit désormais savoir rechercher l’amylose cardiaque dans de nombreux syndromes : insuffisance cardiaque à FEVG préservée, fibrillation atriale, troubles conductifs, sténose aortique, dysautonomie. L’utilisation de l’imagerie multi-modalité à bon escient est indispensable pour aboutir rapidement au diagnostic d’amylose cardiaque et à son sous-typage indispensable pour une prise en charge spécialisée.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :