Publié le 17 oct 2017Lecture 6 min
Quand opérer une fuite tricuspide ?
Patrick DEHANT, Clinique Saint-Augustin Bordeaux
Longtemps peu ou pas exploré, le cœur droit est resté en retrait derrière l’exploration du cœur gauche. L’importance pronostique de la fonction ventriculaire droite (VD) et celle d’une fuite tricuspide (IT) sont maintenant bien documentées, mais l’indication d’un geste chirurgical est moins fréquente que pour les valves aortiques ou mitrales. Le risque est de ne pas y penser.
Quand opérer une fuite tricuspide (IT) ? Pour répondre à cette question, nous allons nous tourner vers les recommandations. Nous disposons actuellement de recommandations relativement récentes, mises à jour en 2012 pour les recommandations européennes (tableau 1) et en 2014 pour les recommandations nord-américaines. Les recommandations européennes(1) ont l’avantage d’une rédaction conjointe par la Société Européenne de Cardiologie (ESC) et la Société Européenne de Chirurgie Cardio-Thoracique (EACTS). Ces dernières listent 7 questions à poser avant de porter une indication chirurgicale de valvulopathie (tableau 2).
Les fuites tricuspides ont une particularité étiologique car 75 % d’entre elles sont secondaires et 25 % seulement sont primitives ou organiques.
Les fuites tricuspides organiques
Les étiologies sont rhumatismale, dégénérative, congénitale (anomalie d’Ebstein), carcinoïde ou médicamenteuse, endocarditique, par fibrose endomyocardique, traumatique ou iatrogénique. Le diagnostic étiologique se fait essentiellement par l’échographie et l’anamnèse.
Les 7 questions du tableau 2 sont assez adaptées aux IT organiques qui sont le plus souvent isolées, sans valvulopathie gauche associée.
Cette fuite est-elle sévère ?
La quantification va utiliser les différentes modalités écho-Doppler dans une approche intégrative (tableau 3)(2).
Le diagnostic de fuite sévère est en général aisé. Les grades moins importants sont plus délicats à évaluer en raison de leur variabilité en fonction des conditions de charge. Nous ne détaillerons pas la quantification, sujet déjà traité (EchoCardiographie n°13 - février-mars 2008).
VD : ventricule droit ; SOR : surface de l'orifice régurgitant ; OD : oreillette droite ; VCI : veine cave inférieure.
Le patient est-il symptomatique et les symptômes sont-ils en rapport avec l’IT ?
Question difficile car les signes droits sont tardifs, et une fuite sévère est souvent apparemment bien supportée. En effet, au premier plan viennent une fatigabilité et une baisse de capacité fonctionnelle auxquelles beaucoup de patients s’adaptent en limitant leur activité. Le test d’effort, pour évaluer la réelle capacité fonctionnelle, permet assez souvent de démasquer de faux asymptomatiques, la capacité fonctionnelle étant limitée par l’absence d’élévation du débit cardiaque en rapport avec l’importante régurgitation tricuspide. L’échographie d’effort apporte un peu plus en objectivant la faible augmentation de débit aortique. Les recommandations sont claires pour une chirurgie chez un patient symptomatique :
– IT primitive sévère symptomatique malgré un traitement médical optimal et sans dysfonction VD sévère (niveau 1). Elles sont moins claires quand la symptomatologie manque, les seuils de dilatation VD ou de dégradation de la fonction VD étant mal définis. À notre sens, l’évaluation de la fonction VD doit être multiparamétrique et associer la mesure de l’onde s en DTI à l’anneau, la fraction de raccourcissement de surface en 4-cavités, le calcul de l’accélération de l’anneau pendant la phase de contraction isovolumique (IVA) ;
– IT sévère isolée a- ou pauci-symptomatique avec dilatation progressive VD ou dégradation de la fonction VD (niveau II a).
Les fuites tricuspides secondaires
Elles sont en rapport avec une dilatation annulaire et une restriction du jeu valvulaire (tethering) par remodelage VD dû à une surcharge en pression et/ou en volume.
Les responsables sont :
– les atteintes du cœur gauche (VG ou valve) entraînant une hypertension artérielle pulmonaire (HTAP) ;
– toute autre cause d’HTAP (BPCO, embolie pulmonaire, shunt gauche-droit) ;
– toute cause de dysfonction VD (idiopathique, ischémie ou infarctus VD).
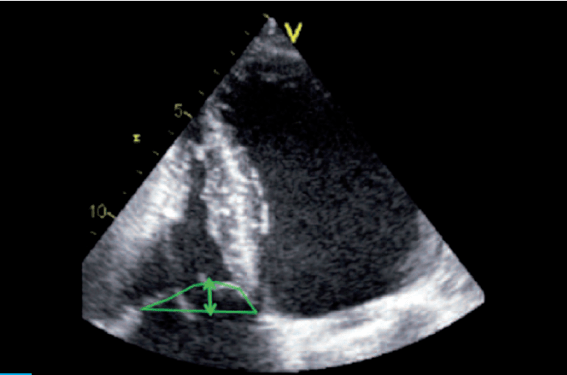
À la quantification habituelle indispensable de la fuite, il est important d’ajouter l’évaluation du « tenting » (figure 1). Dans un travail destiné à rechercher des prédicteurs de fuite résiduelle après annuloplastie tricuspidienne(3), ni la surface VD mal appréciée par la planimétrie en 4-cavités, ni le diamètre annulaire mesuré en 4-cavités ne sont de bons indicateurs. En revanche, la distance point de coaptation-anneau et la surface sous la tente ont des sensibilités et spécificités satisfaisantes (tableau 4).
Figure 1. Évaluation du « tenting » : mesure de la surface sous la tente formée en systole par l’anneau tricuspide et les feuillets valvulaires ; mesure de la distance point de coaptationanneau (double flèche).
Il n’y a pas de modification d’indication pour les IT sévères associées à une valvulopathie gauche chirurgicale : indication de niveau I. En revanche, pour les fuites moins importantes, les recommandations européennes et nord-américaines ont évolué.
Les modifications portent sur l’élargissement de l’indication chirurgicale pour les IT modérées ou moyennes (mild et moderate) dès que l’anneau est dilaté (> 40 mm ou 21 mm/m2) : niveau II a.
Comment mesurer l’anneau tricuspide ?
Théoriquement en coupe apicale des 4-cavités en diastole. Cette coupe ne rend pas toujours compte du plus grand diamètre, et la multiplication des incidences semble judicieuse (figure 2).
Figure 2. Principales incidences permettant de mesurer le diamètre de l’anneau tricuspide. C’est l’incidence 4-cavités qui a permis de définir les seuils actuellement utilisés.
Recommandation de niveau II a : on doit considérer (« should be considered ») et discuter l’indication. Quels sont les éléments de cette discussion ?
La vraie question est : peut-on prédire quels patients sont à risque de développer une IT plus ou moins tardive ?
Les facteurs prédictifs reconnus dans la littérature(4,5) sont :
– FA ;
– FEVG altérée ;
– étiologie rhumatismale ;
– présence de sonde de pacemaker ;
– HTAP.
Quand l’IT ainsi évaluée entre dans une indication chirurgicale de type I ou II a, on doit se poser les 4 dernières questions du tableau 1 :
– quelles sont l’espérance de vie et l’espérance de qualité de vie du patient ?
– les bénéfices attendus de l’intervention (comparés au pronostic spontané) excèdent-ils les risques ?
– que souhaite le patient ?
– les ressources chirurgicales locales permettent-elles l’intervention prévue ?
Le patient se retrouve donc au centre de la discussion médico-chirurgicale avec ses éventuelles comorbidités.
En conclusion
Isolée ou associée, une IT significative a une valeur pronostique péjorative.
Il faut évaluer la valve tricuspide en préopératoire d’une chirurgie du cœur gauche, en particulier d’une IM, quelle que soit l’étiologie.
L’examen échographique d’une valvulopathie gauche est déjà long, mais il faut s’astreindre à évaluer le cœur droit, qui apparaît de plus en plus comme un prédicteur fort du pronostic de nos patients.
L’examen écho-Doppler doit évaluer :
– la valve tricuspide ;
– l’anneau (utiliser toutes les incidences) ;
– l’éventuel tenting ;
– la fonction VD ;
– la sévérité de la fuite ;
– les pressions pulmonaires.
Il faut avoir présents à l’esprit :
– la fréquence des IT tardives ;
– la mortalité des interventions redux pour IT sévère ;
– les facteurs prédisposant aux IT tardives : FA, FEVG altérée, étiologie rhumatismale, HTAP, anneau dilaté > 40 mm ou 21 mm/m2.
Il faut être préventif dans les IT secondaires. Toutes les séries récentes encouragent à pratiquer une annuloplastie dès qu’existe une fuite de grade 2 ou 3 (mild et moderate) avec dilatation annulaire (≥ 40 mm ou > 21 mm/m2) d’autant que sont présents les facteurs favorisants.
C’est notre rôle de cardiologue de fournir au chirurgien suffisamment d’arguments pour associer ce geste à la chirurgie prévue. L’annuloplastie tricuspide est un geste chirurgical simple, pouvant même être réalisé à cœur battant, prolongeant peu l’acte chirurgical.
Une stratégie d’annuloplastie plus systématique (comme encouragée par les dernières recommandations) chez les patients devant bénéficier d’une chirurgie de valve gauche, nous fera probablement ajouter le geste d’annuloplastie chez des patients qui n’en auraient jamais eu besoin, mais la gravité des interventions pour IT tardive est telle que ce risque mérite, à mon sens, d’être couru.
"Publié dans EchoCardiograhie"
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :