Publié le 12 sep 2017Lecture 10 min
Rechercher un athérome aortique : pourquoi et comment ?
Nadia BENYOUNES(a), Marion CHAUVET(b), Clélie VAN DER VYNCKT(a), Laurie SOULAT-DUFOUR(b), Ariel COHEN(b) - a. Unité de cardiologie, Fondation ophtalmologique A. de Rothschild, Paris ; b. Service de cardiologie, Hôpital Saint-Antoine, Paris

Les accidents vasculaires cérébraux représentent un problème majeur de santé publique, puisque troisième cause de décès dans les pays industrialisés, et importante source d’hospitalisation et d’incapacité fonctionnelle.
Les sources cardiaques et aortiques d’embolie (SCE) seraient responsables de 15 à 30 % des cas d’accidents ischémiques cérébraux (AIC), globalement plus sévères que les AIC d’autres causes. Leur reconnaissance est donc impérative, du fait des implications pronostiques et thérapeutiques(1).
L’Association européenne d’échocardiographie (AEE) classe les SCE en sources à risque majeur et sources à risque mineur ou indéterminé. Les plaques athéromateuses de l’aorte sont considérées comme source à risque majeur (tableau 1)(2). L’AEE considère que l’échocardiographie transœsophagienne (ETO) est la méthode de choix pour la recherche et la caractérisation de l’athérome aortique, même si d’autres outils sont disponibles.
Prévalence de l’athérome aortique dans la population générale
La prévalence de l’athérome aortique dans la population générale n’a pas été largement étudiée, la recherche se faisant généralement de façon secondaire, chez des patients symptomatiques. Quelques données sont disponibles, avec dans une étude portant sur 2 700 autopsies (âge de 10 à 64 ans) suite à une mort d’origine autre que vasculaire (coronaropathie, accident cérébral, diabète et HTA exclus), une augmentation de l’extension de l’athérome aortique avec l’âge, l’athérome occupant 0,4 % de la surface intimaleentre 15 et 24 ans contre 33 % entre 55 et 64 ans(3). Un athérome aortique protrusif a été rapporté chez 7 % des patients explorés par ETO dans un laboratoire d’échocardiographie(4).Dans une étude de population, 579 patients d’âge ≥ 45 ans ont été explorés par ETO : un athérome aortique complexe a été identifié chez 7,6 % des inclus (protrusif d’épaisseur > 4 mm, avec élément mobile ou ulcération de plaque) contre 43,7 % ayant un athérome simple(5).
Recherche de l’athérome aortique, pourquoi ?
Le concept est né du fait que les AIC de cause indéterminée dits « AIC cryptogéniques » représentaient jusqu’à 40 % des AIC dans les années 1990(6). En outre, la fréquence des sténoses carotidiennes homolatérales était certes plus élevée chez les patients avec embolie rétinienne de cholestérol que chez des témoins, mais cette différence n’atteignait pas la significativité(7). Ainsi est née l’hypothèse d’une source d’embolie située en amont des troncs supra-aortiques, justifiant la recherche d’un athérome aortique en cas d’AIC ou d’occlusion de l’artère centrale de la rétine (OACR) cryptogéniques.
Recherche de l’athérome aortique, comment ?
Études anatomiques
(tableau 2)
Les études anatomiques dans les années 1990 ont confirmé l’association entre AIC cryptogénique et athérome aortique. Ainsi, dans une série portant sur 500 autopsies consécutives, les patients avec AIC avaient un risque multiplié par 4 d’avoir des plaques d’athérome de crosse et des plaques ulcérées ont été identifiées dans 61 % des cas si l’AIC était étiqueté cryptogénique, contre 22 % des cas lorsqu’une cause potentielle avait été identifiée(8). Dans une seconde étude portant sur 120 autopsies, 68 % des patients décédés des suites d’AIC avaient des plaques ulcérées, un thrombus de plaque ou l’association des deux, identifiant les plaques compliquées comme facteur de risque indépendant d’AIC (odds ratio 5,8, IC à 95 % : 1,1-31,7 ; p < 0,05)(9).
Échocardiographie transœsophagienne
(tableau 2)
Suite à de nombreuses études dont certaines sont citées dans ce texte, l’ETO en mode bidimentionnel avec sonde multiplan est devenue la technique d’imagerie de référence pour la détection, la mesure (épaisseur) et la caractérisation (calcification, ulcération, thrombus surajouté) de l’athérome aortique, comme le précisent les recommandations de l’AEE(2).
• Épaisseur de plaque
Les études ETO ont permis d’identifier les plaques à risque. Dans une étude cas-témoins, la fréquence de l’athérome de crosse aortique était significativement plus élevée chez des patients ≥ 60 ans hospitalisés pour AIC que chez des témoins(10). De surcroît, le risque d’AIC s’élevait avec l’augmentation de l’épaisseur de plaque (tableau 3)(10). Dans cette étude, la fréquence des plaques ≥ 4 mm était significativement plus élevée dans le groupe des AIC cryptogéniques (28,2 %) et les éléments mobiles surajoutés étaient 14 fois plus fréquents chez les patients avec AIC cryptogénique. Enfin, le risque d’AIC n’était pas accru pour les plaques de l’aorte thoracique descendante (en aval de l’ostium de l’artère sous-clavière gauche).
D’autres études cas-témoins en ETO ont évalué le risque lié à l’épaisseur de plaque(11-16). L’échographie épi-aortique peropératoire a également été utilisée(17) (tableau 2).
• Morphologie et composition de plaque : ulcérations
Ces mêmes études cas-témoins en ETO(14-16) s’accordent pour identifier les plaques ulcérées comme à risque d’AIC (tableau 4). La définition échographique généralement admise pour une ulcération de plaque est la présence d’un cratère de profondeur et de largeur ≥ 2 mm.
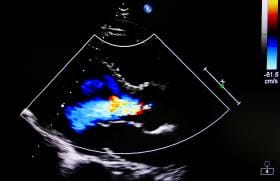
La boucle 1 illustre un athérome de crosse en ETO à 0°, avec d’une part une épaisseur de plaque dépassant les 4 mm (mesurée au maximum à 6,6 mm) et d’autre part un ulcère de plaque (petit cratère).
• Morphologie et composition de plaque : calcifications, irrégularités de surface
Dans l’étude cas-témoins de FAPS(18), bien que les calcifications et les irrégularités de plaques soient indépendamment associées au risque d’AIC, l’épaisseur de plaque reste le facteur morphologique le plus fortement associé au risque d’AIC. En combinant l’épaisseur des plaques avec la présence ou l’absence des autres paramètres morphologiques (irrégularités et calcifications), les plaques ≥ 4 mm non calcifiées sont le plus fortement associées au risque d’AIC (tableau 5), suggérant qu’il puisse s’agir de plaques instables, à haut risque de rupture et de complications.
Ces résultats traduisent les constatations anatomiques. Cent cinquante-cinq segments à partir de 13 aortes d’hommes de moins de 69 ans décédés subitement et ayant une coronaropathie significative sans autre cause apparente de décès, ont été examinés à l’autopsie(19). Les plaques dites « stables » étaient intactes, les plaques dites « instables » étaient thrombosées. La taille du cœur lipidique extracellulaire dépassait 40 % de la section de plaque dans 91,1 % des cas dans le groupe « plaques instables » et seulement 3,2 % des cas dans le groupe « plaques stables ». La taille du cœur lipidique apparaît comme un facteur favorisant important de thrombose de plaque. Parallèlement, le rapport nombre absolu des fibres musculaires lisses/macrophages par unité de surface était plus important dans la chape des plaques stables et plus faible dans la chape des plaques instables.
L’implication biomécanique des calcifications de plaques d’athérome est différente selon le degré de calcification(20). La compressibilité du cœur lipidique est responsable d’un stress de paroi significatif au niveau de la chape fibreuse en systole. Une calcification étendue et dense réduit le stress de la chape fibreuse en réduisant la déformation liée à l’augmentation de pression en systole. À l’opposé, des microcalcifications au sein de la chape fibreuse augmenteront significativement le stress local de la chape, pouvant conduire à la rupture de plaque(20). Les boucles 2, 3 et 4 illustrent une plaque rompue, visualisée en ETO en utilisant la modalité « biplan ». La chape et le cœur central sont bien identifiés.
• Morphologie et composition de plaque : lésions mobiles
Les éléments mobiles surajoutés, supposés être des thrombi, sont à haut risque embolique. L’avantage de l’ETO par rapport aux autres modalités non invasives (scanner et IRM) est de permettre l’évaluation en temps réel des éléments mobiles(2). Les boucles 5, 6 et 7 montrent des thrombi de crosse, documentés chez des patients explorés par ETO pour AIC.
Qu’en est-il de l’athérome de l’aorte descendante ?
Les données de la littérature ne sont pas concordantes quant au risque d’embolisation cérébrale rétrograde à partir d’un athérome situé en aval de l’artère sous-clavière gauche (les boucles 8 et 9 montrent un athérome complexe de l’aorte thoracique descendante proximale, après le départ de l’artère sous-clavière gauche, chez un patient exploré par ETO pour AIC).
Certaines études, notamment IRM, suggèrent la possibilité d’un flux rétrograde dans l’aorte descendante(21), qui augmente avec l’âge, la baisse de la fréquence cardiaque, l’augmentation de la rigidité artérielle et la présence d’athérome complexe.
Néanmoins, une métaanalyse récente portant sur 11 études et 4 000 patients(22), alors qu’elle a bien mis en évidence une prévalence augmentée d’athérome complexe situé au niveau de l’aorte thoracique descendante chez les patients avec AIC (25,4 % ; IC 95 % : 14,6- 40,4 % vs 6,1 % ; IC 95 % 3,4-10 % chez les patients sans AIC ; p = 0,001), n’a pas montré d’excès d’athérome complexe de l’aorte thoracique descendante chez les patients avec AIC cryptogénique par rapport à ceux avec AIC non classé selon les critères TOAST (Trial of Org 10172 in Acute Stroke Treatment)(23), suggérant que l’athérome de l’aorte descendante serait plus un marqueur d’athérosclérose généralisée et de haut risque vasculaire qu’une source cardiaque d’embolie.
Angioscanner
L’ETO est un examen semi-invasif. De plus, une petite portion de l’aorte ascendante peut être masquée par la colonne d’air trachéal. L’angioscanner aortique n’ayant pas ces inconvénients, il est utilisé pour le dépistage et la caractérisation de l’athérome de l’aorte thoracique, avec une bonne sensibilité(24). La figure 1 illustre le type d’images obtenues par angioscanner et son miroir en ETO. Cependant, l’angioscanner n’est pas non plus dénué d’inconvénients, au vu de la taille du matériel, de son prix, de sa disponibilité et de l’irradiation. De plus, la visualisation des éléments mobiles en temps réel est impossible. Enfin, sa spécificité serait imparfaite(25).
Figure 1. Exemple de bonne corrélation entre l’angioscanner et l’ETO respectivement d’une plaque à risque de l’isthme aortique comportant une vaste ulcération et un élément bourgeonnant : vues longitudinales (A, B) et sections de coupe (C, D).
Imagerie par résonance magnétique (IRM)
L’IRM permet la description anatomique des plaques et une approche de leur composition. La concordance avec l’ETO est bonne en ce qui concerne la caractérisation des plaques et leur extension(26).
Tomographie par émission de positons (PETscan)/scanner
Cette technique d’imagerie médicale utilise le traceur radioactif [18F]-flurodéoxyglucoce (en abrégé [18F]- FDG). Lorsque les images PET sont fusionnées avec les images de l’angioscanner, il devient possible de localiser et d’étudier l’extension des plaques d’athérome actives, permettant l’identification de plaques vulnérables ou à haut risque(27).
Implications thérapeutiques
Anticoagulants et antiagrégants plaquettaires
Les études prospectives françaises(18) et américaines(28) n’ont pas montré de bénéfice du traitement anticoagulant. Dressler(29) et Ferrari(30) ont rapporté à partir d’études rétrospectives une diminution des accidents ischémiques cérébraux sous traitement anticoagulant, mais le bénéfice concernait surtout(30) ou exclusivement(29) les patients avec thrombus mobile.
L’étude ARCH(31), prospective, randomisée, contrôlée avait pour objectif de tester la supériorité de l’association d’antiagrégants plaquettaires (aspirine 75 à 150 mg/j + clopidogrel 75 mg/j) sur le traitement anticoagulant oral par warfarine (INR entre 2 et 3) chez des patients avec AIC, accident ischémique transitoire (AIT) ou embolie artérielle périphérique, avec documentation d’un athérome de l’aorte thoracique > 4 mm, et en l’absence d’autre source d’embolie identifiée. Elle a dû être arrêtée au bout de 8 ans du fait d’un nombre d’inclus insuffisant, et n’a donc pas permis de trancher, l’étude ayant une puissance insuffisante.
Il est donc difficile de proposer une attitude codifiée. La présence d’un thrombus aortique mobile reste une indication raisonnable du traitement anticoagulant initial(2, 32) jusqu’à sa disparition, relayé par un traitement antiagrégant plaquettaire.
Statines
Si l’effet bénéfique d’un traitement par statine évoqué par plusieurs auteurs n’a pas encore été établi dans de grands essais thérapeutiques, il est néanmoins accepté et recommandé par les sociétés savantes(2).
Enfin, l’endartériectomie prophylactique ne réduit pas le risque d’AIC(33).
Messages clés
Les données cliniques ont identifié les plaques à haut risque embolique comme étant celles dont l’épaisseur est ≥ 4 mm.
L’athérome aortique complexe est considéré comme une source cardiaque majeure d’embolie(2).
L’athérome complexe est défini par une épaisseur de plaque ≥ 4 mm et/ou comportant un élément mobile ou une ulcération de plaque(34) (figures 2 et 3).
Chez les patients avec antécédent d’AIC, le risque de récidive ou de survenue d’un autre événement vasculaire est multiplié par 3 à 4 chez les patients avec athérome complexe de crosse par rapport à ceux avec athérome < 4 mm ou sans athérome.
L’AEE recommande l’étude de la crosse aortique en échocardiographie transthoracique (ETT) chez tous les patients avec AIC. L’ETO doit être réalisée si l’ETT ne permet pas d’exclure un athérome de crosse ou d’en préciser les caractéristiques. Chez les patients avec embolie périphérique, si l’ETT ne permet pas d’en identifier la source, l’ETO est indiquée à la recherche d’une source aortique d’embolie(2).
De nouvelles modalités échocardiographiques en ETO peuvent compléter utilement l’imagerie traditionnelle : « la modalité biplan »(35) permettant de visualiser simultanément deux plans de la même structure en temps réel, et les différentes modalités « 3D »(36, 37) (boucle 10).
Figure 2. Même patient que sur la boucle 1. Athérome de crosse visualisé en ETO à 0°, avec d’une part une épaisseur de plaque dépassant les 4 mm (mesurée au maximum à 6,6 mm) et d’autre part un ulcère de plaque (petit cratère).
Figure 3. Athérome complexe, hétérogène et bourgeonnant, visualisé en ETO à 63°, au niveau de la crosse distale, au départ de l’artère sous-clavière gauche.
Les auteurs ne déclarent pas de conflit d’intérêt concernant cet article.
"Publié dans EchoCardiographie"
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :