Polémique
Publié le 29 fév 2016Lecture 6 min
Peut-on identifier les patients qui vont dégrader leur FEVG après la pose d’un stimulateur ?
P. MABO, N. BEHAR, R. MARTINS, service de cardiologie et maladies vasculaires, CHU de Rennes
Pourquoi une telle question ? Exercice de style académique ? Identification d’une population « à risque » justifiant un suivi rapproché après l’implantation d’un stimulateur « conventionnel » ? Optimisation individuelle du mode de stimulation pour limiter le pourcentage de stimulation ventriculaire droite (VD) ? Meilleur guidage de la procédure d’implantation ?
En pratique, tout ne se résume-t-il pas à poser une autre question : chez quels patients proposer en première intention l’implantation d’un stimulateur bi-ventriculaire (bi-V) ?
La réponse pourrait être simple : suivez les dernières recommandations de la Société européenne de cardiologie qui ont intégré, certes avec prudence, les résultats de l’étude BLOCK-HF dont voici la conclusion : « la stimulation bi-V est supérieure à la stimulation conventionnelle du VD chez les patients avec un bloc atrioventriculaire (BAV) et une dysfonction systolique du ventricule gauche (définie par une FEVG ≤ 50 %) en classe fonctionnelle NYHA I, II ou III ».
Pour revenir à la question posée, nous aimerions, comme souvent en médecine, prédire le futur, mais nous devons humblement nous limiter à considérer les faits et en tirer le meilleur pour une prise en charge optimale des patients.
Que nous dit la médecine basée sur les preuves ?
Les effets délétères de la stimulation apicale du VD, identifiés dès 1925 par Wiggers et confirmés depuis sur de nombreux modèles animaux, sont non seulement mécaniques, mais aussi structurels, allant jusqu’à la modification de l’expression de certains gènes, pouvant faire suspecter une prédisposition génétique.
Qu’en est-il en situation clinique ?
La littérature est riche dans le contexte des dysfonctions sinusales, aboutissant à la conclusion pratique de stimuler le moins possible les ventricules, solution apportée par les algorithmes de préservation de la conduction ventriculaire intrinsèque (figure 1) et qui peut aussi se discuter pour les BAV paroxystiques. Pour les patients stimulés pour BAV, les données sont avant tout observationnelles car une étude comparative « ONOFF » est ici impossible. Néanmoins, la suspicion est forte mais ne peut être généralisée.
Dans un travail récent(1), D. Auger a évalué l’impact pronostique de l’asynchronisme mécanique (échocardiographie) induit par la stimulation VD chez des patients avec un BAV, sans dysfonction VG préalable. La mortalité à 1 et 5 ans était de 5 et 27 % en présence d’asynchronisme postimplantation versus 1 et 3 % en l’absence d’asynchronisme induit (p < 0,003). Le taux d’hospitalisations pour insuffisance cardiaque était de 18 et 24 % versus 3 et 4 % (p < 0,001).
Figure 1. Patient implanté d’un stimulateur double chambre pour dysfonction sinusale. Grâce à l’algorithme de préservation de la conduction auriculoventriculaire intrinsèque, les QRS restent spontanés et fins, au prix d’un intervalle PR allongé.
Que faire en pratique : site de stimulation VD alternatif ou stimulation bi-V ?
Les sites alternatifs n’ont pas, pour l’instant, apporté de preuves cliniques solides. Attendons les résultats de l’étude SEPTAL-PM…
Implantation de novo d’un stimulateur bi-ventriculaire ?
Cette option, dans le cadre d’une indication de stimulation pour bradycardie, a été évaluée avant tout dans des populations avec une dysfonction VG modérée à sévère, avec pour conclusion que la stimulation bi-V apporte un certain bénéfice, mais sur des critères d’évaluation « non robustes », avant tout des données fonctionnelles ou de remodelage VG à court terme (HOBIPACE, COMBAT)(2,3). En revanche, l’étude BLOCK-HF(4) (FEVG ≤ 50 %) montre une différence significative (-26 %) en faveur de la stimulation bi-V sur un critère primaire d’évaluation composite (mortalité totale, visite urgente pour insuffisance cardiaque, réduction ≥ 15 % du volume télésystolique VG), ainsi qu’une réduction de 30 % des hospitalisations et de 17 % de la mortalité totale, au prix d’un taux de complications liées à la sonde VG de 6,5 %. Les données sont en revanche moins convaincantes en l’absence de dysfonction VG préalable.
L’étude PACE (2009)(5), comparant stimulation conventionnelle et stimulation bi-V chez des patients avec fonction VG normale et concluant au bénéfice de stimulation bi-V est hautement critiquable car 50 % des patients inclus présentaient une dysfonction sinusale (stimulation ventriculaire VD ou bi-V « forcée »). PACE n’autorise aucune conclusion pour les patients avec BAV.
L’étude PREVENT-HF (2011)(6) incluant uniquement des patients avec un BAV ne retrouve qu’une tendance en faveur de la stimulation bi-V sur un critère de remodelage VG à 1 an. L’étude BIOPACE, la plus récente et en attente de publication, a inclus des patients avec ou sans dysfonction VG. Elle est également négative sur le critère principal composite (mortalité totale et hospitalisations pour insuffisance cardiaque). Il existe une légère tendance en faveur de la stimulation bi-V chez les patients avec une FEVG < 50 % laissant espérer un bénéfice à long terme, mais aucune tendance lorsque la FEVG à l’inclusion est normale.
En pratique quels paramètres prendre en considération ?
Avant l’intervention
Les patients qui ont une indication validée de stimulation bi-V, dysfonction VG plus trouble de conduction intraventriculaire, sont exclus de cette discussion, mais encore faudrait-il avoir ces paramètres en dehors d’un BAV complet. Si le patient arrive en BAV complet avec échappement ventriculaire, quelle valeur donner à l’éventuelle dysfonction VG et à la largeur du QRS ? Ces patients relèvent relèvent-ils tous d’une stimulation bi-V ? Il faut récupérer, si possible, une FEVG et un ECG antérieurs. Si la preuve d’une FEVG ≤ 35 % est établie, le risque d’une dégradation sous stimulation VD est fort probable. Entre 35 et 50 % de FEVG, la question reste ouverte.
En cours d’intervention
Des facteurs prédictifs de dysfonction VG, recueillis en peropératoire, ont été proposés (petites études méritant validation). La stratégie consiste à rechercher des critères prédictifs une fois la sonde VD mise en place. Que retenir ?
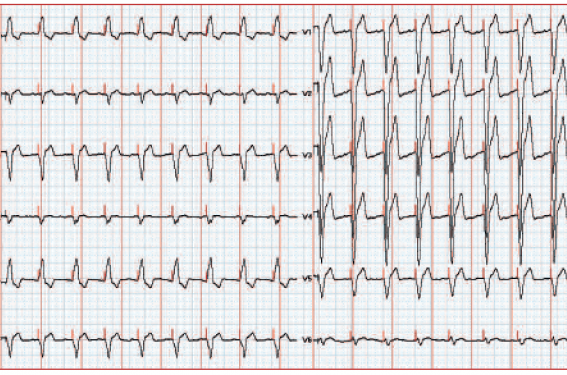
Regarder l’ECG 12 dérivations (figure 2) : largeur du QRS, son axe et sa morphologie, éventuellement la durée de l’intervalle QT. Un score prédictif a été proposé par Lee en 2014 : durée du QRS ≥ 150 ms (1 point), transition (1 point), crochetage (2 points), déviation axiale gauche (1 point). La probabilité d’induire un asynchronisme VG (échocardiographie per-opératoire) est de 3,4, 12,5, 22,6, 45, 57,9 et 72,7 % pour un score passant de 1 à 5 (p < 0,001).
Évaluer en temps réel l’asynchronisme mécanique induit, par la réalisation d’une échocardiographie peropératoire systématique.
À côté des contraintes techniques, cette stratégie repose sur le concept non validé que les données recueillies en aigu soient corrélées avec le devenir clinique à long terme.
De plus, cette approche repose sur le prérequis de pouvoir « basculer » dans le même temps opératoire vers une stimulation bi-V. Est-ce réaliste aujourd’hui alors que la majorité des implantations pour BAV est effectuée dans des centres « non autorisés » à la CRT par les agences régionales de santé (ARS) et par des opérateurs pas tous formés à la mise en place d’une sonde VG ?
Figure 2. Un score (restant à valider à large échelle) proposé pour prédire en peropératoire le risque de dysfonction VG ultérieure intègre comme facteur favorisant une durée des QRS > 150 ms sous stimulation.
Après l’intervention
C’est une autre stratégie qui peut conduire à un upgrade. Le but de la recherche au décours de l’implantation des critères d’asynchronisme n’est pas de proposer une ré-intervention sans délai, mais de proposer un suivi rapproché afin de reconsidérer l’ajout d’une sonde VG en fonction de l’évolution clinique. Mais, même en l’absence de données postopératoires péjoratives, le développement d’une insuffisance cardiaque est toujours possible, y compris à distance de l’implantation. Il faut savoir la détecter par un suivi adapté en ayant toujours un œil sur le taux de stimulation ventriculaire. Enfin, il ne faut pas oublier qu’un upgrade dans un second temps semble apporter le même bénéfice qu’une implantation de novo.
Conclusion
Identifier les patients à risque de développer une dysfonction VG cliniquement significative induite par la stimulation apicale VD reste un défi.
En présence d’une dysfonction ventriculaire gauche significative (FEVG < 35 %) et d’une histoire clinique d’insuffisance cardiaque témoignant d’une atteinte mécanique préexistante qui ne pourra que s’aggraver sous stimulation, et si le pourcentage de stimulation ventriculaire attendu est élevé, le choix d’une stimulation bi-V d’emblée paraît une option « raisonnable ». Pour les autres patients le rapport bénéfice/risque d’une stimulation bi-V d’emblée n’est pas évident et l’option d’un upgrade ultérieur, si besoin, n’est probablement pas une perte de chance sous réserve de savoir y penser à temps.
Prévoir le futur repose sur les données de la littérature, non seulement celles des études prospectives mais aussi celles des larges registres de la vraie vie, seules à même d’affiner les recommandations. Le débat reste ouvert…
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


