Chirurgie
Publié le 02 fév 2005Lecture 11 min
Techniques d'avenir en chirurgie cardiaque
T. FOLLIGUET et F. LABORDE, Institut mutualiste Montsouris, Paris

La chirurgie cardiaque a connu un essor fulgurant dans les deux dernières décennies et se pratique maintenant de manière courante avec des résultats fiables et reproductibles. Cependant, cette chirurgie reste physiologiquement agressive en raison de la taille de l’incision et de l’utilisation de la circulation extracorporelle. En suivant l’exemple de la chirurgie digestive et des autres qui sont maintenant pratiquées très fréquemment de manière totalement endoscopique, ce qui a permis de réduire la morbidité et la durée de séjour, la chirurgie cardiaque commence à adopter des techniques moins invasives.
Contrairement aux autres chirurgies dont la durée de l’intervention n’entraîne pas de conséquences graves, en chirurgie cardiaque le fait d’arrêter le cœur provoque une ischémie qui, malgré la protection du myocarde, conditionne le pronostic vital. L’utilisation de la circulation extracorporelle (CEC) avec sa cascade de possibles conséquences délétères liées à l’inflammation, ainsi que les risques hématologique, infectieux et neurologique ont largement contribué à freiner le développement des techniques chirurgicales endoscopiques ou peu invasives dans cette spécialité chirurgicale. C’est seulement au cours des toutes dernières années que sont apparues des innovations technologiques, portant à la fois sur les instruments chirurgicaux et sur la CEC, qui ont permis de pratiquer certaines opérations cardiaques par des méthodes vidéoscopiques.
Chirurgie coronaire
La chirurgie des artères coronaires connaît depuis quelques années des changements qui sont en partie liés à la technique chirurgicale mais également à la nouvelle génération de stents enrobés de substance active.
Quelques chiffres
La pathologie coronarienne a été responsable d’un peu plus de 298 000 hospitalisations en France métropolitaine en 2001, dont 126 700 pour angine de poitrine et 92 800 pour infarctus ou ischémie aiguë du myocarde. Cela correspond à 22 % des hospitalisations pour maladies cardio-vasculaires et à 2 % des hospitalisations. En 2001, environ un tiers des séjours pour maladie coronarienne ont été motivés par les traitements invasifs des sténoses coronaires. Le nombre de séjours pour traitement des artères coronaires est ainsi passé de 52 400 en 1993 à 116 600 en 2001. C’est le développement des traitements par voie percutanée qui en est responsable, puisque le taux de recours à ce mode d’intervention a pratiquement triplé durant cette période, passant de 53 à 157 pour 100 000 personnes. Au contraire, le taux de recours aux interventions chirurgicales a peu varié durant la même période, passant de 37 à 41 pour 100 000 en 1993 et 2001 respectivement.
En 1993, les séjours se répartissaient en 40 % de séjours avec intervention chirurgicale et 60 % de séjours avec traitements percutanés, tandis qu’en 2001 le traitement par voie percutanée des sténoses coronaires représente désormais 80 % des séjours.
Évolution des techniques de pontage
Si le nombre de pontages pratiqués a tendance à se stabiliser, leur mode de réalisation a changé :
• en 1993, 71 % des interventions n’utilisaient que les pontages veineux, les autres utilisaient les artères mammaires internes seules ou associées à des pontages veineux en proportions voisines ;
• en 2001, 13 % des pontages sont des pontages veineux isolés et 22 % uniquement des pontages mammaires tandis que les associations de pontages mammaires internes et de pontages veineux représentent 49 % des interventions. La meilleure perméabilité des pontages mammaires explique que cette technique soit actuellement préférentiellement choisie.
L’âge moyen des patients concernés en 2001 par un traitement invasif de sténose coronaire est de 64,6 ans, soit 1,9 an de plus qu’en 1993. L’augmentation de l’âge moyen des patients a été lente et régulière. Le traitement chirurgical concerne des patients qui ont, en moyenne, 17 mois de plus que ceux qui sont traités par voie percutanée.
Tous ces facteurs ont modifié la prise en charge des patients coronariens dits chirurgicaux, allant de la chirurgie coronaire réalisée par sternotomie avec ou sans CEC, à la chirurgie dite « mini-invasive » réalisée au travers des thoracotomies réduites ou de façon totalement thoracoscopique. Ces diverses techniques chirurgicales peuvent être associées à un geste d’angioplastie, on parle alors de « procédures hybrides ». Le but actuel de cette méthode, qui s’adresse à des patients de plus en plus graves et fragiles, est de pouvoir effectuer une revascularisation la plus complète possible avec une morbi-mortalité réduite et un taux de resténoses le plus faible possible.
Revascularisation sous CEC
Actuellement, la revascularisation chirurgicale complète sous CEC à cœur arrêté reste la technique de choix chez les patients à risque opératoire faible pouvant avoir une CEC et un clampage de l’aorte.
- En effet, les progrès de l’anesthésie et de la réanimation ont permis de chiffrer la mortalité opératoire à 1 % chez ces patients à faible risque.
- Cependant, chez les patients à fonction ventriculaire très altérée (< 30 %), la mortalité n’est pas négligeable et passe à près de 10 %, de même que la morbidité périopératoire : essentiellement faite de bas débit postopératoire (23 % dans certaines études), nécessitant la mise sous assistance circulatoire (ballon de contrepulsion ou assistance ventriculaire).
- Enfin, chez ces patients, la cardioplégie utilisée pour le temps de protection myocardique est aussi responsable de bas débit circulatoire et la CEC est responsable de possibles altérations des différents organes vitaux.
Les facteurs aggravant les conséquences de l’emploi d’une CEC sont essentiellement : les troubles graves et chroniques de l’hémostase, les leucémies lymphoïdes actives, l’insuffisance respiratoire sévère, l’angiome cérébral, l’accident vasculaire cérébral récent, l’insuffisance hépatique grave en attente de transplantation, l’hémodialyse chronique ou un âge avancé. Enfin, en cas de calcifications aortiques importantes, le clampage aortique est à éviter en raison du risque d’embols calcaires et de rupture aortique ; un geste de revascularisation sans CEC et sans clampage aortique est alors préférable.
Revascularisation à cœur battant
- Pour diminuer ces complications, certains ont proposé d’effectuer une revascularisation myocardique à cœur battant. Cette technique s’est révélée efficace pour les lésions mono- ou bitronculaires, et notamment chez les patients à mauvaise fraction d’éjection ou à risque opératoire élevé ; d’autres ont étendu cette méthode de revascularisation à tous les territoires.
- Cependant, la chirurgie coronaire sans CEC présente des aléas techniques non négligeables. Pour des raisons essentiellement techniques, cette chirurgie permet de revasculariser les branches antérieures du ventricule gauche (IVA, diagonales) et du ventricule droit (coronaire droite). En effet, la luxation cardiaque produit une instabilité hémodynamique qui rend la revascularisation par sternotomie des territoires latéraux (marginales distales) et inférieur (interventriculaire postérieure) plus difficile.
- Enfin, chez certains patients âgés avec des calcifications mitrales et aortiques importantes, une luxation cardiaque peut provoquer des lésions traumatiques cardiaques, rendant dangereuse la revascularisation des territoires latéraux de la circonflexe par sterno-tomie. Dans ce cas, une approche par thoracotomie gauche est possible et permet de revasculariser les branches de la circonflexe, les artères diagonales et l’interventriculaire antérieure, mais pas le territoire de la coronaire droite.
Procédures hybrides
Sous le terme de « procédures hybrides », nous parlons des patients chez lesquels une revascularisation par angioplastie est combinée à un geste chirurgical.
Pour la revascularisation coronaire hybride concernant les patients qui, de manière prospective, ont un pontage coronaire précédé ou suivi d’une angioplastie sur d’autres sites coronaires, la revascularisation chirurgicale complète peut se faire avec circulation extracorporelle (CEC) ou sans CEC.
La chronologie de la méthode hybride est encore discutée :
• la plupart des équipes préfèrent réaliser l’intervention chirurgicale en premier, suivie dans un deuxième temps du contrôle angiographique du pontage et simultanément du geste d’angioplastie. Le délai entre ces deux gestes reste à définir, mais peut être extrêmement court ;
• d’autres pratiquent l’inverse, en dilatant l’artère responsable du syndrome coronarien aigu et après un délai d’un mois, le pontage coronaire, en raison du traitement antiagrégant qui doit être arrêté au moins 5 jours avant la chirurgie. Cette séquence ne permet pas une revascularisation complète rapide.
Résultats.
Si l’on analyse les résultats des quelques études publiées ainsi que notre expérience personnelle, elles incluent toutes un faible nombre de patients. Les résultats immédiats sont en général excellents avec une mortalité et une morbidité opératoires très faibles, mais à distance, on note un taux de l’ordre de 25 % de nouvelles angioplasties liées à des resténoses coronaires.
Enfin, bien que le coût initial soit moindre que celui d’une revascularisation chirurgicale complète, il devient équivalent au bout de 6 mois en raison des angioplasties itératives.
Dans notre centre, 18 patients ont eu une revascularisation hybride avec une revascularisation chirurgicale première sur une artère suivie d’une angioplastie ultérieure sur une autre artère. Ce choix s’adresse à des patients multitronculaires chez lesquels une chirurgie réalisée avec CEC présente un risque opératoire élevé.
Une chirurgie robot assistée
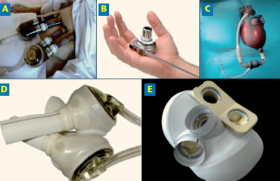
La technique de pontage sera réalisée dans la majorité des cas par sternotomie médiane avec la mise en place d’une ou de deux artères mammaires ou de greffons veineux. S’il faut revasculariser isolément le territoire circonflexe, l’intervention sera effectuée par thoracotomie gauche (figure 1).
Figure 1. Robot da Vinci.
Actuellement, la dissection des artères mammaires et la réalisation de l’anastomose coronaire peuvent être réalisées par voie totalement endoscopique à l’aide du robot da Vinci. Ce robot est constitué d’une console couplant la vision en 3 dimensions à deux poignets introduits par voie thoracoscopique dans deux trocarts de 5 mm. La caméra est introduite également par un trocart de 12 mm et un stabilisateur endoscopique est placé par voie sous-xiphoïdienne. L’intervention est donc réalisée au travers de quatre thoracostomies.
Afin de mieux choisir les différents placements des thoracostomies, il est important de réaliser un scanner cardiaque spiralé. Ce scanner permet de visualiser l’endroit de l’anastomose par rapport au grill costal, de préciser le caractère intramyocardique de l’artère à ponter et la qualité du lit d’aval qui est souvent sous-perfusé à la coronarographie. Enfin, il permet de préciser s’il existe des contre-indications d’ordre thoracique à cette chirurgie endoscopique (déformations thoraciques, maladies parenchymateuses pulmonaires).
Expérience de l’IMM
Nous avons ainsi pu réaliser, chez 11 patients, un monopontage mammaire interne gauche interventriculaire antérieure par voie endoscopique. Tous les pontages ont été faits sans circulation extracorporelle à cœur battant. Les patients présentaient une sténose ou une occlusion isolée de l’IVA ; cinq patients avaient également des sténoses associées sur d’autres artères. Pour ce dernier groupe, une revascularisation combinée chirurgicale sur l’IVA puis par angioplastie sur les autres sites a été planifiée. L’âge moyen était de 66,4 ± 12,6 ans. Chez cinq autres patients un prélèvement par méthode vidéoscopique de l’artère mammaire interne gauche ou droite a été pratiqué, suivi de la confection du pontage au travers d’une mini-incision antérolatérale gauche ou droite. Ces patients avaient tous une artère coronaire avec un trajet intramyocardique qui rendait l’identification de l’artère par voie endoscopique difficile.
Enfin, le surcoût lié à une intervention coronaire assistée par robot est, dans notre institution, de 2 700 euros par patient. Cependant, après une chirurgie endoscopique, la plupart des patients partent directement à domicile sans avoir besoin de rééducation cardiaque contrairement à la sternotomie ; de plus, le délai de reprise de la vie active est de quelques semaines puisque l’inconfort est moindre. Ce surcoût hospitalier initial devrait tenir compte de la diminution globale d’hospitalisation et donc réduire le coût total de la prise en charge comparativement à un patient ayant une revascularisation par sternotomie.
Chirurgie valvulaire assistée par vidéoscopie ou robotique
La chirurgie valvulaire peut, elle aussi, être pratiquée par des incisions autres que la sternotomie, dans le but de diminuer la morbidité liée à l’incision. Cette chirurgie est techniquement réalisable grâce à la technique de CEC, qui devient percutanée, et à l’utilisation d’instruments chirurgicaux adaptés, qui sont endoscopiques. Cet abord nécessite une ventilation bronchique sélective permettant d’exclure le poumon droit avant le démarrage de la CEC.
La technique
La CEC est établie de manière percutanée (technique de Seldinger) entre l’artère fémorale, la veine fémorale pour le drainage cave inférieure et la veine jugulaire droite pour le drainage cave supérieure. Le drainage veineux est optimisé par une aspiration sur les canules veineuses qui permet d’assurer le débit théorique calculé en fonction de la surface corporelle du patient.
Le clampage aortique est effectué grâce à un endoclamp placé par voie endoscopique sous l’aisselle gauche ; la cardioplégie est réalisée de manière conventionnelle par l’aorte ascendante.
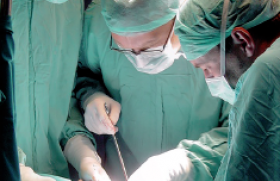
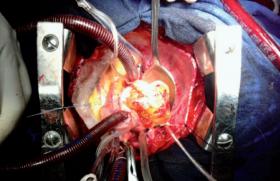
La technique opératoire repose sur un abord de la valve à réparer ou à changer par une minithoracotomie droite de 5 à 6 cm sur la ligne axillaire antérieure. Cet orifice permet d’introduire la caméra qui permet une vision en 3D et de faire passer des instruments endoscopiques ainsi que la prothèse valvulaire. Deux autres orifices de 5 mm sont réalisés dans lesquels sont placés des trocarts afin d’introduire également des instruments endoscopiques. Le geste valvulaire est alors réalisé selon les mêmes principes chirurgicaux en utilisant les instruments endoscopiques et sous vision endoscopique (figures 2, 3 et 4). L’introduction des instruments endoscopiques reliés au télémanipulateur permet d’obtenir 7 degrés de liberté, ce qui rend la réparation valvulaire ou la mise en place de la valve plus aisée que par méthode vidéoscopique seule, qui ne permet pas d’obtenir ces mêmes degrés de libertés.
Figures 2, 3 et 4. Présentation des instruments.
Les résultats
L’expérience rapportée de ces techniques, soit vidéo assistée soit robotique assistée, est encore très limitée.
- Les équipes allemandes sont pionnières et ont rapporté 17 cas d’insuffisance mitrale traités par une technique robotique assistée avec un taux d’échecs de 2 %.
- Une équipe américaine possède une expérience plus importante de plus de 100 cas avec des résultats cliniques satisfaisants et une durée de séjour diminuée par rapport à une chirurgie conventionnelle.
- Enfin, une équipe belge rapporte la plus grande série, sur plus de 400 patients, de réparation mitrale vidéo assistée avec également des résultats encourageants.
Dans toutes ces études, le temps opératoire est plus long et la CEC également plus longue comparativement à une chirurgie réalisée par sternotomie. Cela est lié à la courbe d’apprentissage de l’opérateur et de l’équipe, mais également à la plus grande complexité de la procédure en raison de l’introduction de la vidéoscopie et du robot.
La mortalité dans ces études a été de 0,8 à 1,7 % dans le groupe des réparations mitrales et des remplacements, ce qui se compare favorablement aux résultats du registre américain de la Société de chirurgie cardio-thoracique, qui sont de 2,2 et de 6,6 %.
Cependant les patients proposés à une chirurgie mini-invasive sont extrêmement sélectionnés ; il s’agit en général de patients jeunes, sans morbidité associée ; la chirurgie se limite à un geste de réparation valvulaire simple.
L’avantage évident est la diminution de la douleur postopératoire et un retour à domicile et à une vie fonctionnelle plus rapide (figure 5). Les complications sont essentiellement liées à la phase d’apprentissage avec un retour au bloc opératoire pour hémostase qui varie, suivant les équipes, de 3 à 10 %.
Figure 5. Thorax après l’intervention.
- Dans notre expérience, nous avons pu réaliser, par des voies d’abord réduites (5 cm) et à l’aide du robot, plusieurs opérations de réparation valvulaire mitrale, de remplacement de la valve aortique et de fermeture d’une communication interauriculaire. Notre expérience est encore limitée et il est difficile d’en tirer des conclusions hâtives. Cependant, nous avons pu observer une très nette diminution de la morbidité pariétale et un retour à une mobilité complète beaucoup plus rapide comparativement à une chirurgie conventionnelle. Bien évidemment, cette technique s’adresse à des patients sélectionnés et ne peut être réalisée à l’heure actuelle qu’au prix d’une durée opératoire plus longue.
Conclusion
Les techniques que nous avons décrites — vidéo assistée, robotique assistée et hybrides — doivent trouver leur place dans l’arsenal thérapeutique proposé aux patients. Elles s’intègrent, comme nous l’avons vu, avec l’essor de l’angioplastie, dans une évolution naturelle qui tend à diminuer la morbidité de la chirurgie et la durée d’hospitalisation, même si leur coût actuel reste supérieur à celui des techniques conventionnelles. Leur rationnel doit être validé par des études prospectives comparatives multicentriques.
Une bibliographie sera adressée aux abonnés sur demande au journal.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :