Échocardiographie
Publié le 18 mai 2010Lecture 7 min
L'échocardiographie transthoracique dans les AVC ischémiques après 75 ans
P. AMBROSI, Hôpital de la Timone, Marseille
Les recommandations pour le bilan échocardiographique après AVC ischémique sont floues et reflètent l’absence de consensus. Par exemple, pour les recommandations européennes (ESO), « Il existe une controverse pour les indications et le type d’échocardiographie à réaliser chez les patients ayant présenté un AIT ou un AVC… L’échocardiographie est recommandée chez des patients sélectionnés ».
La situation est encore moins nette chez les sujets très âgés. Pour cette classe d’âge, on manque d’évaluations de l’intérêt de l’échocardiographie. Pourtant, l’AVC ischémique n’est pas une rareté après 75 ans. C’est même la forme la plus fréquente. Dans la cohorte de Framingham, la moyenne d’âge dans les AVC ischémiques est de 75 ans pour l’homme et de 81 ans pour la femme (Petrea, Stroke 2009) ! Or l’AVC du sujet très âgé pose des problèmes spécifiques.
Les causes d’AVC ischémique varient avec l’âge
Chez le sujet jeune (< 45 ans), aucune cause ne domine franchement l’étiologie de l’AVC ischémique. La part de l’athérosclérose est modeste (tableau 1).
Chez le sujet âgé, l’hypertension artérielle, la fibrillation auriculaire et l’athérosclérose sont de loin les causes principales d’AVC ischémique. Ce qui n’exclut pas la possibilité des causes diverses rencontrées chez le sujet plus jeune, mais leur part relative est beaucoup plus faible.
L’AVC lacunaire est la forme la plus fréquente. Elle représente 42 % des patients dans la série de Rojas et col. chez des sujets de plus de 80 ans (Eur J Neurol 2007). Dans la très grande majorité des cas, l’AVC lacunaire est l’expression d’une artériolopathie liée à l’HTA. Très rarement, il est de nature embolique. Certaines causes sont spécifiques au sujet âgé.
Le rétrécissement aortique calcifié peut être rarement le point de départ d’embolies calcaires. Les calcifications de l’anneau mitral peuvent, surtout lorsqu’elles sont importantes ou anfractueuses, être le point de départ d’embolies à destinée cérébrale par trois mécanismes : thrombus sur la calcification, endocardite, migration de fragment calcaire. Exceptionnellement, le scanner cérébral montre une embolie calcaire permettant d’évoquer ce dernier mécanisme. Cependant, les calcifications de l’anneau mitral sont plus un marqueur du risque embolique qu’une véritable cause. Elles sont associées non seulement à l’âge, mais aussi à l’athérosclérose aortique et carotidienne et à la fibrillation auriculaire (en particulier parce qu’elles provoquent des insuffisances mitrales). C’est ce qui explique que dans la cohorte de Framingham, la présence de telles calcifications de l’anneau mitral double le risque d’AVC ischémique en analyse multivariée.
Les calcifications de l’aorte ascendante posent un problème similaire. Leur fréquence croît avec l’âge et elles sont associées aux autres localisations de l’athérosclérose. Leur rôle causal est cependant vraisemblable dans une petite fraction des cas, surtout lorsqu’elles sont très proéminentes dans la lumière aortique (> 4 mm) ou ulcérées ou associées à un thrombus.
L’échocardiographie transthoracique (ETT) chez le sujet âgé
Elle détecte souvent des anomalies cardiaques potentiellement emboligènes.
Dans notre série de patients âgés en moyenne de 84 ans explorés par ETT dans les suites d’un AVC ischémique, les anomalies potentiellement emboligènes les plus fréquentes étaient la dilatation de l’oreillette gauche (40 % des patients), des troubles de la cinétique (23 %), des calcifications de l’anneau mitral (13 %) et le rétrécissement aortique (8 %).
La série de Tribolet de Abreu (Stroke 2005), portant sur une population plus jeune (âge moyen = 74 ans) montre également la présence fréquente d’anomalies potentiellement emboligènes à l’ETT : cardiopathie dilatée (19 %), FEVG < 35 % (4 %), dyskinésie antérieure (6 %), rétrécissement mitral (2 %), association de plusieurs de ces anomalies (6 %).
Dans la grande majorité des cas la cardiopathie était connue avant la réalisation de l’échocardiographie post-AVC : notion d’infarctus du myocarde, de valvulopathie, d’insuffisance cardiaque etc. Parfois, elle n’était que suspectée sur la clinique, l’ECG ou la radiographie du thorax. L’échocardiographie apporte alors la confirmation du diagnostic. Beaucoup plus rarement l’ETT permet de découvrir réellement une cardiopathie emboligène : rétrécissement mitral, dyskinésie, anévrisme du septum interauriculaire, endocardite, etc.
L’ETT permet parfois de découvrir une endocardite
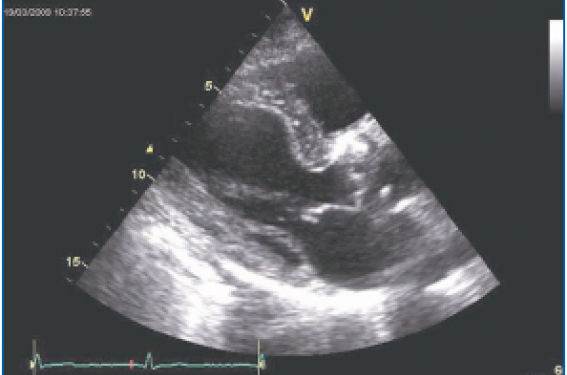
Dans la série de Thuny et col (Circulation 2005), sur 384 endocardites, 62 comportaient une embolie cérébrale, qui pouvait être parfois le mode de présentation initiale (figure 1). Cependant, l’ETT manque de sensibilité pour le diagnostic des végétations. Dans la série de Roudaut et col, l’ETT manquait d’identifier la moitié des végétations de taille inférieure à 4 mm.
Figure 1. Accident vasculaire cérébral ischémique révélant une endocardite. L’ETT a permis de découvrir une végétation sur le versant aortique de la valve aortique (incidence parasternale grand axe).
L’ETT, très rarement une indication formelle pour le traitement anticoagulant
L’exploration des AVC ischémiques du sujet de plus de 75 ans n’est légitime que si elle modifie la prise en charge. Dans quels cas l’ETT fait-elle choisir un traitement anticoagulant plutôt qu’antiagrégant ?
Si le patient est en fibrillation auriculaire ou a des antécédents de fibrillation auriculaire, le résultat de l’échocardiographie ne modifiera pas le choix de l’antithrombotique. Il en va de même si le patient présente une contre-indication aux anticoagulants.
La découverte à l’ETT d’une dyskinésie ou d’une akinésie ventriculaire gauche, d’un anévrisme du septum interauriculaire, d’une dilatation des cavités gauches, de calcifications de l’anneau mitral ou de la valve aortique, ne suffit pas à modifier le choix de l’antithrombotique. En effet, l’association d’une de ces cardiopathies à un AVC ischémique n’est pas une indication formelle du traitement anticoagulant sauf si un thrombus est découvert (tableau 2).
Or il est très rare que l’ETT montre un thrombus intracavitaire dans les suites d’un AVC ischémique.
Par exemple dans la série déjà citée de 853 patients ayant présenté un AVC ischémique, l’ETT n’a permis de découvrir une masse intracardiaque que chez seulement 2 patients. Ces masses intracardiaques peuvent être caillots auriculaires ou intraventriculaires gauches ou de tumeurs.
La connaissance de la fonction ventriculaire gauche
Elle est souvent utile après un AVC ischémique chez le sujet très âgé.
Toutes les recommandations sont d’accord pour indiquer une perfusion de sérum physiologique à la phase initiale de l’AVC ischémique, sans préciser quand il est possible de la remplacer par du glucosé. Le niveau de preuve est cependant faible. Le principal argument en faveur du sérum physiologique plutôt que du glucosé est que l’hyperglycémie aggrave les lésions ischémiques cérébrales dans les modèles animaux et est associée à un plus mauvais pronostic après AVC chez l’homme. Une interprétation commune et probablement abusive de cette recommandation aboutit à la perfusion de sérum physiologique pendant de nombreux jours après l’AVC. De plus, si le sujet ne reprend pas rapidement une alimentation par voie orale, les volumes perfusés sont parfois importants. La perfusion peut être associée ou relayée par une alimentation par sonde nasogatrique qui apporte elle aussi de l’eau et des électrolytes. Il existe donc un risque de surcharge hydrosodée.
La fonction ventriculaire gauche du sujet très âgé après un AVC ischémique
Elle est très souvent altérée. Dans un travail récent portant sur une population d’âge moyen égal à 84 ans nous avons apprécié une semaine après l’AVC la fonction systolique et diastolique. Cette évaluation comprenait la mesure des vélocités de l’onde mitrale et du doppler tissulaire de l’anneau mitral dans sa partie septale (E/Ea) (Ambrosi, Int J Cardiol 2008). Une dysfonction ventriculaire gauche systolique était présente dans environ 1/4 des cas. Parmi les patients avec fonction systolique préservée, aucun n’avait une fonction diastolique normale : 64 % avait un profil transmitral de trouble de la relaxation (dont les 2/3 avec E/Ea >10) et 36 % un profil évocateur de pressions de remplissage élevées au repos. L’âge ne suffisait pas à expliquer ces anomalies puisque dans le groupe de 34 témoins de même âge moyen, hospitalisé pour des raisons non cardiovasculaires, seulement 3 avaient un profil pseudonormal évocateur d’une élévation des pressions de remplissage.
La dysfonction systolique, la dysfonction diastolique et la fibrillation auriculaire expliquent donc en grande partie les valeurs élevées de BNP mesurées après un AVC ischémique chez le sujet très âgé (figure 2). Il faut y ajouter l’insuffisance rénale et l’hypercatécholaminergie initiale.
On peut en tirer deux conséquences pratiques :
1) éviter de perfuser des volumes importants chez les patients très âgés après un AVC ischémique,
2) lorsque le patient ne reprend pas vite l’alimentation par voie orale, adapter les quantités d’eau et de sel en fonction du résultat de l’ETT.
Figure 2. Log (NT-proBNP) une semaine après AVC ischémique selon la fonction ventriculaire gauche chez des sujets très âgés. Les valeurs médianes de NT-proBNP étaient 489 pg/ml en cas d’anomalie de la relaxation isolée, 1932 pg/ml en cas de dysfonction diastolique isolée moyenne à sévère et 2 697 pg/ml en cas de dysfonction systolique.
L’ETT doit-elle être complétée par une ETO après 75 ans ?
Les pratiques varient beaucoup d’un centre à un autre. Certains prescrivent toujours une ETO, d’autres exceptionnellement après un AVC ischémique du sujet âgé. Elle est indispensable pour le diagnostic des plaques de l’aorte ascendante ou d’un foramen ovale perméable mais leur découverte ne modifie pas habituellement le traitement (tableau 2). Elle est parfois irremplaçable pour certains diagnostics « utiles » comme celui de végétation de petite taille ou de caillot de l’auricule gauche ou de caillot sur calcification mitrale. Son rendement chez le sujet très âgé n’est cependant pas bien connu.
Quand l’ETO est-elle réellement utile à l’issue d’un bilan conventionnel comprenant un holter ECG et une ETT, après 75 ans ? Il n’y a pas de données suffisantes dans la littérature pour répondre à cette question.
Une série de 20643 ETO pratiquées dans diverses situations a permis de retrouver un caillot dans l’oreillette gauche chez seulement 15 patients sans antécédent de fibrillation auriculaire (Agmon, Circulation 2002). Ces 15 patients avaient tous soit une dysfonction systolique ventriculaire gauche soit une valvulopathie significative. Il semble donc logique a priori de prévoir l’ETO chez les patients présentant une cardiopathie susceptible de se compliquer de thrombus ou de végétation, sous réserve que le résultat de l’ETO puisse modifier l’attitude thérapeutique. A contrario, son intérêt est très modeste chez un patient en fibrillation auriculaire ou chez un patient présentant un AVC lacunaire.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :