Publié le 17 avr 2007Lecture 8 min
Cardiomyopathie hypertrophique : actualités sur la thérapeutique percutanée
P. CHARRON et R. CHOUSSAT, CHU Pitié-Salpêtrière, Paris
Décrit en 1995 par U. Sigwart, le traitement de la cardiomyopathie hypertrophique (CMH) obstructive par une technique de cathétérisme interventionnel constitue désormais une alternative à l’intervention chirurgicale de myomectomie de Morrow, chez le patient très symptomatique malgré un traitement pharmacologique bien conduit. Plusieurs travaux récents ont permis d’en préciser à la fois les indications et la procédure technique.
Principe de l’alcoolisation coronaire dans la CMH obstructive
Le principe de cette réduction septale non chirurgicale est de cathétériser sélectivement l’artère coronaire responsable de la perfusion de la région septale impliquée dans la production du gradient intraventriculaire gauche (habituellement le septum sous-aortique), puis d’injecter de l’éthanol à environ 95 % de façon à provoquer un infarctus de cette zone (CPK entre 400 et 1 500) (figure 1). Il en résulte une réduction majeure du gradient de pression intraventriculaire gauche qui est associée à une amélioration significative des symptômes du patient. Le remodelage ventriculaire gauche se poursuit pendant les semaines ou les mois qui suivent, avec un amincissement de la paroi septale, une augmentation de la surface de la chambre de chasse, une discrète diminution de la fraction d’éjection (< 5 % en règle).
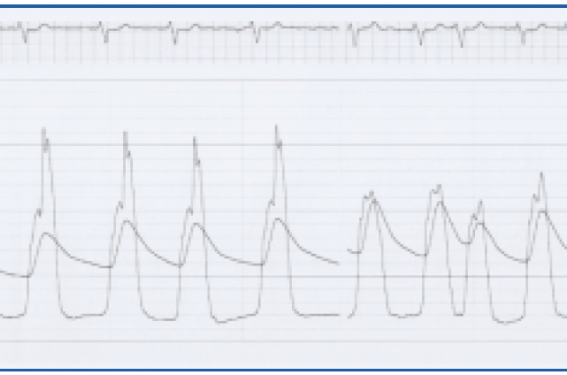
Figure 1. Courbe hémodynamique, avec réduction immédiate du gradient intra-VG obtenue en perprocédure. Ce résultat a été possible grâce à l’optimisation du choix de l’artère cible par écho de contraste.
Efficacité de la technique
La procédure a été maintenant pratiquée sur plus de 3 000 pa-tients dans le monde. Elle permet une réduction importante du gradient intra-VG, aussi bien au repos (pic à 65 mmHg avant procédure puis à 16 mmHg après) qu’après provocation (après extrastimulus, par exemple).
Les symptômes sont nettement diminués avec un stade NYHA qui baisse de plus d’une classe fonctionnelle (passant de 3,1 à 1,6 en moyenne dans l’une des principales études) mais environ 12 % des patients restent à un stade III ou IV.
L’amélioration est également hémodynamique : le cathétérisme réalisé au décours permet de constater une amélioration du débit cardiaque et des pressions pulmonaires à l’effort. Sur l’échographie, la fonction diastolique de repos est améliorée, notamment les pressions de remplissage et la relaxation. Enfin, la capacité d’effort est significativement augmentée (+ 33 %) au cours des 6 premiers mois de suivi (durée d’effort et consommation maximale d’oxygène). Les bénéfices observés à court terme (3 à 6 mois) persistent à moyen terme (suivi d’environ 3 ans) pour les premières cohortes de patients (avec ici des effectifs très inférieurs à 100 patients).
Réduire le risque de BAV et mieux le prévenir
Le bloc auriculoventriculaire (BAV) complet constituait l’incident le plus fréquemment observé dans les premières séries de patients avec un taux qui pouvait atteindre 50 % en perprocédure puis persistait dans environ 30 % des cas à 48 h et 12 % à 2 semaines. Dans quelques cas, le BAV survenait secondairement, au décours de la procédure (pendant la première semaine) justifiant, à côté du risque d’arythmie ventriculaire, une surveillance sous scope pendant cette période. Dans les premières séries, un pacemaker était finalement implanté chez 20 à 35 % des patients ayant été alcoolisés.
Deux études se sont attachées à rechercher des facteurs prédictifs de BAV complet.
Elles ont permis de constater que la durée du QRS avant procédure est étroitement associée à la survenue d’un BAV complet, et que la présence d’un bloc de branche gauche en préprocédure conduit à l’implantation d’un pacemaker dans 50 % des cas (alors que la constatation d’un bloc de branche droit n’est pas un facteur prédictif). De plus, un score prenant en compte divers paramètres obtenus en pré- et postprocédure immédiate ont permis d’affiner la prédiction.
La prise en compte de ces éléments permet de moduler la durée de la surveillance postopératoire et la décision d’implantation. Conjointement aux améliorations de la procédure elle-même (échographie de contraste, quantité d’éthanol), cela a permis une diminution notable du taux d’implantation de pacemaker (< 10 %) au sein des équipes les plus expérimentées.
Améliorer la procédure
Doser l’éthanol
Différentes doses d’éthanol ont été injectées lors des procédures (entre 1,5 et 5 ml). La dose d’éthanol est étroitement corrélée au taux de CPK et à l’importance de la zone nécrosée, mais elle semble peu ou pas corrélée à l’efficacité de la procédure (appréciée notamment sur la réduction de gradient obtenue), ce qui conduit la plupart des équipes à utiliser désormais des doses plus faibles d’éthanol (entre 1,5 et 2,5 ml).
Avant l’injection d’éthanol, une étape cruciale réside dans la sélection de l’artère coronaire. L’une des méthodes consiste à réaliser l’inflation du ballon mis en place dans l’artère cible (habituellement la première artère septale) pour créer un test d’ischémie par occlusion transitoire. Il est positif en cas de réduction immédiate du gradient intra-VG. Cette méthode est utilisée avec succès par l’une des équipes allemandes qui a le plus d’expérience en la matière.
Échographie de contraste
Une méthode alternative, ou complémentaire, par échographie de contraste s’est développée au fil du temps et est maintenant adoptée par la majorité des centres. Il s’agit d’injecter du produit de contraste (Levovist® le plus souvent) par voie intracoronaire (dans l’artère sélectionnée) et de visualiser par échographie la région myocardique opacifiée (figure 2).
Le premier intérêt est de pouvoir vérifier directement l’adéquation entre la zone myocardique concernée et la zone adjacente d’accélération maximale du flux intra-VG (l’injection d’éthanol est récusée en cas de « mismatch »).
Le deuxième intérêt est de pouvoir vérifier que la zone perfusée reste limitée et que la nécrose sera donc elle-même limitée (l’injection est récusée si l’opacification déborde le septum basal, avec opacification concomitante des muscles papillaires ou de la paroi libre du ventricule droit, par exemple).
Dans une série de 337 patients, cela a conduit dans 11 % des cas à modifier le choix de l’artère cible (dans 3 % des cas, l’artère finalement retenue était issue de l’artère coronaire droite), et dans 6 % supplémentaires l’injection d’éthanol n’a pas pu être réalisée car les critères de sélection n’avaient pu être réunis.
L’optimisation du choix de l’artère cible semble aboutir à une plus grande efficacité de la procédure (taux de succès primaire de 92 vs 70 % dans une série) ; elle aboutit probablement aussi à une morbidité moindre.
Figure 2. Échographie d’une patiente de 74 ans avec CMH obstructive en préprocédure (A et B) puis échographie de contraste en perprocédure (C) puis résultat obtenu en postprocédure (D), au CHU Pitié-Salpêtrière.
Des indications élargies ou précisées
Classiquement, l’alcoolisation est proposée chez un patient très symptomatique (classe NYHA III ou IV) malgré un traitement pharmacologique optimal et en présence d’un gradient de pression intra-VG > 50 mmHg au repos.
Gradient présent après provocation.
Chez un certain nombre de patients symptomatiques, le gradient est absent au repos mais présent après provocation (échographie d’effort ou extrastimulus, par exemple). Divers patients dans cette situation ont fait l’objet d’une alcoolisation septale et le bénéfice semble strictement superposable à celui obtenu dans l’indication conventionnelle.
Dans un travail allemand, une série de 45 patients avec gradient présent uniquement après provocation (> 30 mmHg par extrastimulus) a été comparée à une série de 84 patients avec gradient présent au repos. Le bénéfice était identique en termes de réduction de gradient, et d’amélioration des symptômes et de la consommation d’oxygène. On note que les seuils de gradient retenus pour poser l’indication sont variables selon les équipes et que le seuil de 100 mmHg pour un gradient uniquement provoqué est préféré par l’équipe suisse qui a décrit la méthode.
L’âge des patients.
La faisabilité et l’efficacité de la procédure ont été également étudiées selon l’âge des patients. Le bénéfice obtenu dans une cohorte de patients de plus de 60 ans s’est révélé identique à celui obtenu chez des malades de moins de 60 ans, même si le taux de BAV persistant était plus important (17 vs 5 %) ; la fraction d’éjection VG était davantage abaissée en post-procédure. En revanche, la technique n’est qu’exceptionnellement proposée chez les mineurs du fait des incertitudes qui existent sur le long terme.
Patients en stade II de la NYHA.
Enfin, la procédure est étendue par certains aux patients qui sont au stade II de la NYHA. Cependant, il n’y a pas d’étude spécifiquement ciblée sur cette population qui permette de valider cette indication. Surtout, la morbi-mortalité associée à la procédure ne permet pas de retenir l’indication, qui est uniquement fondée sur une plainte fonctionnelle. L’alcoolisation n’a pas pour objet, en l’état actuel des données, d’améliorer le pronostic des patients.
Alcoolisation percutanée ou chirurgie de myomectomie ?
Les résultats de la technique percutanée sont tels que la procédure est devenue l’alternative de choix à la chirurgie de myomectomie.
Pour certains auteurs, qui sont les promoteurs de la technique, elle est même devenue la nouvelle stratégie de référence chez ce type de patients.
La plus faible mortalité périprocédure de la technique percutanée (1 à 2 % vs 2 à 6 %) associée à un bénéfice comparable (réduction du gradient et classe NYHA) plaide en faveur de cette thèse. Il semble cependant que les paramètres objectifs de capacité fonctionnelle (consommation d’oxygène notamment) soient davantage améliorés par la chirurgie. Surtout, il n’y a aucune étude randomisée à notre disposition, et il est fort peu probable que de tels essais puissent se mettre en place dans le futur. Les spécificités du patient peuvent, en fait, amener à privilégier l’option chirurgicale (anomalies associées de l’appareil mitral, jeune âge du patient) ou l’alcoolisation (présence d’un gradient uniquement provoqué, comorbidité avec risque chirurgical).
Points forts
- La procédure d’alcoolisation vise à améliorer les symptômes du patient et non pas son pronostic.
- L’efficacité à moyen terme se confirme (réduction des gradients, amélioration du stade NYHA, de la durée d’effort).
- La procédure bénéficie clairement de l’échographie de contraste.
- Le risque de BAV complet et d’implantation de pacemaker diminue à moins de 10 %.
- La mortalité périprocédure n’est pas négligeable (1 à 2 %).
- Les indications s’étendent aux patients avec gradient absent au repos mais présent après provocation.
- L’évolution à long terme reste inconnue.
En conclusion
La technique percutanée d’alcoolisation coronaire confirme ses résultats à moyen terme et son intérêt chez le pa-tient très symptomatique avec obstruction intra-VG.
Elle devient, en pratique, l’alternative à la chirurgie de myomectomie et elle lui est préférée le plus souvent en première intention.
Elle ne semble pas associée à un risque proarythmogène ni à une évolution vers la dysfonction VG, mais le suivi prospectif à long terme manque encore et la prudence s’impose à cet égard.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :