Cardiologie interventionnelle
Publié le 03 avr 2012Lecture 11 min
Du nouveau avec les stents actifs en 2012 ?
G. CAYLA, L. SCHMUTZ, B. LEDERMANN, L. CORNILLET, J.-P. BERTINCHANT, P. MESSNER, CHU de Nîmes
Plus de 25 ans après la mise en place du premier stent coronaire par Jacques Puel, les endoprothèses coronaires ont connu un essor considérable. Des améliorations constantes tant sur le plan des stents eux même que sur l’environnement pharmacologique qui entoure leur implantation ont été observées.
L’arrivée en 2003 des premières endoprothèses actives a permis une diminution remarquable de la resténose en comparaison aux stents nus. L’amélioration permanente des endoprothèses avec l’apparition de stent actifs de nouvelle génération a permis d’accroitre leur efficacité et surtout de rassurer complètement la communauté médicale et scientifique sur les risques de thromboses de stent très tardives.
Une décennie après les premières études dans l’angioplastie coronaire, les endoprothèses actives représentent environ 60 % des endoprothèses implantées en France, avec une constante progression depuis 2006, date à laquelle des doutes sur la sécurité des stents actifs avaient été observés.
Le schéma ci-dessous résume l’évolution de l’angioplastie coronaire avec le premier stent nu en 1986 jusqu’à l’arrivée des stents actifs en 2003. Parallèlement sont indiqués les progrès du traitement antithrombotique (figure 1).
Figure 1. Evolution de l’angioplastie.
De quels éléments sont constitués les stents actifs ?
Le stent actif est constitué de 3 éléments : un stent métallique d’architecture variable, un polymère, un principe actif.
Les principes actifs utilisés
Les « limus »
Le sirolimus (anciennement rapamycine) : antibiotique de la classe des macrolides initialement développé pour son action immunosuppressive après transplantation rénale. Elle associe une action cytostatique (blocage du cycle cellulaire en phase G1 via le récepteur mTOR mammelian target of rapamycine) et anti-inflammatoire.
Le zotarolimus : il s’agit d’un analogue semi-synthétique de la rapamycine. Son action antiproliférative est très proche du sirolimus ; il bloque le récepteur mTOR entrainant une inhibition cellulaire en phase G1.
L’everolimus : antibiotique de la classe des macrolides, son action antiproliférative est, elle aussi, très proche du sirolimus. Il est par ailleurs utilisé comme agent anticancéreux dans le cancer du rein, du sein et les tumeurs neuroendocrines du pancréas.
Le biolimus A9 : lui aussi dérivé du sirolimus mais ayant des caractéristiques de lipophilicité importantes lui permettant d’être plus rapidement absorbé par la paroi artérielle.
Le paclitaxel
Il provient de certaines espèces d’if (du pacifique, le Taxus brevifolia mais aussi l’if européen Taxus baccata). Cette molécule était initialement utilisée comme agent chimiothérapique ; elle est toujours utilisée dans les cancers du poumon, du sein et de l’ovaire. Le paclitaxel est un poison du fuseau, qui bloque la division cellulaire en inhibant la dépolarisation des microtubules.
Les polymères
Les polymères permettent de délivrer le principe actif dans la paroi artérielle habituellement dans les 2 mois suivant l’implantation. De très nombreux polymères sont utilisés (phosphorylcholine, translute, copolymère fluoré, acide polylactique, etc.) ; certains d’entre eux comme l’acide polylactique sont biodégradables.
La plateforme
(tableau 1)
Les stents utilisés peuvent avoir une structure modulaire ou tubulaire et sont composés d’acier, d’association de chrome, de cobalt ou d’alliage de cobalt ou de platine. D’importantes améliorations ont été réalisées par les différentes firmes sur les plateformes utilisées avec notamment une réduction de l’épaisseur des mailles du stent (de 140 µm à 80 µm) associée à une meilleure tractabilité permettant ainsi l’accès à des lésions distales et tortueuses.
Quels sont les bénéfices et les limites des stents de première génération ?
Il s’agit du stent au sirolimus (Cypher) et au paclitaxel (Taxus Express). Les stents actifs de 1re génération se sont montrés très efficaces en comparaison aux stents nus pour lutter contre la resténose intrastent. Les résultats d’une des plus larges métaanalyses dans le domaine(1) portant sur 18 023 patients de 38 études sur les stents actifs avec un suivi de 4 ans, retrouvaient une diminution de 70 % (p < 0, 0001) du taux de revascularisation du vaisseau cible (TLR) pour le stent au sirolimus et 58 % (p < 0,0001) pour le stent au paclitaxel. Dans cette étude, aucun bénéfice n’était retrouvé concernant la mortalité avec ces endoprothèses.
La principale limite de ce type de prothèse est la thrombose de stent très tardive (ie survenant au-delà de 1 an après l’implantation). Les données issues des registres suisses, hollandais, suédois et japonais avec le Cypher retrouvaient un taux annuel de thromboses très tardive entre 0,36 % et 0,6 % par an et persistant même au delà de la 5e année(2,3). Les stents de première génération ne sont actuellement plus utilisés ; la société Cordis a d’ailleurs stoppé la commercialisation du stent Cypher fin 2011.
Endoprothèses de nouvelle génération : quels bénéfices ?
Le terme générique d’endoprothèse de nouvelle génération est le plus souvent utilisé pour désigner ces nouvelles endoprothèses. Il est en pratique assez difficile de distinguer dans cette nouvelle génération les stents de 2e, de 3e, voire de 4e génération.
Les endoprothèses de nouvelles générations utilisent majoritairement les dérivés du limus comme principe actif (évérolimus, zotarolimus) et ont profité de larges améliorations de leur plateforme (stent plus flexible et épaisseur de maille plus fine).
Les études expérimentales ont montré l’impact majeur de l’épaisseur de la maille du stent sur le risque de thrombose. Les modélisations informatiques confirment que l’utilisation de mailles fines s’accompagne d’une réduction des phénomènes de turbulence de flux pouvant être à l’origine des phénomènes thrombotiques (figure 2). Ces données ont été confirmées chez l’animal in ex vivo, avec une moindre thrombogénicité des mailles fines en comparaison aux mailles épaisses(4).
Figure 2. Modèle informatique représentant les modifications de flux autour d’une maille fine (81X 81 µm² en haut) et d’une maille épaisse (162x81 µm² en bas). Echelle de couleur fournie en cm/s. d’après(4).
D’importants progrès ont été aussi réalisés avec les polymères grâce à l’utilisation de polymères biocompatibles dont l’épaisseur a été réduite de 6 à 8 µm sur certains stents. Certaines endoprothèses comme les stents Biomatrix (Biosensor) ou Nobori (Térumo) utilisent des polymères biodégradables en 6 à 9 mois à base d’acide polylactique (PLLA) (figure 3) ou comme l’acide polylactique coglycoside (PLGA) pour le stent Synergy (Boston).
Figure 3. Métabolisme de l’acide L polylactique.
De très nombreuses études (tableau 2) ont comparé les endoprothèses de nouvelle génération aux stents actifs de première génération.
Une récente métaanalyse(5) comparant les stents actifs à l’évérolimus aux stents actifs sans évérolimus (essentiellement de 1re génération) portant sur 17 101 patients et 13 essais randomisés confirme ces données avec, d’une part, une diminution du taux de revascularisation du vaisseau cible (TVR) de 33 % (p = 0,001) et, d’autre part, une meilleure sécurité avec une réduction de 45 % du risque relatif de thrombose de stent (p = 0,004) (figure 4).
Figure 4. Métaanalyse comparant les stents à l’évérolimus aux stents actifs sans everolimus. Réduction de 45 % du risque de thrombose de stent et de 33 % du taux de revascularisation du vaisseau cible.
Les stents au biolimus ont été comparés dans l’étude LEADERS aux stents au sirolimus dans une étude de non infériorité portant sur 1 707 patients. Les résultats à 4 ans de l’étude LEADERS(6) retrouvent une non-infériorité et même une supériorité, sur le critère composite décès cardiovasculaire, infarctus et revascularisation du vaisseau cible par rapport aux stents au sirolimus ; 18,7 % biolimus vs 22,6 % sirolimus, p pour non-infériorité < 0,0001, p pour supériorité = 0,05. On observait une réduction de 38 % du risque relatif de thromboses de stent tardives (p = 0,09) avec une réduction des thromboses très tardives (> 1 an) entre la 1e et la 4e année (p = 0,004).
Les résultats des différentes études avec les stents au polymère biodégradable sont en faveur d’une réduction des thromboses de stent en comparaison aux stents au sirolimus (figure 5).
Figure 5. Métaanalyse comparant stent au polymère biodégradable au polymère durable au sirolimus(6).
Quelles sont les indications et les contre-indications des stent actifs en 2012 ?
Les stents actifs représentent 60 % des stents implantés en France avec d’importantes disparités en fonction des centres. Il existe 5 indications de remboursement des stents actifs en France (tableau 3) :
– les lésions de novo des artères coronaires natives chez certains sous-groupes de patients à haut risque de resténoses (lésions > 15 mm, diamètre du vaisseau atteint < 3 mm ou patients diabétiques),
– la resténose intrastent nu,
– l’occlusion chronique totale,
– après concertation pluridisciplinaire des alternatives de revascularisation en tenant compte des facteurs de risque évalués (Euroscore et score SYNTAX), pour le traitement de certaines lésions pluritronculaires de novo des artères coronaires natives (lésions > 15 mm, diamètre du vaisseau atteint < 3 mm ou chez les patients diabétiques) accessibles à l’angioplastie et lorsque le risque chirurgical est élevé,
– le tronc commun non protégé.
Enfin, il faut noter que l’infarctus du myocarde est une indication où les stents actifs peuvent être utilisés lorsque l’une de ces 5 indications est présente (stent Cypher, Taxus élément, Promus et Xience).
Les récentes recommandations européennes de cardiologie considèrent que l’utilisation des stents actifs doit être une stratégie « par défaut » en dehors des contre-indications (tableau 4). En pratique, toutes ces contre-indications sont relatives.
Quelle durée de la bithérapie antiplaquettaire après stent actif ?
Avec la réduction observée des thromboses de stent tardives et très tardives avec les endoprothèses de nouvelles générations, la durée de la bithérapie antiplaquettaire est une question qui mérite d’être posée en dehors des conditions instables (syndrome coronarien aigu) où la poursuite de la bithérapie pendant 12 mois est la règle. Les données récentes de la littérature ne sont pas en faveur d’une augmentation des thromboses de stent tardives lorsque le clopidogrel est stoppé 12 mois(7) et même 6 mois(8) après l’angioplastie avec stent actif en comparaison à une poursuite de 24 mois après l’angioplastie.
Des essais cliniques sont actuellement en cours pour valider des durées de bithérapies encore plus courtes (3 mois et même 1 mois) avec des stents actifs de nouvelle génération, dont certains sans polymère.
Quel apport du SYNTAX score ?
L’étude Syntax(9) est une étude multicentrique randomisée de non-infériorité qui a comparé chez 1 800 patients tritronculaires ou porteurs d’une sténose du tronc, l’angiopastie avec stent actif au paclitaxel à la chirurgie de pontage. Après 4 ans de suivi, la chirurgie faisait mieux que l’angioplastie sur le critère principal d’événements cardiaques et cérébrovasculaires MACCE (décès toute cause, AVC, IDM ou revascularisation) : 23,6 % vs 33,5 % (p < 0,001). On observait notamment beaucoup plus de revascularisations dans le groupe angioplastie en comparaison au groupe chirurgie : 23 % vs 11,9 % (p < 0,001).
Un des mérites de cette étude est d’avoir systématiquement utilisé un marqueur de gravité angiographique faisant intervenir plusieurs composantes (figure 6). Pour un score SYNTAX ≤ 22 l’angioplastie faisait jeu égal avec la chirurgie (26,1 % vs 28,6 % ; p = 0,57). En revanche, on observe une supériorité de la chirurgie pour les scores intermédiaires (entre 22 et 32) ou élevés (≥ 33).
Figure 6. Méthode de calcul du score SYNTAX (www.syntaxscore.com).
Les recommandations européennes(10) ont repris le score SYNTAX pour guider la revascularisation.
L’angioplastie peut être proposée (classe IIa niveau d’évidence B) pour les lésions du tronc gauche ou les lésions tritronculaires lorsque le score SYNTAX est < 22.
Quelle place reste-t-il pour les stents nus ?
Les stents nus sont toujours très largement utilisés et représentent 40 % des endoprothèses implantées. Leur structure peut être modulaire ou tubulaire, ils sont constitués d’acier, d’alliage chrome et cobalt, d’alliage platine chrome, etc. Ils ont profité des améliorations techniques avec la diminution de l’épaisseur des mailles pouvant atteindre 65 µm et l’amélioration de leurs profils de franchissement. Les stents nus peuvent aussi bénéficier d’un « coating » comme le stent Titan 2 qui est coaté à l’oxynitrure de titane. Les stents autoexpansibles ont refait leur apparition, en utilisant les propriétés du nitinol, ils permettent de mieux s’adapter à la morphologie de l’artère et de limiter les phénomènes de malappositions. C’est le cas du STENTYSTM dont les interconnections entre les mailles peuvent être désolidarisées si un accès à une voie accessoire est nécessaire.
Les indications de ce type de stent reposent essentiellement sur les non-indications des stents actifs ainsi que sur leurs contre-indications.
La compliance au traitement antiplaquettaire joue aussi un rôle important. Lorsque celle-ci est incertaine ou inconnue (patient en choc et/ou intubé), le choix se porte préférentiellement sur les stents nus. Enfin, sur le plan économique le coût de ces endoprothèses reste environ 2 fois inférieur à celui des endoprothèses actives.
L’avenir : les stents biorésorbables ?
Les stents biorésorbables sont capables de se résorber une fois le mécanisme de cicatrisation terminé. Ces endoprothèses ont de nombreux avantages théoriques. Ils permettent la restauration de la vasomotricité coronaire, de limiter les phénomènes d’inflammation tardive et d’hypersensibilité, et diminuent ainsi les thromboses tardives. Elles permettent une diminution de la durée de la bithérapie, de respecter les collatérales et d’envisager une imagerie non invasive sur les segments stentés. Les stents biorésorbables utilisent soit des polymères comme l’acide polylactique (PDLLA pour poly-D, L lactide acide), l’anhydride d’acide salicylique et d’acide adipique, soit des alliages métalliques à base de magnésium (stent Dreams).
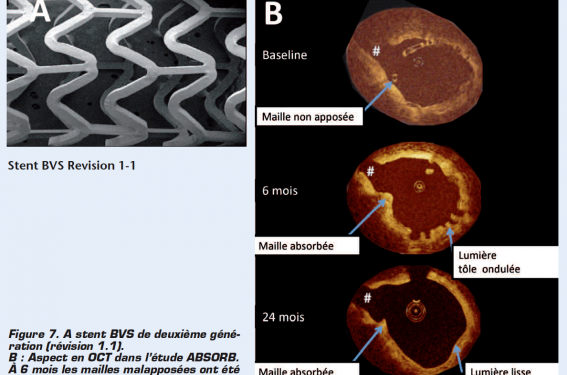
Le stent Bioresorbable Vascular Scaffold (BVS, Abbott) (figure 7) est recouvert d’une couche d’évérolimus intégré à une matrice de PDLLA dont la diffusion se fait dans les premiers mois. La résorption complète du polymère se faisant en 24 mois. Les premières études cliniques avec le BVS de première génération étaient encourageantes mais la perte du diamètre intraluminal (late loss) était plutôt élevée à 0,44 mm. Le BVS de deuxième génération (Revision 1.1) permet d’obtenir une meilleure force radiale et un late loss à 0,19 mm. Le registre ABSORB EXTEND portant sur 1 000 patients avec ce stent est actuellement en cours.
Le stent métallique AMS-1 (Absorbable Metallic Stent) Biotronik est composé de 93 % de magnésium et de 7 % de métaux rares. Les travaux expérimentaux ont montré une dégradation complète du magnésium en sels non organiques sur une période de 2 mois. Deux évolutions techniques de ce stent ont été réalisées afin d’améliorer la force radiale et d’y incorporer une matrice biorésorbable permettant la libération de substance active dans la paroi. L’étude clinique BIOSOLVE-1, qui évalue son efficacité et sa sécurité d’emploi, a débuté récemment.
En pratique
Les stents font partie intégrante de l’angioplastie coronaire. L’arrivée des stents actifs a permis une importante réduction de la resténose intrastent sans bénéfice sur la mortalité.
Les stents actifs de nouvelle génération ont profité de l’amélioration des polymères et des plateformes et ont permis d’améliorer encore l’efficacité en optimisant parallèlement la sécurité avec une diminution des thromboses de stent, notamment les thromboses très tardives. Les nouvelles technologies devraient permettre encore d’améliorer les résultats de l’angioplastie avec l’arrivée des stents biodégradables.
Il est cependant peu probable qu’un seul et même type de stent soit envisageable pour tous les patients. Une stratégie d’individualisation en fonction du type de lésion, du contexte clinique, des comorbidités du patient, de sa capacité à poursuivre la bithérapie antiplaquettaire sera probablement envisagée.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :