Training
Publié le 31 déc 2007Lecture 6 min
Échographie endocoronaire : les fondamentaux pour quantifier une sténose
S. GHOSTINE, Y. HABIB, C. CAUSSIN, Centre chirurgical Marie Lannelongue, Le Plessis-Robinson.
L’avènement de l’échographie endocoronaire (IVUS) depuis le début des années 90 a révolutionné l’imagerie coronaire en offrant des renseignements précieux et complémentaires tant qualitatifs que quantitatifs sur l’athérome. Deux conditions s’imposent cependant pour en tirer de véritables enseignements : une réalisation et surtout une interprétation extrêmement rigoureuses.
Longtemps considérée comme la méthode de référence pour la quantification des sténoses coronaires, la coronarographie montre un luminogramme et ne renseigne pas sur la plaque athéromateuse. Ses principales limites demeurent celle de la projection planaire d’un volume tridimensionnel. Or l’athérome présente une structure géométrique complexe. L’échographie endocoronaire en visualisant non seulement la lumière artérielle, mais aussi la plaque d’athérome avec une précision de quelques dizaines de microns, permet de palier les principales limites de l’évaluation quantitative d’une sténose en coronarographie (figure 1) définies par :
– le postulat qu’un segment de référence « sain » permet de calculer un pourcentage de sténose. Or ce segment de référence est en fait exceptionnellement sain ;
– la projection bidimensionnelle d’un volume qui peut masquer des sténoses excentrées ou créer des superpositions sur des segments importants.
Figure 1. Incidence crâniale de l’IVA avec des coupes échographiques étagées. Le segment proximal supposé sain est très pathologique. La sténose du segment moyen est confirmée avec une autre lésion très significative en aval de la diagonale passée inaperçue à la coronarographie. En fait, le segment le plus sain est celui de la bifurcation IVA-diagonale.
Réalisation de l’examen
Fixer le motordrive sur le chariot de retrait et insérer l’ensemble dans une housse stérile.
Préparer la sonde d’IVUS : connexion à deux seringues remplies de solution saline. Purger la sonde pour chasser les bulles d’air. Connecter la sonde au motordrive.
L’examen est réalisé en 6F avec les sondes mécaniques ou 5F avec les sondes électroniques, sur un patient ayant reçu un traitement anticoagulant efficace. Après l’injection intracoronaire de nitrés, la sonde est introduite sur un guide coronaire 0,014 et franchit la zone à étudier.
L’acquisition commence au moins 10 mm au-delà de la lésion, au mieux au-delà d’une branche repère. Le retrait se fait automatiquement à l’aide du motordrive (0,5 mm/s). L’artère est ensuite flushée au sérum physiologique ou au produit de contraste afin de délimiter au mieux les contours de la lumière. On termine l’acquisition à la jonction aorto-ostiale. La lecture du retrait est effectuée puis la sonde retirée.
Un deuxième passage peut être réalisé si besoin après avoir purgé la sonde une fois retirée et l’avoir réengagée dans sa gaine. Il faut ensuite faire les mesures automatiques. Un dérivé nitré est injecté en fin d’examen.
Aspects physiologiques
Les images échographiques sont formées par des interfaces entre des milieux d’impédances acoustiques différentes. Une partie des ultrasons est réfléchie à chaque interface et permet la composition de l’image, l’autre partie est transmise en profondeur jusqu’à une prochaine interface. Plus l’interface est réflective et plus le signal est intense. La densité d’un tissu est proportionnelle à la présence de collagène ou de calcium. La pre- mière structure que le faisceau d’ultrasons traverse est la lumière remplie de sang. Le sang a un aspect scintillant en mouvement qui le distingue des tissus. La média est essentiellement de composante musculaire avec très peu de collagène. L’adventice et les limitantes élastiques sont très riches en collagène. Les sondes utilisées actuellement sont de 40 mHz permettant une résolution spatiale, axiale de 80 à 100 µm et circonférentielle de l’ordre de 200 µm avec une cadence d’images de 30/s. Les mesures sont directes et précises.
La résolution spatiale est remarquable, de l’ordre de 80 à 100 mm en axial et de 200 mm en circonférentiel, à une cadence de 30 images par seconde.
Aspects qualitatifs
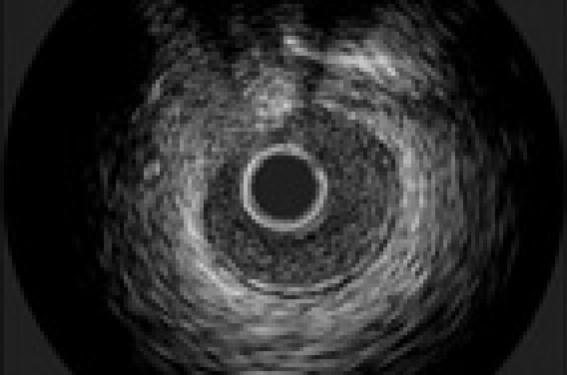
Sur l’image échographique d’une section d’artère, la paroi du vaisseau sain apparaît en trois couches (figure 2) :
– une couche interne écho-intense : intima, limitante élastique interne ;
– une couche moyenne peu écho-intense : média ;
– une couche externe écho-intense : limitante élastique externe, adventice, tissu péri-adventiciel.
La plaque d’athérome selon sa richesse en fibres de collagène sera qualifiée de molle (moins échogène que l’adventice), intermédiaire (échogénicité semblable à l’adventice) ou calcifiée (densité supérieure à l’adventice).
En présence d’un stent, les mailles génèrent des échos intenses.
Figure 2. Aspect en trois couches d’une artère coronaire. L’aspect scintillant du sang autour du transducteur peut être atténué par l’injection saline.
Aspects quantitatifs
Les mesures de diamètre et de surface luminale doivent être réalisées sur les images de section d’artère et non pas sur les images de reconstruction longitudinales sauf pour les mesures de longueur de segment(1,2).
Deux mesures de section (diamètre luminal) doivent être réalisées de façon reproductible, au bord d’attaque de chaque interface. Les mesures de diamètre doivent passer par le centre de la lumière et non pas par le centre du cathéter.
Dans un second temps sont mesurés :
– la surface artérielle endoluminale (SAL) ou surface de la lumière bordée par l’intima (ou la plaque) ;
– la surface artérielle totale (SAT) bordée par la limitante élastique externe et par soustraction, la surface plaque-média (SPM) = SAT-SAL (figures 3 et 4).
Figure 3. Mesure de surfaces et de diamètres d’une coronaire non sténosée. DL : diamètre luminal.
Figure 4. Mesure de surfaces et de diamètres d’une coronaire sténosée. Noter le cône d’ombre généré par les deux plaques calcifiées entre 2 et 5 heures et 8 et 11 heures. SPM : surface plaque-media.
Cas particulier des stents
En présence d’un stent, une troisième mesure est réalisable : la surface intrastent délimitée par le centre de chacune des mailles du stent (figure 5). Elle permet de calculer la surface d’hyperplasie intimale qui est la surface intrastent moins la surface artérielle luminale.
En faisant la somme de ces surfaces d’hyperplasie tous les millimètres, on obtient le volume d’hyperplasie en mm3. Ce volume peut être reporté à la surface en divisant le volume par la longueur.
Figure 5. Mesure de surfaces d’une coronaire stentée.
Par ailleur s, pour une angioplastie guidée par l’IVUS, le bon déploiement du stent est apprécié selon les critères« MUSIC » :
• apposition complète de toutes les mailles ;
• surface intrastent minimale
- > 90 % de la référence moyenne si la référence est > 9 mm2 et surface intrastent minimale
- > 80 % si la référence moyenne est < 9 mm2 ;
• symétrie d’expansion intrastent > 0,7, définie par le rapport du plus petit diamètre sur le plus grand diamètre.
Valeur pronostique de l’IVUS
La surface artérielle minimale endoluminale (minimal lumen area : MLA des Anglo-Saxons) a la plus forte corrélation avec les tests d’ischémie et une excellente valeur pronostique. Cette surface est corrélée de façon significative au risque d’événements graves(3). La valeur seuil de 4 mm2 pour les gros troncs épicardiques est confirmée par les tests d’ischémie, notamment le Doppler coronaire, le guide pression(4) ainsi que la scintigraphie myocardique(5). Pour le tronc commun gauche, la MLA a été déterminée à 6 mm2(6).
La surface artérielle minimale endoluminale corrélée de façon significative au risque d’événements graves est de 4 mm2 pour les gros troncs épicardiques et de 6 mm2 pour le tronc commun gauche.
Indications de l’IVUS endocoronaire
Diagnostiques : bilan des patients avec une discordance clinique et angiographique (sténoses non vues angiographiquement ou ruptures de plaque telles que l’infarctus du myocarde à coronaires saines ou le syndrome X)(7).
En complément de la coronarographie : lésions intermédiaires, lésions difficiles (ostia, tronc commun gauche).
En complément de l’angioplastie : avant et après stenting pour une meilleure impaction, résultat imparfait après angioplastie, bilan de la resténose intrastent.
Conclusion
Les principales limites de l’IVUS restent son coût élevé et son caractère invasif. Mais l’apport diagnostique, thérapeutique et pronostique de cette technique devrait en faire un outil nécessaire dans une unité de cardiologie interventionnelle.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


