Valvulopathies
Publié le 03 nov 2009Lecture 5 min
Voie sous-clavière : une alternative intéressante pour les prothèses aortiques
B. GELLEN, E. TEIGER, M. KIRSCH, E. ALLAIRE, C. VIALLET, J.-L. MONIN, J.-L. DUBOIS-RANDE, CHU Henri Mondor, Créteil
Le remplacement valvulaire aortique (RVA) par voie percutanée est une approche thérapeutique récente. Pour l’instant elle ne s’adresse, comme toute innovation majeure en médecine, qu’aux patients ne pouvant bénéficier de la thérapie de référence du rétrécissement aortique sévère : le RVA par voie chirurgicale. Ainsi, l’implantation d’une bioprothèse aortique par voie percutanée est réservée aux patients âgés, porteurs d’un rétrécissement aortique calcifié (RAC) serré symptomatique, et chez qui l’approche chirurgicale conventionnelle est à très haut risque ou ne peut pas être envisagée (aorte porcelaine, toute contre-indication à la circulation extracorporelle, comorbidités lourdes, etc.).
Les valves percutanées
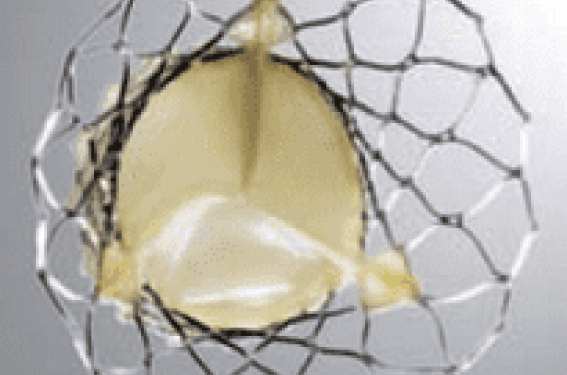
Deux types de bioprothèse aortique ont été commercialisés au cours des dernières années : la CoreValve et la valve Edwards-Sapien, utilisant deux concepts technologiques complètement différents. Les cusps de la valve Edwards-Sapien sont montés sur un stent métallique rigide serti sur un ballon, par analogie avec les stents coronaires. Actuellement, la mise en place de cette valve nécessite une voie d’abord d’un diamètre minimal de 22 French(F), ce qui exige une préparation chirurgicale de l’artère fémorale (procédure dite « transcutanée »). En contraste, les cusps de la Corevalve sont portés par une armature auto-expansive à mémoire de forme (cf. ci-dessous) suffisamment miniaturisée pour passer à travers un désilet de 18F (figure 1). La mise en place de la Corevalve par voie fémorale peut être réalisée sans préparation chirurgicale de l’artère (procédure dite « entièrement percutanée »).
Figure 1. La prothèse CoreValve.
Corevalve : historique
La société CoreValve a été fondée en 2001. Le premier RVA utilisant la CoreValve a été réalisé en 2004 chez l’homme. La troisième génération de cette prothèse, accessible depuis 2006, permet de réaliser la procédure de façon entièrement percutanée. À ce jour, plus de 2 500 remplacements valvulaires aortiques percutanés utilisant la Corevalve ont été réalisés dans 125 centres à travers le monde. La mortalité à 30 jours rapportée est de 10 à 15 %, et le taux de succès de la procédure de 85 à 90 %. La survie à 1 an est de 70 %(1). En France, 130 procédures ont été réalisées dans 10 centres, l’hôpital Henri Mondor disposant de la plus grande expérience avec plus de 30 implantations.
Sertissage et implantation
La CoreValve est constituée de trois cusps d’origine péricardique porcine, suturés sur une armature (stent) auto-expansive en Nitinol. Le Nitinol a pour caractéristique d’être rigide et déformable à des températures proches de 0 °C et de regagner immédiatement sa forme initiale à des températures > 30 °C. La valve est fournie à température ambiante, dans sa forme déployée. Avant l’implantation, elle doit être comprimée dans de l’eau glacée jusqu’à un diamètre inférieur à 6 mm à l’aide d’un système de compression et de chargement. Ensuite, la valve est chargée à l’extrémité distale du cathéter de pose. L’ensemble des procédures de compression et de chargement est appelé sertissage. La CoreValve est implantée par voie rétrograde après dilatation du RAC au ballonnet et sans retrait de la valve native, qui sera finalement écrasée par l’armature de la prothèse. Le cathéter de pose possède un diamètre de 18 F au niveau distal (cage hébergeant la valve) et 12 F au niveau du corps, nécessitant ainsi un abord artériel de 18F (6 mm) de diamètre. Dans la majorité des cas, le calibre et l’anatomie des axes ilio-fémoraux permettent la mise en place de la CoreValve par cette voie.
Indications de la voie sous-clavière
Néanmoins, l’acheminement de la prothèse par voie fémorale peut s’avérer impossible ou très risqué chez certains patients en principe éligibles pour la CoreValve, compte tenu du petit calibre, des rétrécissements significatifs et/ou des tortuosités importantes des axes ilio-fémoraux. À condition que l’artère sous-clavière gauche ait un calibre supérieur à 6 mm sur l’ensemble de son trajet, ce qui est mis en évidence par un angioscanner thoracique, l’accès par cette artère peut être une solution alternative pour les patients récusés pour la voie fémorale. Cette approche nécessitant la préparation chirurgicale de l’artère sous-clavière, la procédure doit être réalisée dans une salle adaptée à la fois à la cardiologie interventionnelle et à la chirurgie (dite « hybride », figure 2), en étroite collaboration entre les équipes de cardiologie interventionnelle, de chirurgie vasculaire, de chirurgie cardiaque, et d’anesthésie. Notre équipe, constituée de 3 cardiologues interventionnels, 2 chirurgiens vasculaires, 1 chirurgien cardiaque, 1 cardiologue échographiste, 1 anesthésiste et 6 membres du personnel paramédical, a réalisé récemment un RVA par voie sous-clavière dans notre salle hybride (figure 3) avec succès.
Figure 2. Salle hybride de l’hôpital Mondor.
Figure 3. Gauche : Préparation chirurgicale de l’artère sous-clavière gauche. Droite : Introducteur 18F mis en place.
Avantages et risques de la voie sous-clavière
L’approche sous-clavière comporte des avantages et des risques spécifiques par rapport à la voie fémorale. L’acheminement et le positionnement de la prothèse peuvent être moins délicats pour le cardiologue interventionnel compte tenu du trajet intravasculaire plus court et de l’angle plus faible entre la poignée du cathéter et la cage contenant la valve. Les risques de la procédure du point de vue cardiologique sont identiques à ceux de l’approche fémorale et consistent essentiellement en des fuites paraprothétiques résiduelles significatives liées à un positionnement trop bas de la prothèse par rapport à l’anneau aortique. Pour un chirurgien vasculaire expérimenté, la préparation de l’artère sous-clavière gauche ne pose habituellement aucun problème technique et peut être réalisée en moins de 30 min. Dans certains cas par contre, le plexus brachial se situe directement au niveau de la face antérieure de l’artère sous-clavière et doit être mobilisé sur un long trajet, ce qui comporte un risque de séquelles sensitivo-motrices au niveau du membre supérieur gauche en raison de la traction importante des fibres nerveuses. De ce fait, le rôle de l’imagerie préprocédurale ne se limite pas à visualiser le calibre de l’artère sous-clavière, mais peut faciliter le travail du chirurgien vasculaire en déterminant le rapport anatomique exact entre l’artère sous-clavière et le plexus brachial.
Conclusion et perspectives
Le remplacement valvulaire aortique par voie percutanée représente une approche curative du RAC symptomatique serré, avec une baisse du gradient trans-valvulaire, une surface valvulaire efficace de plus de 1,5 cm2 et une diminution des symptômes, montrant des résultats fonctionnels immédiats comparables à ceux de la chirurgie. Il s’agit d’une technique très récente qui a déjà fait ses preuves en termes de sécurité et de faisabilité, mais qui devra encore être évaluée par des études de morbi-mortalité avec suivi à long terme, avant de pouvoir être considérée comme une réelle alternative au RVA chirurgical. En particulier, la longévité des cusps de la bioprothèse devra être démontrée et comparée à celle des bioprothèses chirurgicales. En attendant, cette technique doit rester réservée aux patients récusés pour la chirurgie, pour qui autrefois la seule option thérapeutique consistait en un traitement médical symptomatique et, en cas d’OAP répétitif ou réfractaire, en une valvuloplastie au ballon de caractère palliatif.
En cas de succès et en l’absence de complications post-procédure, les patients peuvent quitter l’hôpital en moins d’une semaine. Ceux présentant une désadaptation physique importante doivent bénéficier d’un séjour en réadaptation cardiologique avant retour à domicile.
En pratique
Dans notre expérience, sous réserve d’un recul de seulement deux ans, la CoreValve offre une réelle chance de traitement curatif à ces patients souvent sévèrement symptomatiques et fréquemment hospitalisés pour des décompensations cardiaques itératives.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :







