Échocardiographie
Publié le 22 mar 2005Lecture 7 min
Qu'est-ce que la non-compaction du ventricule gauche ?
P. PAULE, hôpital d’Instruction des Armées Laveran, Marseille

La non-compaction du ventricule gauche (VG) est une cardiomyopathie congénitale rare appartenant au groupe des cardiomyopathies (CM) dites « non classées » dans la classification de l’Organisation mondiale de la santé (OMS).
Elle est la conséquence d’une altération de la structure du myocarde secondaire à une embryogenèse incomplète. Les manifestations cliniques qui en découlent sont multiples. L’échocardiographie transthoracique (ETT) permet le diagnostic, qui peut être précisé par d’autres techniques d’avenir comme l’imagerie par résonance magnétique (IRM).
Observation
Un patient, âgé de 26 ans, d’origine gabonaise, est amené à consulter après la découverte d’une cardiomégalie sur un cliché thoracique pris dans le cadre de la médecine universitaire (figure 1). Ce jeune Africain, étudiant en France, ne présente pas d’antécédent familial ou personnel. Il ne signale aucun facteur de risque cardio-vasculaire, ni éthylisme, ni prise médicamenteuse. Il pratique le football en loisir et est asymptomatique. L’examen clinique est normal, notamment en l’absence de signe d’insuffisance cardiaque (IC).
Figure 1. Cardiomégalie d’un patient âgé de 26 ans.
L’ECG enregistre un rythme sinusal et une rotation axiale gauche, l’indice de Sokolow est augmenté et l’onde T est aplatie en territoire latéral, traduisant une hypertrophie du VG.
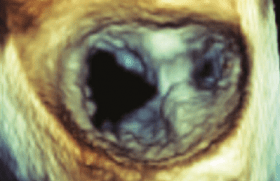
L’ETT montre une dilatation des cavités gauches, essentiellement aux dépens du VG avec un diamètre télédiastolique (DTDVG) à 70 mm. Il existe une altération sévère de la fraction d’éjection du VG (FEVG) qui apparaît globalement hypokinétique avec un profil de remplissage mitral de type restrictif. Le myocarde semble hypertrophique, mais présente en réalité un aspect spongieux révélant la présence de trabéculations saillantes séparées par des cryptes principalement localisées à l’apex et étendues à la paroi latérale (figure 2 a et b).
Le myocarde semble constitué de deux couches : une couche sous-endocardique épaisse non compactée et une couche sous-épicardique fine mais bien compacte.
Figure 2. Trabéculation apicale et de la paroi latérale. Doppler couleur en incidence apicale 4 cavités révélant le remplissage des espaces intertrabéculaires cryptiques par le flux sanguin aux différents temps du cycle cardiaque (A et B).
En mode Doppler couleur, on visualise le remplissage des espaces intertrabéculaires cryptiques par le flux sanguin dans les différents temps du cycle cardiaque (figure 2 A et B). Il existe une insuffisance mitrale modérée par dilatation de l’anneau et il n’y a pas d’hypertension artérielle pulmonaire.
L’IRM cardiaque permet de préciser les données échocardiographiques (figure 3). Cet examen retrouve la dilatation et l’hypokinésie du VG, et confirme dans différentes incidences l’existence de cet aspect inhabituel de l’apex qui n’existe pas dans les cardiopathies dilatées classiques.
Ce patient jeune bénéficie d’une coronarographie qui ne montre pas d’anomalie.
Figure 3. À droite : IRM en incidences 4 cavités. À gauche : petit axe montrant les trabéculations.
- Il présente donc une cardiomyopathie dilatée hypokinétique avec un aspect échocardiographique très insolite, cependant typique d’une entité individualisée sous le nom de non-compaction du VG (NCVG). Il ne présente pas d’arythmie sur le Holter ECG des 24 heures, ni de potentiel tardif ventriculaire. L’épreuve d’effort est maximale, menée à 180 Watts, sans trouble du rythme à l’effort, et la VO2 max est peu altérée (76 % de la valeur théorique).
- Il bénéficie de la prescription d’un inhibiteur de l’enzyme de conversion (IEC) et demeure asymptomatique un an après le diagnostic. Il n’a pas été prescrit d’anticoagulant compte tenu du risque de mauvaise observance au retour dans son pays d’origine. En revanche, il reçoit de l’aspirine à la posologie de 75 mg/j. Le sport de compétition lui est déconseillé.
Discussion
La non-compaction du ventricule gauche (NCVG) est une cardiomyopathie (CM) congénitale rare, intégrée par l’OMS en 1995 dans le groupe des CM dite « non classées ». Cette pathologie a été initialement décrite en association avec des anomalies congénitales comme les cardiopathies cyanogènes. Cependant, en 1984, elle a été individualisée de manière isolée, en l’absence de toute autre atteinte cardiaque.
Une anomalie de l’embryogenèse
Elle correspond à l’arrêt de l’embryogenèse du myocarde. Jusqu’au premier mois, le myocarde est composé de mailles de fibres musculaires formant des trabéculations entre lesquelles s’enfoncent des récessus intertrabéculaires communiquant avec la cavité ventriculaire. De la 5e à la 8e semaine, la circulation coronaire se développe, les espaces intertrabéculaires se transforment en capillaires et le myocarde se compacte progressivement de la base vers l’apex, depuis les couches sous-épicardiques vers les couches sous-endocardiques.
Dans la NCVG, ces phénomènes ne s’effectuent pas : il persiste des trabéculations et des récessus intertrabéculaires qui communiquent avec la cavité ventriculaire mais pas avec la circulation coronaire.
Sur le plan anatomo-pathologique, on différencie deux couches myocardiques :
• une sous-épicardique fine mais compactée,
• une sous-endocardique non compactée plus épaisse avec, selon certains auteurs, de la fibrose ou des plages de nécrose autour des myocytes.
Parmi les complications de cette affection, certaines résultent des anomalies de la microcirculation coronaire et de la compression exercée par le muscle épaissi sur celle-ci. Une atteinte du ventricule droit est associée dans 41 % des cas.
Sur le plan génétique
Il existe des formes familiales de transmission récessive liée au chromosome x dont le gène est proche de celui des myopathies systémiques et touchant essentiellement l’homme. Des formes familiales de transmission autosomique dominante ainsi que des formes sporadiques pouvant toucher les deux sexes ont été rapportées.
Épidémiologie
La NCVG a été initialement décrite chez des patients jeunes mais elle a ensuite été individualisée dans toutes les catégories d’âge avec une prédominance masculine. Sa prévalence est mal connue.
Les circonstances de découverte
Elles sont multiples.
Dans deux tiers des cas, il s’agit d’un tableau d’IC, souvent systolique, liée aux trabéculations et à l’ischémie sous-endocardique, associée à une dilatation et à une altération du VG.
Il peut s’agir aussi d’une IC diastolique.
Une arythmie supraventriculaire, par exemple une fibrillation auriculaire (FA) dans 25 % des cas, ou ventriculaire, voire une mort subite, peuvent révéler la maladie. Les troubles du rythme ventriculaire sont aussi probablement liés à l’atteinte de la microcirculation coronaire.
La formation de thrombi intracryptiques et leur migration peuvent se compliquer d’accidents thromboemboliques systémiques ou pulmonaires. Ils sont favorisés par la FA, l’altération de la fonction systolique et la présence des trabéculations. Les séries pédiatriques ne constatent pas de complications rythmiques ou emboliques.
Enfin, la découverte peut être systématique comme dans cette observation, parfois sans altération de la FEVG.
Diagnostic
- L’ECG est souvent pathologique : bloc auriculo-ventriculaire, bloc de branche, troubles de la repolarisation sont décrits. Mais cet examen n’est pas discriminant.
- En l’absence d’autre cause de cardiopathie, le diagnostic positif est basé sur des critères échocardiographiques :
• l’association de trabéculations et de récessus intertrabéculaires ;
• le remplissage des récessus par le flux sanguin provenant du VG visible en Doppler couleur.
La localisation préférentielle de l’anomalie est apicale ou latéro- ou inféro-médiane. Pour préciser le diagnostic, certains auteurs ont proposé d’individualiser deux couches myocardiques : une couche sous-endocardique non compacte, deux fois plus épaisse en télésystole que la couche sous-épicardique compacte.
Ces arguments permettent d’établir le diagnostic différentiel avec des trabéculations normales, certaines CM hypertrophiques ou dilatées, et la présence de thrombi apico-ventriculaires.
- L’IRM cardiaque complète les données de l’ETT, notamment chez les patients peu échogènes. Elle met en évidence une différence d’intensité de signal des zones non compactées. Cette technique, comme la scintigraphie au thallium 201 et la tomographie par émission de positons, permet de visualiser des régions hypoperfusées au sein du myocarde non compacté, témoignant de l’atteinte de la microcirculation coronaire.
Pronostic
Il est difficile de se prononcer. Cette pathologie est de description récente, certainement sous-estimée et les séries comportent peu d’effectifs. Les patients peuvent demeurer longtemps asymptomatiques.
Quand ils deviennent symptomatiques (dyspnée, FA permanente), qu’apparaît un bloc de branche ou que le DTDVG est important, le pronostic semble moins bon comme l’atteste la série de Œchslin, qui est une des plus importantes avec 34 patients majoritairement symptomatiques à l’inclusion (88 %). Leur évolution à 5 ans montre 53 % d’IC, 35 % de décès (50 % de morts subites, 33 % d’IC terminales), 12 % de transplantations cardiaques ; 24 % ont présenté un événement thromboembolique durant cette période. Ces chiffres sont superposables avec les données de la littérature concernant l’IC en général, mais pour des patients souvent jeunes concernés par cette affection.
Prise en charge
La prise en charge thérapeutique n’est pas totalement codifiée. Le traitement répond aux classes thérapeutiques utilisées dans l’IC. Mais certaines questions demeurent :
• compte tenu du risque thromboembolique, faut-il systématiquement introduire des anticoagulants, en dehors des patients en FA ?
• faut-il systématiquement implanter un défibrillateur devant le risque rythmique chez ces sujets jeunes ?
• n’est-on pas en droit d’envisager précocement une transplantation au vu du jeune âge de ces patients et du pronostic péjoratif ?
Il est recommandé d’introduire un anticoagulant en raison de l’aspect anatomique, d’autant plus que la FEVG est altérée. En cas de contre-indication, les antiagrégants plaquettaires peuvent constituer une alternative. Par ailleurs, l’attitude thérapeutique est identique à celle proposée à tout autre insuffisant cardiaque. La mise en place d’un défibrillateur implantable doit se discuter en tenant compte des règles actuellement retenues pour ces dispositifs.
Conclusion
La NCVG est une CM rare du sujet jeune, au pronostic réservé. Le diagnostic est essentiellement basé sur l’ETT et facilité par l’IRM cardiaque. La découverte d’un cas impose la réalisation de cet examen non invasif au bénéfice de l’entourage familial et certainement une enquête génétique dans l’avenir.
Une bibliographie sera adressée aux abonnés sur demande au journal.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :