Thérapeutique
Publié le 15 sep 2018Lecture 13 min
Complications cardiaques de la radiothérapie - Le point de vue du radiothérapeute
Emmanuel KAMMERER*, Jennifer LE GUÉVELOU*, Juliette THARIAT**, *service de radiothérapie, Centre François Baclesse, Caen, **Professeur universitaire, service de radiothérapie, Centre François Baclesse, Caen
La radiothérapie s’est imposée dans les standards de prise en charge de nombreux cancers thoraciques. Du fait de l’anatomie, le cœur est un organe à risque, critique. Des études récentes ont mis en évidence un sur-risque cardiovasculaire post-irradiation cardiaque. Cet article présente les principales indications de radiothérapie thoracique, les complications cardiaques associées, et les perspectives de dépistage et de prévention primaire. Une coopération rapprochée entre radiothérapeutes et cardiologues semble nécessaire pour améliorer les prises en charge.
La radiothérapie est actuellement un standard de prise en charge de nombreux cancers de la région thoracique (sein, poumon, Hodgkin...). Elle apporte généralement une nette amélioration du contrôle tumoral local et général. Avec l’amélioration de la prise en charge carcinologique et l’amélioration générale de la survie de ces patients, des cohortes de longs survivants existent. Les complications cardiaques, volontiers tardives (survenant des années après la radiothérapie) sont actuellement un réel enjeu de prise en charge. Le taux de décès par cardiopathie radio-induite post-radiothérapie adjuvante dans les cancers du sein a été estimé à 125 cas pour 100 000 patientes-années, soit 0,1 % patiente-année(1). La part réelle de la cardiotoxicité radio-induite reste cependant difficile à établir du fait des traitements systémiques régulièrement associés (chimiothérapie, thérapies ciblées, hormonothérapie).
Le principal paramètre dosimétrique utilisé actuellement pour évaluer la probabilité de cardiotoxicité radio-induite est la dose moyenne cardiaque, en particulier en sénologie(2). D’autres paramètres dosimétriques (notamment le volume physique recevant X Gy) sont en cours d’évaluation, concernant le cœur dans son ensemble ou des sous-structures (notamment les artères coronaires).
Indications de radiothérapie du thorax
Cancers mammaires
Le nombre annuel de nouveaux cancers mammaires invasifs est actuellement de 50 000 cas par an en France, avec une survie nette à 5 ans de 86 % (en 2012). La prise en charge d’un cancer du sein localisé repose en premier lieu sur la chirurgie, soit par mastectomie, soit par tumorectomie (chez 2 patientes sur 3). La tumorectomie est suivie d’une radiothérapie adjuvante de 50 Gy sur le sein restant, avec souvent un complément de 16 Gy supplémentaires au niveau du lit tumoral. Historiquement réalisée sans autre traitement adjuvant, cette radiothérapie adjuvante permettait de réduire le risque de décès à 15 ans (35,9 vs 30,5 %, p < 0,0002)(3). Dans les cancers du sein gauche, cette radiothérapie adjuvante post-tumorectomie gauche conduit cependant à une irradiation cardiaque.
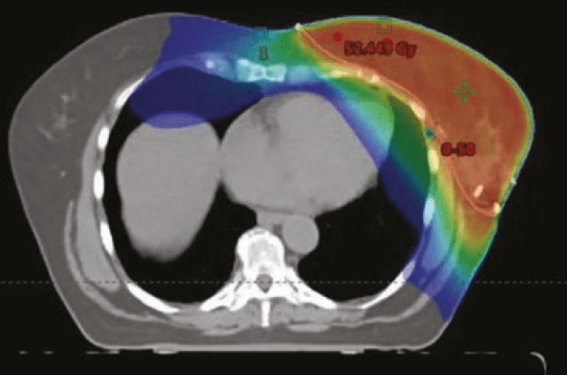
Il existe deux techniques différentes : la radiothérapie 3D dite « classique » (RT3D) et la radiothérapie conformationnelle en modulation d’intensité (RCMI). La RT3D emploie 2 faisceaux obliques tangentiels, placés en dosimétrie directe (figure 1), de manière à irradier la totalité du sein. La dose maximale reçue par le cœur peut parfois atteindre 50 Gy focalement dans la partie postérieure des faisceaux tangentiels. Celle-ci couvre assez souvent une minime frange de la partie antérieure du cœur incluant notamment l’interventriculaire antérieure. La dose moyenne au cœur est généralement basse, autour de 3 Gy (vu que 80 % du volume cardiaque est totalement épargné). Cette technique reste la plus employée pour les irradiations de sein seul. La RCMI multiplie les portes d’entrée des faisceaux et module les faisceaux (figure 1) de manière à respecter des contraintes fournies a priori par le radiothérapeute. Elle induit généralement une irradiation cardiaque plus importante en volume que la RT3D, mais permet d’éviter les points chauds (forte dose focale) (figure 2). La dose moyenne peut atteindre 8-10 Gy (vu qu’un volume plus important de cœur est irradié à faibles doses).
Figure 1. Comparaison entre dosimétrie directe et dosimétrie indirecte.
Figure 2. Comparaison de dosimétrie projetée sur scanner de simulation, chez 2 patientes irradiées au niveau du sein gauche exclusivement. En haut, traitement réalisé en radiothérapie conformationnelle (RT3D). En bas, traitement réalisé en radiothérapie conformationnelle avec modulation d’intensité (RCMI).
La RCMI est le standard actuel des irradiations adjuvantes incluant des aires ganglionnaires au vu de la meilleure couverture du volume-cible qu’elle permet d’obtenir, et compte tenu de publications récentes suggérant que l’irradiation de la chaîne mammaire interne augmente la survie liée au cancer du sein.
Par ailleurs, certains cancers du sein en situation adjuvante (qui présentent des surexpressions du récepteur au facteur de croissance épidermique) sont traités avec du trastuzumab, connu pour sa cardiotoxicité propre. L’essai HERA(4), évaluant le trastuzumab en situation adjuvante dans les cancers du sein a récemment fait l’objet de critiques concernant la cardiotoxicité rapportée. En effet, la cardiotoxicité était évaluée de manière globale dans cet essai, via la baisse de la fraction d’éjection et était imputée au trastuzumab, sans donnée concernant la radiothérapie adjuvante. La cardiotoxicité post-traitement adjuvant semble au minimum additive, voire supra-additive.
Localisations pulmonaires
La radio-chimiothérapie constitue la prise en charge initiale des cancers pulmonaires localement avancés inopérables. Du fait de la proximité du cœur avec les aires ganglionnaires ciblées, la partie cardiaque postérieure est généralement irradiée à relativement forte dose (la partie antérieure pouvant se retrouver irradiée en cas de proximité avec la tumeur initiale).
La radiothérapie stéréotaxique peut être utilisée à visée curative dans les tumeurs pulmonaires primitives de petite taille(5), ou dans les oligométastases pulmonaires. La dose délivrée est alors beaucoup plus forte, via quelques centaines de mini-faisceaux non coplanaires. L’épargne cardiaque peut être difficile à obtenir en cas de proximité avec le volume tumoral mais la dose moyenne est en générale faible.
Lymphomes hodgkiniens
La radiothérapie a longtemps été un standard de prise en charge initiale dans les lymphomes médiastinaux. Dans les lymphomes hodgkiniens, elle est actuellement surtout employée en clôture (post-chimiothérapie), où elle permet d’obtenir un bon contrôle tumoral. L’importance du volume à irradier, volontiers médiastinal, impose la recherche d’un compromis couverture-épargne cardiaque.
• De nombreux cancers de la région thoracique sont traités par radiothérapie, induisant une irradiation cardiaque non souhaitée, chez plusieurs dizaines de milliers de patients annuellement en France.
• Les nouvelles techniques de radiothérapie peuvent parfois permettre de délivrer des doses moins élevées au cœur, au prix d’une augmentation de la dose moyenne.
Optimisation cardiaque en radiothérapie
Contrôle de la position cardiaque
De manière à diminuer la dose reçue par le cœur, la radiothérapie (particulièrement en sénologie) peut être délivrée en inspiration bloquée. L’apnée permet de s’affranchir des mouvements respiratoires.
L’inspiration profonde permet d’augmenter l’espace entre le cœur et le volume traité, réduisant les doses délivrées au cœur.
Plusieurs études ont montré une diminution de la dose moyenne cardiaque post-irradiation mammaire (- 50 %), quelle que soit la technique de radiothérapie utilisée(6,7). De même, la dose délivrée à l’interventriculaire antérieure est réduite (-10 % environ)(8). Mast et coll.(9) ont montré, dans une étude prospective, que l’asservissement respiratoire était associé à une moindre augmentation de la charge calcique à distance de la radiothérapie.
De la même manière, toujours en sénologie, la radiothérapie peut être également délivrée en décubitus latéral ou même ventral(10), avec des résultats plus modestes en termes d’épargne cardiaque.
Optimisation technologique : proton-thérapie
Les protons ont l’avantage balistique d’avoir une décroissance rapide de la dose délivrée en fin de parcours, plus nettement que les photons.
En sénologie, cet avantage permet d’arrêter le volume irradié à forte dose au niveau de la paroi postérieure du sein gauche, en évitant le cœur.
Peu répandus actuellement, ils nécessitent un appareillage technique plus complexe. Plusieurs études ont montré une meilleure épargne cardiaque dans les irradiations mammaires adjuvantes(11-13), avec une dose moyenne de l’ordre de quelques centiGy.
Complications cardiaques postradiothérapie
Physiopathologie
Les photons arrivant dans les cellules irradiées induisent une radiolyse de l’eau, produisant des radicaux OH· intracellulaires. Ces radicaux vont induire un stress oxydatif à l’échelle cellulaire, et des cassures d’ADN à l’origine d’un effet antitumoral. L’inflammation résultante de ce stress cellulaire et de la réparation de l’ADN va générer une réaction inflammatoire (à l’échelle du myocarde). Le recrutement capillaire de cellules inflammatoires et des cytokines (TNF, IL-1, IL-6, IL-8) va alors activer localement la coagulation, associée à des lésions endovasculaires(14,15).
À court terme, ces deux mécanismes (lésions endovasculaires et coagulation) vont être responsables des effets indésirables dits aigus, survenant jusqu’à 3 mois après la radiothérapie, généralement réversibles.
Ils associent myopéricardite « sèche » (par inflammation des feuillets péricardiques sans trouble de résorption), angor (par ischémie locale d’origine capillaire), troubles du rythme par hyperexcitabilité (par inflammation).
À long terme, l’association de lésions capillaires (radio-induites), des lésions ischémiques myocardiques résultantes, et de l’atteinte de la fonction coronaire (athérosclérose accélérée) peut causer les effets indésirables tardifs (figure 3). Les effets indésirables tardifs (au-delà de 3 mois post-radiothérapie, généralement plus tard) peuvent alors apparaître : péricardite exsudative (la fibrose péricardique diminuant la résorption) ou constrictive (par fibrose péricardique), infarctus segmentaire (par déstabilisation de plaques d’athérome coronaires), valvulopathies (par distension lente), et rythmopathies (par destruction ischémique lente des voies de conduction ou des nœuds).
Figure 3. Physiopathologie des effets cardiotoxiques d’une irradiation cardiaque.
Complications coronaires
Les complications coronaires sont actuellement les complications cardiaques les plus décrites et les mieux connues. Volontiers tardives, elles peuvent survenir des années après irradiation. L’étude rétrospective de Darby et coll.(2) a retrouvé une majoration du risque d’événement coronaire de 7,4 % par Gy de dose moyenne cardiaque, sans seuil, dans une cohorte cas-témoin de 2 168 patientes irradiées au niveau du sein gauche. Cet excès de risque commençait 5 ans après la radiothérapie, et se poursuivait au moins jusqu’à 30 ans post-radiothérapie. Quoique fortement critiquée lors de sa parution, cette étude fait désormais référence (des résultats similaires ayant été publiés depuis).
D’autres études plus récentes ont montré qu’après irradiation mammaire gauche, les plaques d’athérosclérose radio-induite se concentrent en réalité au niveau des parties distale et médiale de l’artère interventriculaire antérieure, et au niveau de la partie distale de l’artère diagonale(16). Les plaques retrouvées après radiothérapie sont plus riches en tissu conjonctif fibreux, et plus à risque de rupture que des plaques « normales ». L’artère interventriculaire antérieure est la plus responsable d’événements ischémiques considérés comme radio-induits dans cette indication.
La dose cardiaque moyenne est probablement inadaptée en cas d’irradiation cardiaque très inhomogène (une irradiation quasi-exclusive à très forte dose de la partie distale de l’interventriculaire antérieure donnera une dose moyenne cardiaque jugée « acceptable » mais sera pourtant très à risque de complications futures). Partant de ce principe, plusieurs auteurs ont proposé des modèles différents de prédiction de complications cardiaques, à partir de différentes cohortes, en comparant dose cardiaque, dose délivrée aux coronaires, etc.
Dans les lymphomes hodgkiniens par exemple, plusieurs modèles existent pour évaluer le risque de complications coronaires post-traitement. Hahn et coll.(17) ont récemment comparé plusieurs modèles de prédiction de toxicité dans une étude rétrospective d’un échantillon aléatoire de 125 patients. Concernant les 44 complications cardiaques retrouvées, 31 d’entre elles étaient coronaires, pour 3 péricardites, 6 troubles de la conduction, 1 valvulopathie, et 3 non spécifiées. Le meilleur modèle pour prédire les complications cardiaques (tout type) utilisait la dose cardiaque moyenne, l’homogénéité de la dose délivrée au cœur, l’âge du patient et son sexe (la dose délivrée aux artères coronaires n’étant pas significative). À l’inverse, dans une analyse en sous-groupe, le meilleur modèle pour prédire les complications coronaires utilisait le volume d’artère interventriculaire antérieure recevant 5 Gy, le volume d’artère circonflexe recevant 20 Gy, et l’âge du patient (la dose moyenne et le sexe n’étant alors pas significatifs). Hormis l’âge et le sexe, les facteurs de risque cardiovasculaires n’avaient pas de valeur prédictive.
Dans les cancers du poumon, Speirs et coll.(18) ont rétrospectivement évalué 416 patients qui étaient inclus dans un protocole d’escalade de dose (de 70 à 90 Gy), dans plusieurs essais différents : 19,3 % des patients ont présenté une toxicité cardiaque de grade III (27,5 % de toxicité de grade II). En analyse multivariée, le volume cardiaque recevant 50 Gy était associé avec une diminution de la survie globale. Utilisant les données de 112 patients issus des mêmes essais, Wang et coll.(19) ont retrouvé 26 complications cardiaques (9 péricardites, 7 ischémies, 12 arythmies). Chaque type de complications était rétrospectivement associé avec différentes sous-structures cardiaques (tableau).
Complications péricardiques
Les péricardites en phase aiguë sont probablement sous-évaluées. La clinique associe généralement une douleur thoracique avec sensation d’oppression et dyspnée. L’échographie cardiaque retrouve un épanchement péricardique peu abondant, d’origine inflammatoire.
La suspension de la radiothérapie pendant une semaine et la prescription d’anti-inflammatoires permettent généralement de passer l’épisode, avec une reprise de la radiothérapie au décours.
Cependant, toute interruption de radiothérapie doit être évitée dans la mesure du possible, du fait d’un effet délétère sur la survie sans progression.
Complications valvulaires
Les complications valvulaires précoces sont rares mais probablement mal recensées. Des insuffisances mitrale et aortique peuvent apparaître très tardivement, par distension de leurs anneaux fibreux (du fait de la fibrose myocardique). Leur atteinte est exceptionnellement symptomatique, le plus souvent à des phases très tardives. Leur prise en charge n’est pas spécifique.
Complications rythmiques
Il existe peu de données spécifiques concernant les troubles rythmiques radio-induits. Leur survenue signe généralement une fibrose des voies de conduction par atteinte microvasculaire, ou la destruction d’une structure critique.
• Après radiothérapie adjuvante mammaire gauche, le risque d’événements cardiovasculaires coronaires est lié à l’athérosclérose accélérée de l’interventriculaire antérieure et de la diagonale.
• Le risque de complications cardiovasculaires post-radiothérapie mammaire est lié à la dose moyenne cardiaque, avec une augmentation du risque de 7 % par Gy de dose moyenne supplémentaire, sans seuil.
• Des données concernant les sous-structures cardiaques ont émergé récemment et sont en évaluation.
• Des méthodes d’évaluation plus précoces sont actuellement à l’étude.
Évaluation précoce de la cardiotoxicité
Les complications cardiaques irréversibles surviennent relativement tardivement après irradiation. Un dépistage précoce pourrait permettre de mieux les prendre en charge.
L’évaluation de la fraction d’éjection du ventricule gauche s’est avérée insuffisante, car altérée trop tardivement(14). Elle peut même rester normale, réalisant un tableau d’insuffisance cardiaque à fraction d’éjection conservée, particulièrement après irradiation mammaire adjuvante, chez des patientes âgées(20).
Sawaya et coll.(21,22) ont publié des données prometteuses concernant l’échographie de contractilité. Dans leurs études, la contractilité longitudinale myocardique s’altérait précocement post-chimiothérapie et était prédictive d’une baisse de la fraction d’éjection à distance de la chimiothérapie (p = 0,0003), ce qui n’était pas le cas de la fraction d’éjection mesurée immédiatement post-chimiothérapie. La valeur-seuil était < 19 % (74 % des patients développant une altération de la fraction d’éjection avait un strain < 19 ). Des données similaires ont été rapportées concernant le trastuzumab(23). Erven et coll.(24) ont objectivé des altérations de la contractilité jusqu’à 14 mois post-radiothérapie mammaire gauche. Cependant, aucune étude publiée n’a à ce jour démontré un lien entre cardiotoxicité d’origine radique et événements cardiovasculaires à long terme.
La place de l’IRM cardiaque est en cours d’évaluation. Initialement prometteuse(25) car se corrélant avec des baisses de la fraction d’éjection, elle semble cependant moins sensible que l’échographie de contractilité(26). La scintigraphie cardiaque permet de détecter des défects de perfusion post-radiothérapie mammaire adjuvante(27). Le nombre de défects semble augmenter à distance de la radiothérapie (6, 12, 18, 24 mois : 27, 29, 38, 42 %). Sa valeur prédictive n’est pas connue.
Les marqueurs biologiques usuels semblent également avoir une valeur prédictive de cardiotoxicité post-chimiothérapie. La troponine a été évaluée par Cardinale et coll.(28). Une élévation de troponine était retrouvée chez 32 % des patientes, et était associée à une baisse ultérieure de la fraction d’éjection. Une troponine ultrasensible de plus de 30 ng/ml était associée à une cardiotoxicité ultérieure (cardiomyopathie, réduction de la fraction d’éjection de plus de 10 % à moins de 55 % ou de 5 % à moins de 55 % et associée à des symptômes).
Il n’existe actuellement aucun standard de détection précoce d’une cardiotoxicité post-radiothérapie ou post-chimiothérapie, du fait d’un manque de suivi à long terme dans la plupart des études.
• L’échographie de contractilité retrouve des altérations significatives post-chimiothérapie et post-radiothérapie mammaire. Sa valeur prédictive d’événements cardiovasculaires à long terme n’a pas encore été évaluée.
• Les marqueurs biologiques, la scintigraphie cardiaque, l’IRM cardiaque sont encore en cours d’évaluation.
• Aucune méthode d’évaluation précoce de la cardiotoxicité n’est validée en pratique clinique à ce jour.
Perspectives médicamenteuses
Gulati et coll.(29) ont réalisé un essai randomisé de phase 3 pour évaluer le bénéfice apporté par le candésartan, associé ou non au métoprolol chez des femmes ayant reçu un traitement adjuvant potentiellement cardiotoxique pour un cancer du sein (radiothérapie, trastuzumab...). Le candésartan semblait protecteur, sans interaction avec le métoprolol. La baisse de la fraction d’éjection, mesurée par IRM, était de 2,6 % dans le groupe traité par placebo, pour 0,8 % dans le bras traité par candésartan. Les données de long terme sont attendues.
Un autre essai randomisé est en cours, mené par Guglin et coll. Il évalue l’apport du lisinopril concomitamment au trastuzumab en situation adjuvante. La fraction d’éjection, évaluée par échographie ou scanner, est le critère de jugement principal. D’autres classes thérapeutiques (statines, bêtabloquants) sont actuellement également en cours d’évaluation.
En pratique
La radiothérapie est un standard de prise en charge dans de nombreuses localisations thoraciques.
Du fait des bons résultats obtenus en termes de contrôle local et général, les complications cardiaques qu’elle peut induire sont désormais une priorité de prise en charge.
Les complications tardives sont dominées par les complications coronaires, liées à une athérosclérose accélérée.
Une coopération étroite entre radiothérapeutes et cardiologues est nécessaire pour une meilleure prise en charge des patients.
Références sur demande à la rédaction : biblio@axis-sante.com
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :