Explorations-Imagerie
Publié le 10 oct 2017Lecture 13 min
Complications cardiaques de la radiothérapie : rôle de l’imagerie
Bruno GALLET, Service de cardiologie, Centre hospitalier Victor Dupouy, Argenteuil
La radiothérapie thoracique améliore le pronostic des patients auxquels elle est appliquée, mais au prix de possibles complications cardiaques qui représentent la première cause non cancérologique de décès dans cette population. Ces complications sont multiples et souvent associées chez un même patient. Leur diagnostic repose sur une imagerie multimodalités où l’échographie est l’examen de première intention. Leur dépistage est indispensable et un consensus d’experts publié en 2013 en a précisé les modalités : surveillance clinique annuelle, complétée par un échocardiogramme et la recherche d’une maladie coronaire à partir de la 5e ou 10e année suivant l’irradiation et répétée tous les 5 ans(1).
Généralités
Les complications de la radiothérapie sont généralement retardées de plusieurs années, voire de plusieurs dizaines d’années, par rapport au traitement. Leur prévalence est classiquement de l’ordre de 10 à 30 % dans les 5 à 10 ans suivant l’irradiation, mais elle est en réalité mal connue avec les modalités modernes de radiothérapie ayant pour but de les limiter. Elles sont associées à un mauvais pronostic, puisque la mortalité cardiaque est la première cause non cancérologique de décès chez les patients ayant eu une radiothérapie thoracique. Les cancers en cause sont principalement les lymphomes et les cancers du sein (gauche plutôt que droit), mais il peut également s’agir de cancers du poumon, de l’œsophage, ou de thymomes.
Les facteurs favorisant ces complications doivent être connus car leur présence incite à un dépistage plus précoce. Ils sont indiqués dans le tableau 1. Ils comportent l’importance de la dose reçue (totale et fractionnée), le siège de l’irradiation, l’absence de protection, le volume cardiaque irradié, l’existence d’une extension tumorale intracardiaque ou paracardiaque, l’association à une chimiothérapie notamment par anthracyclines, l’existence de facteurs de risque conventionnels ou d’une cardiopathie préexistante, le jeune âge lors de l’irradiation et le délai écoulé depuis celle-ci.
Les complications cardiaques de la radiothérapie peuvent concerner l’ensemble des structures cardiaques : péricarde, myocarde, valves, artères coronaires, aorte ascendante et troncs supra-aortiques, tissu de conduction. Un point important est que ces complications peuvent assez fréquemment s’associer chez un même patient.
Complications péricardiques
Leur présentation clinique est variable. La péricardite aiguë en cours de radiothérapie est rare. Elle est plus fréquemment retardée de quelques semaines avec une régression souvent lente. La péricardite chronique tardive survient jusque chez 20 % des patients dans les 2 ans suivant l’irradiation. La péricardite chronique constrictive concerne 4 à 20 % des patients(1). Elle est souvent très retardée par rapport au traitement, avec un délai pouvant dépasser 10 ans. Le pronostic après péricardectomie est moins bon que pour les autres causes de constriction péricardique, en raison des autres complications de la radiothérapie qui lui sont fréquemment associées, et notamment des atteintes myocardiques.
L’échographie est la méthode de première intention pour l’imagerie du péricarde. Elle est généralement suffisante pour faire le diagnostic d’épanchement, et le recours à l’imagerie de coupe n’est pas nécessaire, sauf si la question du diagnostic différentiel se pose entre épanchement et graisse péricardique. L’échographie est en revanche insuffisante pour l’analyse morphologique du péricarde, et le diagnostic d’épaississement ou de calcifications péricardiques fait appel à l’imagerie de coupe. Le diagnostic de péricardite constrictive, qui s’appuie sur des données morphologiques et fonctionnelles, repose sur un faisceau d’arguments en échocardiographie, qui sera toujours complétée par une imagerie de coupe.
En échocardiographie « statique », les anomalies morphologiques évocatrices de péricardite constrictive sont un épaississement du péricarde (dont le diagnostic est difficile), une dilatation des oreillettes, une dilatation de la veine cave inférieure et des veines sus-hépatiques (figure 1), et parfois la présence d’épanchements (pleural ou péritonéal).
Figure 1. Dilatation de la veine cave inférieure à 26 mm en expiration avec réduction de son collapsus inspiratoire (< 50 %).
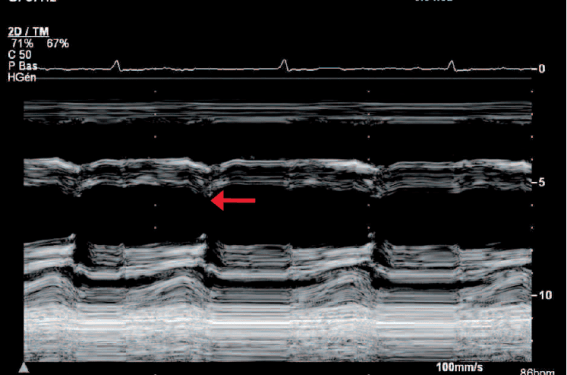
En échocardiographie « dynamique », les anomalies fonctionnelles évocatrices du diagnostic sont la présence de variations respiratoires de la taille du ventricule droit (augmentant en inspiration), la perte du collapsus inspiratoire normal de la veine cave inférieure, la présence d’un mouvement postérieur du septum en proto-diastole s’accentuant lors de l’inspiration (également appelé « septal bounce ») (figure 2), une rectitude de la paroi postérieure du ventricule gauche en diastole en mode TM (figure 2), et parfois une ouverture prématurée de la valve pulmonaire.
Figure 2. Dip septal postérieur protodiastolique en mode TM (→), associé à une rectitude du mouvement de la paroi inféro-latérale du ventricule gauche en diastole.
En Doppler, les signes évocateurs de constriction sont un aspect restrictif des flux mitral et tricuspide, la présence de variations respiratoires de l’onde E mitrale d’au moins 25 % (associées à des variations respiratoires de l’onde E tricuspide) (figure 3), un aspect d’adiastolie sur le flux d’insuffisance pulmonaire avec une réduction de son temps de demi-pression (qui n’est parfois visible que lors de l’inspiration) (figure 4), une onde e’ à l’anneau mitral d’amplitude conservée à plus de 8 cm/s mais avec un aspect d’« annulus reversus » (correspondant au fait que l’onde e’ septale est plus ample que l’onde e’ latérale contrairement à ce que l’on observe normalement), et une augmentation du reflux diastolique dans les veines sus-hépatiques lors de l’expiration.
Le recours à l’imagerie de coupe est indispensable lorsqu’une péricardite constrictive est suspectée. L’épaisseur du péricarde est anormale lorsqu’elle dépasse 4 mm.
Figure 3. Variations respiratoires de l’onde E du flux mitral, avec réduction de plus de 25 % de la vitesse de l’onde E en inspiration.
Figure 4. Aspect d’adiastolie sur le flux d’insuffisance pulmonaire avec annulation mésodiastolique du flux et temps de demi-pression très court, à 60 ms. Cet aspect est, ici, intermittent et n’apparaît que lors de l’inspiration.
Le scanner est la méthode de référence pour le diagnostic des calcifications péricardiques, qui sont visibles sans injection de produit de contraste, et qui sont présentes chez 50 % des patients ayant une constriction péricardique. Si ces anomalies morphologiques du péricarde sont suggestives du diagnostic, elles ne sont cependant pas spécifiques d’un diagnostic qui n’est pas exclusivement anatomique. Elles sont par ailleurs inconstantes, puisque près de 30 % des patients ayant une constriction péricardique chirurgicalement prouvée avaient une épaisseur péricardique normale en scanner dans une étude de la Mayo Clinic(2). L’IRM permet également une analyse morphologique du péricarde, mais les calcifications peuvent être manquées en IRM et leur diagnostic repose plutôt sur le scanner. Un épaississement du péricarde avec un rehaussement suivant l’injection de gadolinium témoigne d’une inflammation persistante (figure 5). Les autres signes pouvant être observés en imagerie de coupe sont une déformation tubulaire des deux ventricules, une dilatation bi-atriale, une dilatation de la veine cave inférieure et des veines sus-hépatiques, la présence d’épanchements (pleural ou péritonéal), l’absence de transmissions des pulsations cardiaques au parenchyme pulmonaire adjacent en scanner, une augmentation de l’interdépendance ventriculaire et un aspect de « septal bounce » en IRM.
Figure 5. Épaississement péricardique post-radique en IRM avec prise de contraste suivant l’injection de gadolinium.
(Remerciements : Dr Juliette Rousseau)
Complications myocardiques
Il peut s’agir d’une myocardite aiguë, d’une fibrose myocardique diffuse tardive et, au maximum, d’une cardiomyopathie restrictive secondaire à la fibrose et responsable d’une dysfonction diastolique sévère et d’une insuffisance cardiaque.
En échographie, on peut observer des troubles de la cinétique segmentaire (qui ne sont pas spécifiques d’une maladie coronaire), des signes de dysfonction diastolique et systolique.
L’analyse de la fonction diastolique repose sur les paramètres habituels (flux mitral, flux veineux pulmonaire, Doppler tissulaire à l’anneau mitral). Les signes de cardiomyopathie restrictive associent une dilatation atriale contrastant avec des ventricules non dilatés (figure 6), un flux mitral restrictif, et une réduction de l’onde e’ à l’anneau mitral (contrairement à ce que l’on observe en cas de péricardite constrictive). Le diagnostic différentiel entre cardiomyopathie restrictive et péricardite constrictive est d’autant plus difficile que les deux affections peuvent s’associer après radiothérapie thoracique. Les arguments échographiques orientant vers une cardiomyopathie restrictive plutôt que vers une péricardite constrictive sont l’absence de variations respiratoires de la taille du ventricule droit, l’absence de variations respiratoires des flux mitral et tricuspide, l’existence d’une hypertension pulmonaire, la réduction de l’onde e’ à l’anneau mitral, un reflux diastolique dans les veines sus-hépatiques majoré lors de l’inspiration (et non lors de l’expiration), et l’absence d’anomalie morphologique du péricarde. L’imagerie de coupe est indispensable pour ce diagnostic différentiel. L’absence d’anomalie morphologique du péricarde oriente vers une cardiomyopathie restrictive, alors qu’une épaisseur > 4 mm évoque une péricardite constrictive. Un aspect de fibrose myocardique diffuse en IRM est au contraire en faveur d’une cardiomyopathie restrictive. Le recours au cathétérisme reste souvent nécessaire dans les cas difficiles. La constatation d’une dysfonction systolique du ventricule gauche est plus rare et plus tardive. Son diagnostic repose classiquement sur la mesure de la fraction d’éjection, mais la définition de la cardiotoxicité basée sur la mesure de la fraction d’éjection est variable dans la littérature(1). De plus, la mesure de la fraction d’éjection ne permet pas un diagnostic précoce de dysfonction systolique, et a une mauvaise reproductibilité. La mesure du strain longitudinal global est au contraire une technique reproductible à condition d’utiliser la même plateforme échographique, et elle semble prometteuse dans cette situation pour le diagnostic précoce d’une dysfonction systolique. Il a été montré que le strain longitudinal global était diminué chez les patients irradiés pour maladie de Hodgkin en comparaison d’un groupe témoin, et que la réduction était plus marquée chez les patients ayant reçu des anthracyclines en plus de la radiothérapie(3). Le strain est également diminué chez les patientes irradiées pour un cancer du sein, mais uniquement en cas de cancer du sein gauche, et cette réduction apparaît immédiatement après la radiothérapie(4).
L’IRM a un rôle important dans l’imagerie des atteintes myocardiques. Elle est indispensable au diagnostic de myocardite et de fibrose. Le rehaussement tardif après injection de gadolinium permet le diagnostic de fibrose localisée, et la technique du T1 mapping permet le diagnostic de fibrose diffuse. L’IRM est également utile pour la simple évaluation de la fonction cardiaque chez les patients non échogènes. Le scanner a peu d’indications dans cette situation, hormis l’évaluation de la fonction cardiaque chez des patients non échogènes et ayant une contre-indication à l’IRM.
Figure 6. Cardiomyopathie restrictive en IRM avec dilatation des oreillettes, contrastant avec des ventricules de taille normale.
(Remerciements : Dr Juliette Rousseau)
Valvulopathies post-radiques
Elles se manifestent par un épaississement, une fibrose et des calcifications valvulaires. Elles concernent principalement les valves du coeur gauche, et sont plus souvent fuyantes que sténosantes. En cas de sténose, la valve aortique est préférentiellement concernée (figure 7), et le rétrécissement aortique représente la principale indication opératoire en cas de valvulopathie postradique(5). Dans la série de M.C. Hull et coll. portant sur 415 patients irradiés pour maladie de Hodgkin, l’incidence des valvulopathies cliniquement significatives, 20 ans après la radiothérapie, était de 6 %(6).
En échographie, elles se manifestent par un épaississement fibreux ou des calcifications, qui concernent la valve aortique, la membrane aorto-mitrale, l’anneau mitral, la partie basale et moyenne des valves mitrales. En revanche, la partie apicale des feuillets mitraux est épargnée de même que les commissures, ce qui permet le diagnostic différentiel avec une sténose mitrale rhumatismale.
Le diagnostic différentiel de ces valvulopathies postradiques comporte les valvulopathies des insuffisants rénaux, les valvulopathies médicamenteuses et la sténose mitrale rhumatismale (dont la sténose post-radique se distingue par l’absence de fusion commissurale et la présence de calcifications de la membrane aortomitrale)(1,5). Un dépistage échographique de ces valvulopathies est justifié 5 à 10 ans après l’irradiation, puis tous les 5 ans par la suite.
Figure 7. Rétrécissement aortique post-radique moyennement serré (vitesse maximale Vmax = 3,1 m/s ; gradient moyen = 21 mmHg, surface calculée à 1,45 cm2).
Maladie coronaire post-radique
Elle se manifeste par un athérome accéléré chez un sujet jeune, et concerne classiquement les ostia coronaires et la partie proximale des artères épicardiques. Elle est aggravée par les facteurs de risque conventionnels associés. L’incidence des atteintes coronaires cliniquement significatives, 20 ans après la radiothérapie, était de 10 % dans la série de M.C. Hull et coll.(6). Après irradiation pour cancer du sein, le risque d’événements coronaires majeurs augmente dans les 5 ans suivant le traitement et se poursuit durant 20 ans. Il est d’autant plus important qu’il s’agit d’un cancer du sein gauche, que la dose reçue est importante, et qu’il existe des facteurs de risque traditionnels ou des antécédents personnels de maladie coronaire(7).
Un dépistage de cette atteinte coronaire est justifié 5 à 10 ans après le traitement, puis tous les 5 ans par la suite. Concernant les méthodes de dépistage, l’étude, de P.A. Heidenreich et coll. a comparé l’intérêt de l’échographie de stress (essentiellement échographie d’effort), et de la scintigraphie dans une population de patients ayant été irradiés pour maladie de Hodgkin(8). L’échographie de stress montrait l’apparition d’une asynergie chez 5 % des patients, et la scintigraphie l’apparition d’une hypoperfusion chez 12 % d’entre eux. Cependant, la scintigraphie n’avait une spécificité que de 11 %, alors que celle de l’échographie de stress était de 89 % pour une sensibilité comparable. Ce manque de spécificité de la scintigraphie pourrait s’expliquer par le fait que la présence de défauts de perfusion ne traduit pas nécessairement une atteinte des artères épicardiques, mais pourrait s’observer également en cas de maladie des petits vaisseaux, de dysfonction endothéliale ou d’atteinte myocardique.
Les avantages et les inconvénients des différentes méthodes de diagnostic de la maladie coronaire sont indiqués dans le tableau 2. L’ECG d’effort conventionnel a une précision diagnostique insuffisante dans cette population qui comporte beaucoup de femmes. L’échographie de stress est une méthode largement disponible, non irradiante, et ayant une bonne spécificité. La scintigraphie a les inconvénients d’être irradiante et d’avoir une spécificité insuffisante. Le coroscanner a une sensibilité élevée et est utile pour écarter un diagnostic de maladie coronaire, mais c’est une méthode irradiante et nécessitant un produit de contraste iodé. L’IRM de stress est non irradiante, mais sa disponibilité reste encore limitée. Quant à la coronarographie, elle est bien entendu inadaptée à un dépistage.
Il apparaît donc que l’échographie de stress, et notamment d’effort, semble se positionner assez favorablement pour le dépistage de la maladie coronaire dans cette population, mais ce seront finalement les disponibilités et l’expertise locale qui orienteront souvent le choix de la méthode.
Atteintes de l’aorte ascendante et des troncs supra-aortiques
L’atteinte de l’aorte ascendante peut réaliser au maximum une « aorte porcelaine », dont le diagnostic repose sur le scanner. Son dépistage est indispensable si une chirurgie cardiaque est envisagée chez un patient ayant eu une radiothérapie thoracique. Une visualisation des artères mammaires internes a également été conseillée avant pontage aorto-coronaire pour détecter une fibrose post-radique pouvant les rendre inutilisables(9). La découverte de ces lésions peut conduire à modifier la stratégie de prise en charge (réalisation d’angioplasties coronaires au lieu de pontages aorto-coronaires, indication d’un TAVI au lieu d’un remplacement valvulaire aortique chirurgical). Les résultats de la chirurgie cardiaque étant moins bons chez les patients irradiés, les indications doivent en être portées de façon particulièrement prudente dans cette population(10).
L’atteinte des troncs supra-aortiques concernait 7 % des patients 20 ans après irradiation dans la série de M.C. Hull et coll.(6). Elle est dépistée par le Doppler, qui est indiqué en cas de souffle cervical, d’accident ischémique transitoire ou constitué, ou de la mise en évidence d’une atteinte artérielle dans un autre territoire.
Recommandations
Un consensus d’experts de l’EACVI et de l’ASE a été publié en 2013. Ce consensus recommande une évaluation clinique et échocardiographique complète avant irradiation thoracique (tableau 3).
Au décours du traitement, une évaluation clinique cardiologique annuelle est recommandée, comportant un dépistage et une correction des facteurs de risque conventionnels, ainsi que la recherche de signes pouvant évoquer une complication de la radiothérapie (apparition d’un souffle, d’un angor, d’une insuffisance cardiaque, de symptômes neurologiques, de troubles de conduction).
Si des anomalies sont constatées, elles conduiront à une échographie, complétée par d’autres méthodes d’imagerie en fonction de la situation clinique (imagerie de coupe en cas de suspicion d’atteinte péricardique, imagerie coronaire en cas de suspicion de cardiopathie ischémique, Doppler en cas d’atteinte des troncs supra-aortiques). En l’absence de symptômes et de signes anormaux, une échographie systématique est indiquée dans un délai de 5 à 10 ans après l’irradiation (délai de 5 ans en cas de risque important défini par une irradiation antérieure ou thoracique gauche associée à au moins un des facteurs de risque indiqués dans le tableau 1, et délai de 10 ans dans le cas contraire). Un dépistage systématique de la maladie coronaire par un test non invasif est également indiqué après 5 à 10 ans chez les patients à risque élevé. En l’absence d’anomalie de ces tests, ils seront répétés tous les 5 ans.
IC = insuffisance cardiaque, IRM = imagerie par résonance magnétique, PCC = péricardite chronique constrictive, TDM = tomodensitométrie, TSA = troncs supra-aortiques, VG = ventricule gauche.
En conclusion
L’échographie est la technique d’imagerie de première intention en cas de suspicion de complication cardiaque de la radiothérapie.
En fonction du contexte, elle sera complétée, si besoin, par un scanner (recherche de calcifications péricardiques ou d’une aorte porcelaine) et/ou une IRM (bilan d’une myocardite et recherche de fibrose).
Le dépistage de la maladie coronaire peut faire appel à l’échographie de stress ou éventuellement à l’IRM de stress ou au coroscanner, alors que la scintigraphie manque de spécificité dans cette situation.
La meilleure stratégie de dépistage reste encore à évaluer, et des études prospectives sur le sujet sont nécessaires. Elles devront comporter un nombre important de patients ayant eu une évaluation basale avant traitement, avec un suivi prolongé compte tenu du délai souvent très tardif des complications, et une évaluation économique des stratégies proposées.
"Publié dans EchoCardiographie"
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :