Valvulopathies
Publié le 15 jan 2017Lecture 11 min
La surface valvulaire dans le rétrécissement aortique
M.-A. ISORNI, Centre chirurgical Marie-Lannelongue, Le Plessis-Robinson
Le rétrécissement aortique est la pathologie valvulaire la plus fréquente dans la population caucasienne et est un motif courant de consultation et d’hospitalisation. Son évaluation paraclinique de sa sévérité repose sur des critères simples, essentiellement échographiques, quantifiables en routine.
Parmi eux, la surface aortique est un paramètre très utilisé en pratique courante car relativement accessible et lisible. Cette facilité ne doit pas nous faire oublier les nuances qui accompagnent son interprétation, ni les autres critères d’évaluation. C’est en effet un faisceau d’arguments concordants qui permettra la prise en charge la plus adaptée de ces patients.
Le rétrécissement aortique est la pathologie valvulaire la plus fréquente dans la population caucasienne. Sa prévalence est de 1,2 à 1,8 % chez les patients de 65 à 74 ans et de 4,1 à 5,2 % chez les personnes ≥ 75 ans(1). Dans l’étude européenne TROMSO, la prévalence était de 9,8 % et l’incidence de 4,9 ‰ pour une cohorte âgée de 80 à 89 ans(2). Son évolution conduit à la calcification focale, à l’épaississement des valvules et finalement à la réduction de la surface d’ouverture de la valve. Si cette surface d’ouverture est < 1,0 cm2 (0,6 cm2/m2), les recommandations actuelles considèrent que le rétrécissement aortique devient alors serré(3,4). En l’absence de traitement préventif, il est ainsi essentiel de dépister ces patients afin de leur proposer un traitement curatif avant la survenue de complications.
À la surface
La surface aortique peut être estimée de différentes façons ; selon la technique choisie elle est alors anatomique, fonctionnelle ou hémodynamique. La mesure directe, anatomique, de l’ouverture de la valve correspond à la surface aortique géométrique. L’évaluation de la surface minimale du flux aortique convergeant depuis la chambre de chasse puis s’écoulant à travers la valve, estime la surface aortique efficace. Enfin, la mesure des gradients de pressions en amont de la valve, au niveau de la valve et en aval de la valve permet d’estimer la surface hémodynamique ou surface de Gorlin.
La surface aortique géométrique
La planimétrie consiste à délimiter le périmètre de l’orifice valvulaire aortique sur une image fixe obtenue pendant la systole ventriculaire. Initialement mesurée lors de l’échographie cardiaque, cette méthode a ensuite été appliquée au scanner et à l’IRM cardiaque.
L’échographie cardiaque
La quantification de la surface aortique par visualisation directe de l’orifice valvulaire par échographie cardiaque, transthoracique ou transœsophagienne, a fait l’objet de nombreuses études(5-7). Au-delà de sa relative simplicité, cette méthode est limitée par les ombres et les réverbérations liées aux calcifications qui altèrent la netteté du pourtour de l’orifice valvulaire, et par les structures valvulaires non planes ou par les calcifications bourgeonnantes qui faussent l’estimation du plan valvulaire. Les études consacrées à l’application de l’échographie transœsophagienne et de l’échographie cardiaque 3D à la planimétrie ont des résultats discordants et confirment la limite technique que représentent les calcifications importantes(8).
Le scanner cardiaque
Du fait de ses excellentes résolutions temporelle et spatiale, le scanner est une technique particulièrement adaptée à la planimétrie. Les calcifications sont ici parfaitement appréhendées et ne constituent plus une limite à la définition de la surface valvulaire par planimétrie. Les études s’accordent sur la bonne reproductibilité de cette technique ; cependant, les surfaces ainsi obtenues sont supérieures à celles de l’équation de continuité avec des écarts pouvant atteindre 0,2 cm2(9,10). Les seuils recommandés, fondés sur des évaluations échographiques, ne sont dès lors pas transposables ici. Considérant cette limite, cette technique représente néanmoins une alternative en cas de discordance ou d’impossibilité d’estimer le flux transvalvulaire, bien qu’elle soit limitée par les rythmes irréguliers, en particulier en cas de fibrillation atriale.
L’IRM cardiaque
Les séquences en écho de gradient génèrent des images avec un excellent rapport signal/bruit, un contraste élevé entre le sang et le myocarde et une résolution comparable à celle de l’échographie transoesophagienne(11,12). L’IRM offre une visualisation complète de l’anatomie valvulaire, et permet une planimétrie directe de l’orifice valvulaire avec une très bonne reproductibilité(13-15). Cependant, les calcifications engendrent des turbulences responsables d’artefacts de flux et des volumes partiels limitant la précision des contours de la valve. De ce fait, les mesures deviennent d’autant moins fiables que la valve est calcifiée, dégradant la concordance avec la surface effective obtenue par échographie cardiaque(17,18). Enfin, les rythmes cardiaques irréguliers constituent, là également, un obstacle technique.
La planimétrie est une mesure séduisante car elle s’affranchit partiellement des conditions hémodynamiques. Cependant, la fiabilité et la reproductibilité de cette méthode sont directement corrélées à la résolution de l’imagerie utilisée, ainsi qu’à l’expérience du praticien qui doit tracer manuellement le périmètre de la valve.
Enfin, cette méthode permet une estimation anatomique de la surface aortique alors que c’est la surface fonctionnelle qui est prédictive d’évènement chez ces patients(19).
La surface aortique hémodynamique
L’approche hémodynamique est historiquement la première méthode à avoir quantifié la surface aortique par mesure du gradient de pression transvalvulaire par cathétérisme cardiaque. La localisation intraventriculaire, valvulaire, supravalvulaire ou intra-aortique du gradient repose sur les données de la courbe de retrait et de l’angiographie sélective. Le débit cardiaque est évalué par thermodilution ou par la méthode de Fick.
La formule de Gorlin
La formule de Gorlin a été la référence pour estimer la surface aortique. Elle applique entre la chambre de chasse et la vena contracta l’équation de Bernouilli qui transpose aux fluides le principe de conservation de l’énergie. Elle estime ainsi la surface efficace de la valve aortique par un ratio entre le flux de la valve et le gradient transvalvulaire maximal, à temps constant(20).
Les valeurs mesurées sont influencées par la surface de l’aorte ascendante mesurée au niveau de la jonction sino-tubulaire, avec pour conséquence des résultats discordants, particulièrement chez les patients ayant une aorte ascendante de petit diamètre(21-23). Elles sont également soumises aux conditions hémodynamiques, ce qui se traduit par des valeurs de surface erronées si le débit à travers la valve aortique est faible ou en cas de sténose modérée(24).
La formule de Hakki
La formule de Hakki est une version simplifiée de la formule de Gorlin qui permet d’obtenir des valeurs similaires, mais souffre des mêmes limites(25)
Le cathétérisme cardiaque rétrograde est une technique invasive associée à un nombre significatif d’accidents ischémiques limitant le recours à cette technique(25-27). Cependant, cette approche hémodynamique du rétrécissement aortique n’en reste pas moins pertinente. C’est ainsi que plusieurs études ont persisté en considérant que l’IRM cardiaque permet également d’évaluer les flux et les débits aortiques de façon non invasive. Appliquant les formules de Gorlin ou de Hakki, elles ont démontré une bonne corrélation avec la surface efficace, avec une surestimation de l’ordre de 0,1 cm2 par rapport aux mesures échographiques et hémodynamiques(28-30). Résultats qui doivent être confirmés par de plus larges études.
La surface aortique efficace
L’échographie cardiaque permet de mesurer la surface aortique efficace par application de l’équation de continuité. Cette méthode s’intéresse à la convergence du flux dans la chambre de chasse aortique et permet de quantifier la surface minimale d’écoulement du flux en aval de la valve aortique. Elle considère que les surfaces sont circulaires et nécessite la mesure du diamètre de la chambre de chasse aortique, de l’intégrale temps.vitesse du flux dans la chambre de chasse et de celle du flux transvalvulaire. La surface aortique ainsi obtenue est une surface fonctionnelle ; surface moyenne en systole, et s’oppose à la surface géométrique, anatomique, qui est un instantané, maximal en systole(30). Les valeurs des surfaces efficaces sont plus basses que celles estimées par cathétérisme interventionnel ; cependant, de nombreuses études confirment la pertinence de cette approche et le caractère prédictif de ces valeurs(32-35). Plusieurs approximations limitent néanmoins son application(36-48). Il est ainsi erroné de considérer la surface de la chambre de chasse aortique comme circulaire. L’expérience acquise avec l’imagerie des bilans de TAVI nous a appris que leur forme était elliptique, rendant leur estimation potentiellement hasardeuse. Les mesures peuvent, en outre, souffrir d’obstacles techniques responsables d’une variabilité interobservateur de 5 % à 8 %. Enfin, une sous-estimation ou surestimation de l’intégrale temps.vitesse dans cette fameuse chambre de chasse contribue à fausser les valeurs de la surface aortique. C’est pourquoi cette méthode est inadaptée aux rétrécissements aortiques en bas débit cardiaque et nécessite une grande rigueur dans sa méthodologie(39,40). À ce titre, l’exemple de l’équipe de la Mayo Clinic, qui pratique un recueil systématique du flux transaortique par toutes les voies, est éloquent.
Souffrant de nombreuses approximations, les recommandations actuelles ne considèrent pas cette méthode en première intention et précisent qu’elle ne peut suffire à estimer la sévérité d’un rétrécissement aortique. L’application de l’équation de continuité à l’IRM cardiaque a fait l’objet de plusieurs études qui montrent une bonne corrélation entre échographie et IRM. Cependant, les données actuellement publiées doivent être confortées avant d’envisager cette méthode comme une alternative(29,41,42).
Sous la surface
L’évaluation de la surface aortique permet donc plusieurs interprétations et autant de résultats différents. Ce critère ne saurait être suffisant et doit concorder avec d’autres critères pour définir la gravité d’un rétrécissement aortique.
Le Doppler
La vitesse maximale aortique et le gradient transvalvulaire aortique moyen sont les critères de référence selon les recommandations actuelles(3,4). La vélocité à travers la valve se mesure en Doppler continu, le gradient moyen en est dérivé par une extrapolation de la formule de Bernouilli. Ces paramètres sont prépondérants, à la fois en termes de reproductibilité et d’impact pronostique et suffisent à affirmer la sévérité d’un rétrécissement aortique. Un rétrécissement aortique sévère est alors défini par un pic de vitesse transvalvulaire (Vmax) > 4,0 m/s et par un gradient de pression moyen > 40 mmHg. De nombreux éléments peuvent cependant perturber l’analyse de ces flux à haute célérité. La qualité de la fenêtre acoustique et celle de l’alignement du tir Doppler sur le flux sont déterminantes pour l’obtention de mesures fiables. La qualité du signal pourra être optimisée par l’utilisation de la sonde Pedoff en raison de son rapport signal/bruit élevé. Enfin, une accélération du flux dans la chambre de chasse par un bourrelet septal ou par un mouvement systolique de la petite valve mitrale peuvent contribuer à fausser les valeurs obtenues(43-45).
L’IRM
Une première approche basique consiste à considérer un plan de coupe sur la chambre de chasse du ventricule gauche. Il est alors possible de mesurer la taille et l’extension du jet aortique dans l’aorte ascendante permettant alors une première évaluation. Mais les caractéristiques de cet examen lui permettent également d’analyser les flux transvalvulaires et les caractéristiques tissulaires myocardiques.
Étude des flux
L’IRM mesure le déphasage des protons en mouvement dans un champ magnétique par rapport aux protons statiques. Cette différence de phase est proportionnelle à leur vitesse et peut être estimée sur les séquences de contraste de phase(46). À la différence de l’échographie cardiaque et du cathétérisme interventionnel, l’IRM permet donc une quantification directe des vélocités sur les séquences en contraste de phase, sans approximation ni calcul, avec l’avantage d’une grande reproductibilité(41,47). Cependant, la résolution temporelle de l’IRM limite cette technique puisqu’elle est bien inférieure à celle du Doppler (de 25 à 45 ms contre 2 ms)(48). D’autre part, les flux turbulents génèrent des artefacts de flux et des volumes partiels qui conduisent à sous-estimer les vitesses par rapport à celles obtenues par Doppler, particulièrement lorsque celles-ci sont élevées (> 3,5 m/s)(49,50). C’est pourquoi les sociétés savantes européenne et américaine de cardiologie ne recommandent pas l’évaluation des flux par IRM cardiaque en première intention. L’utilisation de l’IRM est cependant légitime en cas de rétrécissement aortique avec bas débit et bas gradient pour les patients ayant une ectasie de l’aorte ascendante, ainsi que pour la détection de fibrose(3,4). Les avancées dans le domaine de l’IRM cardiaque laissent envisager une réponse à ces limites techniques par l’utilisation du 4D Flow. Cette séquence permet en effet de quantifier les volumes et les flux de n’importe quelle région d’intérêt. De nouveaux éléments pourront, en outre, être étudiés, tels que les flux turbulents ou la tension pariétale(51-53).
La fibrose endomyocardique
La fibrose endomyocardique est un des paramètres à considérer selon les recommandations actuelles. Elle est une conséquence de l’élévation de la post-charge relative au rétrécissement valvulaire, de l’hypertrophie compensatrice qu’elle induit et de la nécrose qui s’en suit. Elle se traduit par un remodelage pathologique et par une insuffisance cardiaque diastolique, aggravant le pronostic de ces patients. Cette fibrose est ainsi considérée comme un marqueur prédictif de sévérité de la maladie pouvant guider la prise en charge thérapeutique(54-56). La généralisation de nouvelles séquences telles que le T1 mapping promettent une meilleure compréhension de la maladie et une utilisation routinière de ce critère pour la prise en charge de ces patients(57-59).
Le scanner
Les premiers enseignements sémiologiques précisaient qu’il n’y avait pas de rétrécissement aortique serré sans calcifications visibles à la scopie. Ces calcifications aortiques sont toujours considérées comme un marqueur de gravité chez les patients asymptomatiques(60,61). Ce critère est particulièrement accessible au scanner cardiaque qui permet une étude quantitative, fiable et reproductible. L’examen est alors peu irradiant et ne nécessite pas de produit de contraste. Les recommandations américaines définissent ainsi un critère de gravité des calcifications aortiques pour un score d’Agatston > 1 000. Le scanner garde donc un rôle majeur dans l’évaluation des rétrécissements aortiques en apportant des informations anatomiques quant à la sévérité de la maladie et quant au pronostic de ces patients.
En pratique
Rapide, accessible et permettant une évaluation lisible de la sévérité d’un rétrécissement aortique, la surface aortique reste un paramètre largement utilisé dans la pratique courante. Pourtant, si nous considérons la surface aortique comme un critère de gravité, alors nous devrions préciser le type de surface utilisé et si ses limites ont été respectées.
Après quoi, cette méthode étant reléguée au titre de critère d’évaluation secondaire par les sociétés européennes et américaines de cardiologie, il conviendra de la confronter aux autres critères de gravité que sont l’évaluation des vitesses et des gradients.
Néanmoins, le débat relatif aux rétrécissements aortiques serrés avec bas débit/bas gradient et fraction d’éjection conservée, ainsi que les études contrastées qui ont suivi, nous a appris que ces critères pouvaient être pris en défaut. Souffrant de variabilités et de reproductibilités critiquables en pratique courante, ils sont focalisés sur l’analyse du flux transvalvulaire aortique et ne permettent qu’une appréciation partielle de cette pathologie.
En cas d’éléments discordants, il semble donc intéressant de considérer les autres aspects physiopathologiques du rétrécissement aortique dans le cadre d’une prise en charge multimodale tels que les calcifications aortiques où la fibrose endomyocardique. Ces éléments complémentaires permettent de dépasser les limites des mesures classiques tout en offrant une compré hension globale.
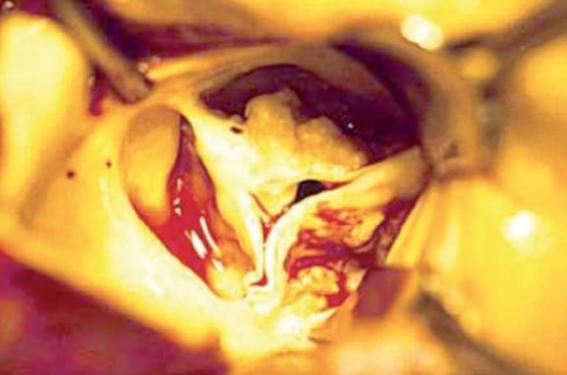
Figure 1. Vue peropératoire d’une valve aortique native tricuspide calcifiée.
Figure 2. Schéma des surfaces aortiques efficaces et géométriques.
Figure 3. Planimétrie par échographie transœsophagienne 2D sur valve aortique native tricuspide.
Figure 4. Planimétrie par scanner cardiaque sur valve aortique native tricuspide.
Figure 5. Planimétrie par IRM cardiaque sur valve aortique native tricuspide.
Figure 6. Courbe de retrait VG-Aorte, avec mise en évidence d’un gradient de pression valvulaire aortique.
Figure 7. Illustration de l’équation de continuité (issue des recommandations de la société européenne d’échographie).
Références sur demande à la rédaction : biblio@axis-sante.com
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :







