Insuffisance cardiaque
Publié le 14 mai 2013Lecture 15 min
La fréquence cardiaque - Un guide pour évaluer le pronostic et traiter l’insuffisance cardiaque
F. PICARD, C. LOIZEAU, M.-A. BILLÈS, P. DOS SANTOS
Les nouvelles recommandations de la Société européenne de cardiologie publiées en 2012 soulignent la valeur pronostique de la fréquence cardiaque (FC) dans l’insuffisance cardiaque systolique (ICS) chez les patients en rythme sinusal(1). Ainsi, au même titre que le rythme, la morphologie ou la largeur des QRS, il importe de prêter une attention particulière à la fréquence cardiaque (Recommandation de classe I et de niveau de preuve C). Celle-ci doit être mesurée sur un ECG 12 dérivations, sur un sujet au repos depuis au moins 5 minutes et dans un environnement calme.
Fréquence cardiaque et risque cardiovasculaire dans l’IC
En France, l’IC touche 1 million de personnes avec plus de 150 000 nouveaux cas par an. Elle est caractérisée par une lourde mortalité : plus de la moitié des personnes décèdent 5 ans après l’apparition des premiers symptômes. La prise en charge a progressé grâce à la découverte de nouveaux traitements, l’éducation des patients et au suivi pluridisciplinaire. Cependant, malgré les progrès, 30 % des patients décèdent dans l’année qui suit une hospitalisation.
L’IC représente d’ailleurs 10 % des patients hospitalisés, des séjours hospitaliers qui dépassent 10 jours et 20 % des patients réhospitalisés dans les 6 mois.
Les dépenses liées à l’hospitalisation représentent deux tiers du coût total de cette pathologie, soit 1 milliard d’euros (M. Galinier, ESC 2012).
Plusieurs études ont montré que la fréquence cardiaque est à la fois un facteur pronostique et un facteur de risque. Le ralentissement de la FC est associé à une diminution de la mortalité totale et de la mortalité cardiovasculaire(2). Ceci est vrai chez les patients ayant une maladie coronaire et chez ceux ayant une insuffisance cardiaque systolique. La fréquence cardiaque initiale est bien corrélée au pronostic : plus elle est élevée, moins bon est le pronostic.
La fréquence cardiaque apparaît donc comme un objectif thérapeutique dans l’insuffisance cardiaque.
Réduction de fréquence cardiaque et amélioration du pronostic
L’étude SHIFT évaluant l’intérêt de l’ivabradine dans l’insuffisance cardiaque systolique a inclus des patients symptomatiques d’IC (la moitié en classe fonctionnelle II et l’autre moitié en classe III à IV), ayant une FEVG < 35 %, en rythme sinusal et plutôt bien traités au regard des recommandations en vigueur (89 % des patients étaient sous β-bloquant, 56 % prenaient au moins la moitié de la dose cible de β-bloquant et 26 % des patients prenaient la dose cible). La FC des patients à l’inclusion était en moyenne de 80 bpm. L’adjonction d’ivabradine à ces patients déjà bien traités a permis de réduire de 18 %, par rapport au placebo, la survenue du critère primaire de jugement combinant la mortalité cardiovasculaire et les hospitalisations pour aggravation de l’insuffisance cardiaque. Parmi les critères de jugement secondaires, la mortalité pour insuffisance cardiaque était réduite de 26 % et les hospitalisations pour aggravation de l’IC étaient également réduites de 26 %(3).
Par ailleurs, dans deux autres études ancillaires de SHIFT, l’adjonction d’ivabradine à un traitement bien conduit, chez des patients symptomatiques et stables, a permis d’améliorer la qualité de vie et de favoriser un remodelage ventriculaire gauche inverse, lui-même corrélé à l’amélioration du pronostic. Depuis ces résultats, les recommandations européennes de 2012 préconisent l’utilisation de l’ivabradine chez les patients en rythme sinusal (RS) qui conservent une FC ≥ 70 bpm malgré un traitement β-bloquant bien conduit (recommandation IIa, niveau de preuve B), ou qui ne tolèrent pas les β-bloquants (recommandation IIb, niveau de preuve C).
Depuis cette étude, qui a testé l’effet d’une molécule dotée d’un effet bradycardisant et dépourvue d’autre effet hémodynamique, nous portons un regard nouveau sur l’impact de la prise en compte de la fréquence cardiaque pour l’optimisation du traitement pharmacologique. Les résultats obtenus à partir des données recueillies dans le groupe placebo de l’étude SHIFT (figure 1) confirment sans conteste qu’une fréquence cardiaque élevée est un marqueur de risque d’événements cardiovasculaires chez les patients souffrant d’ICS(4).
Figure 1. Étude SHIFT : données du groupe placebo. Plus la FC en RS au repos est rapide, plus l’occurrence du critère primaire de jugement combinant mortalité cardiovasculaire et hospitalisation pour aggravation de l’IC est élevée. La divergence des courbes s’observe dès le 1er mois. Ces résultats confirment qu’une fréquence cardiaque élevée est un marqueur de risque de morbi-mortalité chez les patients souffrant d’ICS. D’après(4).
La comparaison des données obtenues dans le groupe placebo avec celles obtenues dans le groupe traité par un agent bradycardisant « pur », fournit des arguments solides pour faire passer la constatation d’une FC de repos élevée chez un patient souffrant d’ICS du rang de marqueur à celui de facteur de risque. Une action thérapeutique ciblant spécifiquement sa réduction diminue la survenue des événements cardiovasculaires. Les résultats obtenus dans le groupe traité par ivabradine montrent que le pronostic est corrélé au niveau de la FC atteint après 28 jours de traitement (figure 2) : les patients ayant une FC < 60 bpm sont ceux ayant le meilleur pronostic.
Figure 2. Étude SHIFT : plus la fréquence cardiaque est réduite par l’ivabradine, meilleur est le pronostic. D’après(4).
Dans un article récent, les investigateurs de SHIFT montrent plus précisément que le bénéfice du traitement est bien lié à l’amplitude de la réduction de la FC par rapport à son niveau mesuré avant la mise sous traitement, aussi bien chez les patients les plus tachycardes (FC > 75 bpm) que chez ceux ayant une FC moins élevée (figure 3). Le pronostic diffère selon que la FC est diminuée de 5 ou 10 bpm par rapport à son niveau de base(5).
Figure 3. Bénéfice de l’ivabradine sur le critère primaire compo - site en fonction de l’importance de la réduction de la FC obtenue à J28, chez les patients ayant une FC de base > ou < à 75 bpm. D’après(5).
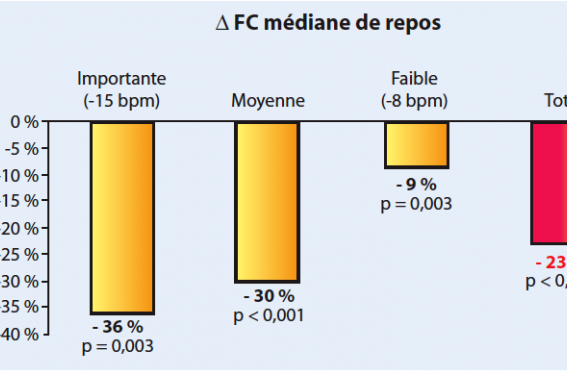
L’amélioration du pronostic en fonction de la baisse de la FC est également retrouvée dans les études portant sur les β-bloquants. Dans une métaanalyse publiée en 2009, on note que la réduction de la mortalité toutes causes est corrélée à l’amplitude de la baisse de la FC obtenue sous traitement(6). Ainsi, la mortalité est réduite de 36 % lorsque l’on obtient une diminution de la FC de plus de 15 bpm alors qu’elle ne baisse que de 9 % lorsque cette FC ne diminue que de 8 bpm par rapport à sa valeur de base (figure 4).
Figure 4. Amélioration du pronostic en fonction de la baisse de FC obtenue sous bêtabloquant. D’après(6).
Dans une autre métaanalyse portant sur près de 23 000 patients inclus dans 35 essais, les auteurs retrouvaient une relation forte entre la diminution de la FC sous β-bloquant et la réduction de la mortalité toutes causes(7). On notait également une corrélation étroite entre réduction de FC et amélioration de la FEVG sous traitement. Faire baisser la FC des patients souffrant d’IC permet de réduire la consommation en oxygène du cœur, d’améliorer son remplissage et sa perfusion en augmentant la durée de la diastole, de favoriser un remodelage inverse en réduisant les volumes ventriculaires et en améliorant la FEVG, et de diminuer le risque d’ischémie(8).
En pratique, même si ce chiffre n’apparaît pas clairement dans les recommandations, les données présentées sur la figure 2 suggèrent qu’il faut cibler une FC voisine de 55 à 60 bpm.
Bénéfice de la réduction de FC pour toutes les formes d’IC ?
Les résultats du programme CHARM (figure 5), qui a évalué l’impact du traitement par le candésartan sur le pronostic de patients souffrant d’insuffisance cardiaque systolique ou d’insuffisance cardiaque à fraction d’éjection peu altérée (ICFEP), suggèrent qu’une fréquence cardiaque élevée chez des patients en rythme sinusal est un marqueur de risque indépendant de mortalité, et cela quelle que soit la valeur de la FEVG(9).
Figure 5. Programme CHARM : relation entre FC à l’inclusion en 3 tertiles et pronostic en cas d’ICS (rouge) et d’IC à FEVG peu altérée (bleu). A : mortalité toutes causes. B : mortalité CV et hospitalisation pour aggravation de l’IC. D’après(7).
Les 7 597 patients du programme CHARM ont été séparés en 3 tertiles en fonction de leur FC à l’inclusion : T1 FC moyenne à 60 bpm (57-64), T2 FC moyenne à 72 bpm (70-75) et T3 FC moyenne à 85 bpm (80-91). Dès le 2e mois, les courbes de survie divergent et montrent un meilleur pronostic des patients les moins tachycardes à l’entrée dans l’étude.
Comme évoqué plus haut, ce programme a inclus des patients avec une FEVG peu altérée (FEVG > 40 % dans la définition de CHARM). Dans ce groupe de patients, la FC d’inclusion a également valeur pronostique. Les patients du T1 sont ceux qui ont le risque de morbi-mortalité le plus faible, même si la relation FC-pronostic est moins marquée que dans l’ICS. En considérant la FC comme une donnée linéaire, toute augmentation de la FC de 10 bpm augmente le risque de mortalité de 7 % en cas d’ICS et de 6 % en cas d’ICFEP.
Une autre étude rétrospective observationnelle a rapporté en 2010 des résultats similaires avec un impact pronostique de la FC initiale chez 685 patients consécutifs souffrant d’ICFEP(10). Néanmoins, ces études n’ont actuellement qu’une portée limitée car elles sont rétrospectives et non randomisées. De plus, la définition employée pour y définir l’ICFEP reste fluctuante. Rappelons enfin que les β-bloquants, même s’ils sont utilisés régulièrement, n’ont pas réellement de recommandation dans cette forme d’IC puisque l’étude SENIORS avec le nébivolol n’avait pratiquement pas inclus de patients souffrant véritablement d’ICFEP (très peu de patients avec une FEVG ≥ 50 %).
Si un traitement bradycardisant est bien susceptible d’améliorer le remplissage ventriculaire chez les patients souffrant d’ICFEP, il n’existe à ce jour aucune preuve formelle pour en valider l’indication.
Absence de bénéfice de la réduction de la FC en cas de FA ?
Il est intéressant de signaler que, dans l’étude CHARM déjà citée, la FC à l’inclusion n’avait de valeur pronostique que dans le groupe de patients en rythme sinusal. Pour les 15 % de patients en FA à l’inclusion, le lien entre FC initiale et mortalité n’était pas retrouvé, même s’il est par définition difficile de déterminer clairement une FC moyenne chez des patients en FA(9). En fait, la fréquence cardiaque en FA ne traduit pas forcément le niveau de stimulation neurohormonale et, à l’inverse, une FC basse peut traduire une altération plus marquée des voies de conduction qui pourrait être de plus mauvais pronostic.
Dans une métaanalyse de 4 études regroupant 8 680 patients avec une insuffisance cardiaque, il n’est pas retrouvé de bénéfice du traitement β-bloquant sur la mortalité chez les patients en fibrillation auriculaire comparativement à ceux en rythme sinusal(11). Les β-bloquants ne diminuent pas non plus le nombre d’hospitalisations chez les patients insuffisants cardiaques en FA comparativement à ceux en rythme sinusal. Les auteurs concluent que le bénéfice des bêtabloquants est moindre chez les insuffisants cardiaques en FA.
Cette notion avait déjà été retrouvée il y a plus de 10 ans dans l’analyse des résultats de l’étude CIBIS II portant sur le bisoprolol(12). Si la prise du traitement améliorait nettement le pronostic des patients en RS, il n’était pas retrouvé de bénéfice en termes de morbi-mortalité à la prise de bisoprolol chez les patients en FA. A contrario, de petites études portant sur le carvédilol ne semblaient pas retrouver les mêmes résultats.
C’est pourquoi, si ces données partielles nécessitent d’être confirmées par d’autres études, les recommandations actuelles s’intéressent surtout à la FC chez les patients en rythme sinusal.
Faut-il privilégier la réduction de la FC ou la dose de bêtabloquant ?
L’étude SHIFT montre que c’est l’amplitude de la réduction de FC obtenue sous ivabradine, chez des patients dont la plupart prenaient des β-bloquants, qui améliore le pronostic et non la dose de β-bloquant à l’inclusion. Cette observation est renforcée par une analyse complémentaire publiée dans le JACC il y a un an(13). Dans ce travail, les auteurs montrent que le bénéfice de l’ivabradine n’est pas, après ajustement sur la FC, modifié par la dose de β-bloquant prise à l’inclusion. Cette donnée est d’autant plus intéressante que l’on sait que les patients inclus dans l’étude SHIFT étaient bien « β-bloqués », comparativement au dernier registre européen dans l’insuffisance cardiaque(14).
Dans ESC-HF Pilot publié en 2010, sur 3 226 patients souffrant d’IC, 87 % étaient sous β-bloquant (contre 89 % dans SHIFT) mais les doses cibles de carvédilol, bisoprolol et métoprolol n’étaient atteintes que dans respectivement 37 %, 21 % et 21 % des cas, alors que dans SHIFT, 26 % des patients prenaient la dose cible de β-bloquant.
De même, dans la métaanalyse de 2009 portant sur plus de 19 200 patients souffrant d’ICS et traités par β-bloquant, c’est la réduction de FC, et non la dose ou le type de β-bloquant, qui est associé à une amélioration du pronostic(6). Dans ce travail, chaque réduction de 5 bpm est associée à une réduction du risque de mortalité de 18 %.
Afin de déterminer si l’impact du traitement β-bloquant dans l’IC est surtout lié à la réduction de FC (ou à un effet neurohormonal propre), de nombreuses études ont été réalisées depuis une dizaine d’années. Par exemple, dans une étude anglaise randomisée portant sur des patients souffrant d’ICS et implantés d’un pacemaker, les auteurs montrent qu’à dose identique de carvédilol, une stimulation rapide à 80/min est plus délétère en termes de remodelage ventriculaire gauche qu’une stimulation à 60/min(15). Ils concluaient que l’efficacité des β-bloquants dans l’ICS semble donc être essentiellement liée à la réduction de fréquence obtenue sous traitement.
On peut donc légitimement se poser la question de savoir si, à baisse de fréquence équivalente, il faut finalement privilégier les fortes doses de β-bloquant par rapport à des doses plus faibles ? Une analyse post-hoc de l’étude MERIT-HF (figure 6), évaluant le bénéfice du métoprolol dans l’ICS, fournit un élément de réponse(16). Dans ce travail, les auteurs ont séparé les patients inclus en deux groupes selon qu’ils avaient atteints ou non, après la phase de titration, plus ou moins de la moitié de la dose cible (200 mg/j). L’analyse montrait que le groupe « forte dose » (1 200 patients) avait reçu > 100 mg/j et comprenait des patients moins âgés et moins sévèrement atteints, en termes de symptomatologie fonctionnelle et de fréquence des cardiopathies ischémiques, que le groupe « faible dose » (600 patients). En revanche, leur fréquence cardiaque à l’inclusion était relativement similaire (respectivement 81 et 83 bpm). De manière très intéressante, la réduction de la FC obtenue 3 mois après la mise sous traitement était également identique dans les deux groupes (67 bpm). Ces résultats permettent donc d’apprécier l’effet « dose-dépendant » du métoprolol, indépendamment de la réduction de FC puisqu’elle est identique dans les deux groupes. Il ressort de cette analyse que la mortalité a tendance à être plus importante dans le groupe faible dose (patients plus sévères) mais que la réduction du risque relatif de mortalité est de 38 % dans les deux groupes. Les hospitalisations toutes causes étaient également réduites dans des proportions similaires. La mortalité par mort subite était réduite, en valeur relative, de manière identique entre les deux groupes. Ainsi, malgré le caractère rétrospectif de ce travail, les auteurs concluent qu’à réduction de FC équivalente, il n’y aurait pas réellement de supériorité à l’utilisation d’une forte dose de β-bloquant par rapport à une dose plus faible.
Figure 6. Étude MERIT-HF : analyse de la relation dose-efficacité du métoprolol à baisse de FC équivalente. D’après(15).
Une autre étude récente semble montrer qu’il vaudrait mieux cibler une réduction de la FC plutôt qu’une dose de β-bloquant(17). Dans ce travail rétrospectif observationnel, 654 patients insuffisants cardiaques en rythme sinusal avec FEVG ≤ 40 % ont été revus systématiquement à 4 mois puis suivis pendant une durée de 3 ans. Ce n’était ni la FC ni la dose de β-bloquant lors de la première visite qui était la plus prédictive de la mortalité mais la réduction de FC (obtenue sous β-bloquant) lors de la 2e visite. Après ajustement sur la FC, la FEVG, l’utilisation de diurétique, la créatininémie et l’âge, ce n’est pas la dose de β-bloquant à V2 mais bien l’utilisation de β-bloquant qui est importante (figure 7).
Figure 7. Après ajustement sur la réduction de FC obtenue à 4 mois, la dose de -bloquant ne semble plus être un élément pronostique majeur. D’après(17).
Cela signifie-t-il qu’il faille privilégier la réduction de la FC par un bradycardisant « spécifique » plutôt que d’utiliser un β-bloquant ? Bien évidemment, non. Il n’y a actuellement aucune preuve que la réduction de FC obtenue sous ivabradine puisse se substituer de manière adéquate à un traitement par β-bloquant. L’étude SHIFT avait d’ailleurs été conçue pour évaluer le bénéfice de l’ivabradine en sus d’un traitement optimal. Par ailleurs, l’ivabradine n’a aucun effet antiarythmique et ne peut se prévaloir du rôle préventif de la mort subite reconnu aux β-bloquants. L’ivabradine n’a par ailleurs aucun effet ralentisseur chez les patients en FA.
Les recommandations européennes restent claires à ce sujet et il faut toujours chercher à amener les patients à la dose maximale de β-bloquant qu’ils peuvent tolérer. Néanmoins, la réduction de FC sous β-bloquant dépend des variations interindividuelles du polymorphisme des récepteurs β-adrénergiques, des interactions médicamenteuses éventuelles, de la variabilité d’absorption et du métabolisme du traitement β-bloquant utilisé, et de la sévérité de l’IC.
Cela permet donc d’envisager des perspectives complémentaires : doit-on forcément attendre qu’un traitement par β-bloquant soit titré à la dose maximale tolérée avant de pouvoir considérer l’utilisation d’un autre agent bradycardisant ? Pourquoi, en cas de problème de tolérance du β-bloquant lors de cette titration des doses, ne pas rajouter de l’ivabradine pour obtenir plus rapidement une réduction de FC efficace ? Quid de l’utilisation précoce d’ivabradine en cas de dysfonction VG sévère avec bas débit ou dans le choc cardiogénique, là où l’on n’oserait pas utiliser trop tôt un traitement β-bloquant ? Dans ce cas, cela permettrait-il par la suite de pouvoir introduire plus facilement un traitement β-bloquant ? Pour l’instant, il n’existe pas de réponse spécifique à ces questions et cela pourra faire l’objet d’études complémentaires.
Conclusion
Ainsi, ces dernières années, la fréquence cardiaque, en plus d’être un marqueur pronostique important dans l’ICS, semble être devenue une cible thérapeutique de choix et il convient, chez les patients en rythme sinusal, de viser sous traitement une fréquence voisine de 60/min.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :