Training
Publié le 25 juin 2020Lecture 10 min
Valve-in-valve mitral : just do it
Charles CHRISTOPHE, Hopital-Clinique Claude Bernard, Metz
Qu’attendre d’autre d’une procédure interventionnelle aujourd’hui qu’elle améliore la survie et la qualité de vie des malades, avec des risques limités, avec un taux de réussite proche de 100 %, tout en permettant à l’équipe interventionnelle de prendre un certain plaisir au cours d’un acte déjà bien codifié et dont l’efficacité clinique est spectaculaire et quasi immédiate ? Vous en rêviez, le Valve-in-valve (ViV) mitral l’a fait.
Relativement simple à mettre en oeuvre pour un cardiologue interventionnel aguerri à la pratique du TAVI et aux techniques transseptales, elle requiert la connaissance précise des différentes étapes et de quelques astuces pour mener à bien cette procédure, certes assez technique, mais à risque limité et ô combien efficace pour nos patients. Nous ne parlerons ici que du ViV, les techniques de valve-in-ring (ViR) et valve-in-MAC (anneaux natifs très calcifiés) étant bien plus complexes et avec des résultats moins probants.
Pourquoi est-ce une (très) bonne option ?
La morbi-mortalité d’une chirurgie redux de valve mitrale est excessive, avec une mortalité à 30 jours très élevée, entre 10 et 15 %. Elle justifie à elle seule de proposer une alternative. Cela est surtout vrai pour les patients qui nous concernent, pour la plupart hypersymptomatiques (NYHA 3-4), porteurs de co-morbidités, de dysfonction ventriculaire gauche, et qui par définition ont déjà subi au moins une chirurgie. Les données des registres (> 1 900 patients) permettent aujourd’hui d’affirmer que cette technique est efficace avec plus de 95 % de succès et qu’elle est moins risquée qu’une chirurgie redux : plus de 50 % de réduction du risque par rapport au risque anticipé par le score STS et la voie transseptale est plus sûre.
La voie transseptale à tout prix
Les abords possibles sont l’approche transseptale (TS) par voie veineuse (fémorale ou jugulaire), l’approche transapicale (TA) et, plus anecdotique, l’abord chirurgical direct dans l’oreillette gauche (voire une veine pulmonaire). La TS est au ViV ce que le fémoral est au TAVI : simple, peu invasive, efficace, et sûr. Bien que la voie apicale ait d’abord été préférée (plus de 80 % sur les années initiales dans les registres), la tendance s’est inversée, du fait de la désacralisation de la ponction transseptale avec l’émergence des autres techniques (ablation de FA, fermeture d’auricule, Mitra-Clip®). Aujourd’hui, c’est la voie qui donne les meilleures chances aux patients, les meilleurs taux de succès (97 % vs 95 %), une mortalité à 30 jours diminuée (5 % vs 8,1 %) et à 1 an, moins de complications (16 % vs 22 %). Et d’après les seules données de 2019, plus de 90 % des procédures ViV mitrales sont réalisées en transseptal, avec une mortalité à 30 jours très faible (figure 1).
Figure 1. ViV mitrale avec la Sapien 3 (données STS/ACC/TVT Registry Guerrero, TCT 2019. Relation entre le taux d’utilisation de la voie transseptale et la mortalité à 30 J. Résultats à 30 J et 1 an selon la voie d’abord.
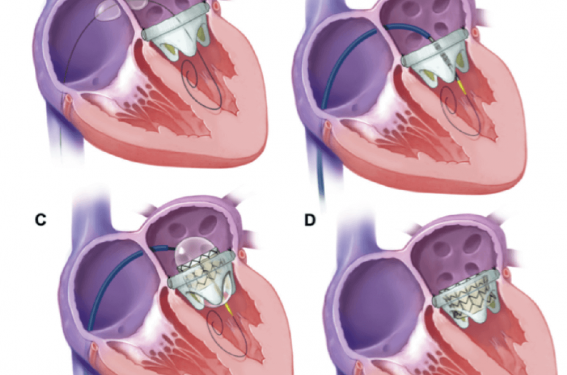
La procédure ViV mitrale avec une sapien 3 (figure 2)
Mme M. âgée de 90 ans (NYHA 3), a une bioprothèse Carpentier- Edwards Perimount 27 mitrale et 19 aortique depuis 2010. La bioprothèse mitrale est dégénérescente. L’échocardiographie cardiaque montre des gradients moyens à 25 mmHg sur la mitrale (IM peu sévère), 11 sur l’aortique. La PAPs est à 90 mmHg. Le cathétérisme droit confirme la part postcapillaire prédominante, laissant espérer l’efficacité d’une procédure ViV mitrale.
Figure 2. Etapes de la procédure ViV mitrale avec une valve transcutanée Edwards Sapien 3 (d’après Eleid MF et al. JACC Cardiovasc Interv 2016 ; 9 (11) : 1161-74).
La préparation
• Le sizing
Il est nécessaire de récupérer le compte rendu opératoire pour connaître le modèle exact de la bioprothèse : il faut avoir confirmation du modèle de bioprothèse grâce à l’étiquette d’origine (marque, modèle et taille). On vérifiera le détail technique chirurgical (suture, patch atrial, ligature auriculaire, difficultés éventuelles rencontrées lors de l’intervention).
Une échographie cardiaque et transoephagienne (ETO) seront réalisées pour préciser le mécanisme et la conséquence de la dégénérescence (50 % IM, 20 % RM, 30 % mixte, etc.) et pour éliminer les situations problématiques :
végétation, thrombus ;
fuite périprothétique ;
toute anomalie du septum IA (anévrisme-FOP, hauteur réduite, etc.) ;
thrombus auriculaire (risque d’AVC si un guide s’y engage) ;
risque d’obstruction de la chambre de chasse aortique par la SAPIEN 3 in valve.
Le scanner permet également de voir l’état du septum interatrial (calcifications, épaisseur, anévrisme) et d’anticiper une éventuelle difficulté à la ponction TS. On vérifiera également l’absence d’obstacle veineux (filtre cave, compression, variantes anatomiques et autres complications).
• Choix de la bioprothèse : l’application ViV mitral
Cette excellente application a été développée suite aux travaux de V. Bapat et al. (elle existe aussi pour le VIV aortique). Elle recense toutes les bioprothèses possibles et les tailles de valves percutanées conseillées selon la marque. Y sont précisés pour toutes ces valves chirurgicales le design et les mensurations (diamètre interne réel). Enfin, sont proposées des photos et images angiographiques des valves chirurgicales, de la position conseillée avant et après déploiement et même un mini-film d’implantation. L’Application est donc sinon indispensable au moins très utile (figure 3).
Figure 3. A. 1 Ponction transseptale. 2 Sonde orientable Agilis™, aide au franchissement de la bioprothèse chirurgicale. 3 Guide rigide dans le ventricule gauche, placé dans l’aorte ascendante pour améliorer le support. 4 Dilatation du septum interatrial au ballon de 16 mm. 5 Approche de la Sapien 3 vers la position cible. 6 Position de la Sapien 3 avant implantation. 7 Sapien 3 de profil postimplantation, léger évasement ventriculaire. 8 Sapien 3 de face, contrôle de circularité. B. Images et mensurations disponibles pour les modèles de bioprothèses chirurgicales, et aspects angiographiques. Aide au positionnement de la Sapien 3.
Ponction veineuse fémorale
Passage de 100 UI/kg d’HNF : 30 UI après la ponction, complétés après la TS, objectif d’ACT 250-300 s. Elle sera préférée à la voie jugulaire car donne plus d’aisance pour la manipulation des cathéters. Une présuture par 1 ou 2 proglide est possible. Mise en place d’un désilet 8 F.
Ponction transseptale
(figures 4 et 5)
Elle nécessite un désilet dédié et une aiguille transseptale. Le plus souvent, on utilise : désilet transeptal SL1 court (SWARTZ™ SL1 de 63 cm et une aiguille Brockenbrough BRK1 de 71 cm, St Jude Medical). Toutes sortes de courbures sont disponibles selon l’anatomie.
Figure 4. En haut : coupes ETO permettant de choisir précisément le site de la ponction TS en supéropostérieur. En bas : orientation correcte de l’ensemble sonde de TS-aiguille de TS. (d’après Russo G et al. Cardiac Interventions Today 2019 13(3) : 22-6).
Figure 5. Sites préférentiels de ponction TS selon les indications.
Rouge : MitraClip®, fermeture de fuites paravalvulaires ; Jaune : fermeture de FOP ; Bleu : assistance VG, cathétérisme ; Vert : fermeture d’auricule gauche ; Orange : intervention sur les veines pulmonaires. (d’après Alkhouli M et al. JACC Cardiovasc Interv 2016 ; 9 (11) : 2465-80).
Quelques règles indispensables
• Diamètre interne réel < diamètre du fabriquant (celui de la taille de la prothèse, qui correspond en fait au diamètre du stent sans les cuspides montées à l’intérieur) ; il est inférieur de 1 à 2 mm
► Par exemple, pour une valve Edwards Perimount 27 en péricarde bovin : diamètre fabriquant 27, diamètre réel 26.
• Toujours mesurer quand même le diamètre au scanner car du matériel fibreux et/ou calcifié peut exister dans l’anneau, et réduire encore celui-ci (surtout évidemment en cas de rétrécissement mitral)
• Lorsque 2 tailles sont possibles, on choisira plutôt la plus petite pour un rétrécissement mitral, la plus grande pour une insuffisance mitrale ou en cas de doute
• L’objectif est d’évaser la Sapien 3 pour une meilleure stabilité, si besoin en ajoutant du volume pour l’inflation. Les pressions auxquelles sera soumise cette nouvelle bioprothèse sont bien plus importantes que dans un ViV aortique, et le risque d’embolisation atriale plus élevé (+ 2/3/4 ml maxi pour les valves 23/26/29)
En pratique
• Sur le guide 032 (super rigide (stiff), fourni avec le désilet TS), on monte dans la veine cave l’ensemble désilet-dilatateur
• On retire le guide, on amène l’aiguille de ponction dans le dilatateur, au ras de l’extrémité
• On oriente la distalité de l’ensemble désilet-dilatateur (tubulure) - aiguille (« flèche » métallique) à 5-6 h (figure 4, droite). On retire lentement, jusqu’au double ressaut (de la VCS vers le septum interatrial puis vers la fosse ovale)
• La ponction est guidée par l’ETO (petit axe 0°/biplan 45°/110°) et doit être faite idéalement en partie postérosupérieure (figure 4, gauche). Le but est d’être le plus éloigné possible du plan de l’anneau mitral (3,5 cm au moins si possible) pour permettre une grande courbure du guide ce qui permettra un support suffisant pour amener la Sapien 3 le plus coaxialement possible dans la bioprothèse.
• Le désilet est avancé dans l’oreillette gauche tout en retirant l’aiguille et le dilatateur ; on complète l’HNF.
Mise en place du guide rigide à l’apex
Utilisez un long guide rigide : Safari™ (plutôt XS ou S, Boston Scientific), Confida (Medtronic), Lunderquist® (courbé, en 300 cm, Cook Medical). À ce stade, on retire l’aiguille et le dilatateur et on monte dans la Veine pulmonaire supérieure gauche le guide rigide (stiff) 032. On remplace le désilet SL1 par la sonde orientable Agilis™ 8,5 F (St Jude Medical). Après retrait de son dilatateur propre, on monte une sonde diagnostique (MP, JR ou pigtail) sur le guide. En OAD (plan perpendiculaire à la valve chirurgicale), on oriente l’Agilis™ (mollette) vers la bioprothèse puis on franchit au guide.
Le guide rigide 035 choisi est alors placé via la sonde diagnostique. C’est sur ce guide que l’introducteur Edwards est mis en place (en position retournée, sigle Edwards vers le bas, pour permettre une flexion de gauche à droite, inversement au TAVI).
Dilatation du septum interatrial
Prudente inflation (lente) au ballon de 14 F voire 16 F (au choix, 035, porteur court). Gonfler à deux reprises.
Implantation de la Sapien 3
Il n’y a plus qu’à positionner puis implanter la Sapien 3. Celle-ci sera bien sûr sertie inversée par rapport au TAVI, jupe côté poignée, vers l’oreillette gauche. La manoeuvre de positionnement du ballon sous le stent est faite dans la veine cave inférieure (VCI). On franchit le septum en activant la flexion du système. Le stent est positionné dans la bioprothèse chirurgicale. Il faut viser la position cible donnée par l’application, en se rappelant que le raccourcissement à l’inflation se fera surtout côté jupe (donc ici la partie auriculaire). La partie ventriculaire ne va donc quasiment pas bouger. En faisant légèrement dépasser le stent de la Sapien 3 de la partie ventriculaire de la bioprothèse chirurgicale, la position est bonne. L’inflation se fait classiquement, après retrait du pusher, et sous pacing ventriculaire rapide en allant impérativement jusqu’à la butée de l’inflateur. Elle doit être très lente, pour ajuster si besoin la position.
Fin de la procédure : retrait du guide VG grâce à une sonde diagnostique, retrait de l’ensemble et fermeture des proglide. Au contrôle à J2, notre patiente passe en NYHA 2, les gradients sur la mitrale sont à 7 et 11 mmHg, l’HTAP est passée de 90 à 45 mmHg. Les bénéfices sont maintenus à 6 mois.
Quleques trucs
• Pour la ponction TS
En cas de ponction difficile, on peut appliquer un courant (bistouri électrique) sur l’aiguille (très bref, 30 W voire 50 ou 70 W si besoin) ou utiliser un guide perforant 014 de CTO (qui rentre dans l’aiguille BRK).
NB : Des systèmes dédiés existent : aiguille NRG® RF (Baylis Medical), guide SafeSept® 014 aiguisé et courbé à 180° à son extrémité pour éviter toute perforation dans l’oreillette gauche.
• Pour améliorer le support
Un 2e guide rigide peut être monté dans le ventricule gauche : les 2 sont montés dans l’Agilis™ qui sera complètement retiré, laissant les 2 guides sortir à la peau, et on montera l’introducteur Edwards sur l’un des deux, laissant le second sortir à la peau en parallèle. Guide à retirer avant l’implantation.
Un guide peut être amené dans l’aorte si besoin avec un lasso (abord secondaire) et/ou maintenu avec ce même lasso.
Enfin, une légère plicature secondaire du guide rigide en amont de la courbure VG peut être réalisée.
• Pour la dilatation transseptale
Faire une inflation lente, à 2 reprises, puis « tester » le passage antérograde du ballon déflaté dans la bioprothèse mitrale (s’il ne passe pas, le stent de la Sapien 3 ne passera pas non plus ; envisager alors une prédilatation au ballon ou une inflation de l’extrémité distale du ballon avec 3-5 ml).
La communication interauriculaire iatrogène ne sera fermée (Amplatzer™) qu’en cas de conséquence clinique importante (hypoxémie réfractaire, insuffisance cardiaque, retentissement droit, etc.).
• Pour positionner le ViV
Faire une inflation avec 3-5 ml de l’extrémité distale du ballon et pousser l’ensemble.
Retirer le pusher, activer la flexion du système, traction sur le guide.
• Pour l’implantation
Le pacing sur guide fonctionne avec les mêmes bénéfices attendus que dans l’étude EASY-TAVI et évitera aussi de « surcharger » l’oreillette droite avec du matériel. On attend avec impatience le dispositif dédié Electroducer.
• Risque d’obstruction de chambre de chasse
Il est nettement plus faible que pour les Valve-in-Ring ou in-MAC (où c’est le déplacement de la grande valve par la Sapien 3 qui obstrue la chambre de chasse). Il dépend de l’angulation entre les plans mitraux et aortiques, de la largeur de la chambre de chasse, de la présence d’un bourrelet septal, etc. Il faut alors discuter d’un TAVI ou d’une alcoolisation septale.
Conclusion
Quand on sait que le recours aux bioprothèses augmente parallèlement à l’espérance de vie des patients, nous serons de plus en plus confrontés à ces situations.
Bien sûr, la chirurgie redux reste aujourd’hui le gold standard faute de recul et d’étude randomisée. Mais il existe d’ores et déjà des données solides et encourageantes pour systématiquement discuter cette option de ViV pour nos patients.
Comme le TAVI à ses débuts, la procédure ViV mitrale se heurtera inévitablement au scepticisme de certains, mais deviendra inéluctablement demain une procédure de routine.
Rappelez-vous enfin que Saint Cribier a implanté son premier TAVI chez un patient artéritique sévère par voie « transveineuse-transseptale-transmitrale », et c’était il y a bientôt 20 ans… Alors, Just Do It.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


