Focus
Publié le 31 mai 2010Lecture 12 min
Le développement de la prothèse Edwards SAPIEN
Quand on examine rétrospectivement l'histoire des implantations par cathétérisme des valves aortiques (TAVI pour Transcatheter Aortic Valve Implantation), depuis la première implantation en 2002 par l'équipe de Rouen jusqu’aujourd’hui (2 ans et demi après l'obtention du marquage CE des premiers modèles de valves), on ne peut s’empêcher d’être émerveillé par une évolution si rapide dans ce domaine de l’activité médicale. Il a fallu une grande énergie pour développer cette nouvelle modalité thérapeutique, une énergie motivée par un réel besoin médical.
Nous nous sommes interrogés ici sur les variables qui influencent le bon fonctionnement à long terme des valves, c'est-à-dire sur les critères d’ingénierie conduisant au choix du design des prothèses, sur les matériaux utilisés, sur la géométrie des composants de la valve et sur les technologies de fabrication. Les chirurgiens comprennent très bien les aspects critiques du design d’une valve. Cependant, pour les cardiologues interventionnels, ce terrain est nouveau et souvent mal connu. Dans cet article nous allons essayer de clarifier les aspects importants en orientant la discussion à partir de la nouvelle valve percutanée Edwards SAPIEN XT™ (Edwards Lifesciences Corporation).
TAVI : la réponse à un vrai besoin médical
Avant le développement de cette technique, plus d'un tiers des patients étaient laissés sans traitement dès lors qu'ils ne pouvaient être opérés, avec des conséquences redoutables pour leur survie à court terme. Le terme de TAVI est devenu omniprésent dans les congrès de cardiologie interventionnelle et de chirurgie cardiaque du monde entier. Avec plus de 15 000 interventions réalisées jusqu'alors dans le monde, on s'éloigne rapidement du domaine de la recherche clinique pour entrer dans le monde réel où cette technique est sur le point d'être utilisée en routine.
Il y a plusieurs variables qui expliquent cet engouement extraordinaire. D’une part, l'expérience croissante des équipes qui ont progressivement achevé leur courbe d'apprentissage, d'autre part, le nombre croissant de publications qui permettent de partager les connaissances, les progrès des équipements d’imagerie, l'obtention du remboursement par les autorités sanitaires et bien sûr les innovations technologiques des produits eux-mêmes.
Un des derniers progrès importants en matière de technologie est certainement le développement de la dernière génération de valve d'Edwards Lifesciences (la valve Edwards SAPIEN) et l'amélioration très attendue du système de délivrance NovaFlex pour l'abord transfémoral. Ce dernier permet un abord purement percutané, donc très simplifié, avec une taille d'introducteur réduite à 18 F, et améliore aussi la précision et la prédictibilité de l’implantation. Avec ce système, la valve reste parfaitement stable lorsqu'elle se déploie et la différence de position entre le prédéploiement et la zone finale où elle est implantée est devenue « imperceptible ». On peut espérer une forte diminution des complications vasculaires avec la diminution du calibre de l'introducteur à 7,2 mm.
Le paramètre le plus important pour nous reste néanmoins la valve elle-même, dont dépend l'amélioration spectaculaire des patients. L’amélioration est liée à l'effondrement du gradient de pression transvalvulaire et à l'augmentation drastique de la surface d'ouverture aortique. Aucun gradient résiduel n'est noté après implantation par mesure hémodynamique même s'il est de l'ordre de 10 mmHg en échographie, tandis que la surface aortique augmente considérablement à 1,70 cm2 en moyenne, alors que les valeurs de base sont respectivement de plus de 50 mmHg pour le gradient et de moins de 1 cm2 pour la surface aortique. Cette amélioration de l'hémodynamique valvulaire explique l'amélioration de la fonction cardiaque, de la cinétique ventriculaire, la diminution de la masse myocardique et, en fin de compte de l'état fonctionnel et clinique des patients. Encore faut-il que les résultats se maintiennent au long cours, et on ne dispose encore que de peu de notions sur la durabilité des modèles de valve actuellement utilisés. Le suivi le plus long concerne une patiente de Rouen dont la valve Edwards a été implantée il y a plus de 6 ans et demi et continue de fonctionner normalement. L'expérience moyenne des équipes ne dépasse guère 3 ans actuellement, mais les résultats sont très encourageants sans aucun signe de détérioration de la prothèse jusqu’alors.
Il y a donc toute raison d'être optimiste sur le futur de cette nouvelle technique. Son expansion pourrait encore s'accroître avec les résultats de l'étude PARTNER aux États-Unis, où la valve d'Edwards Sapien est comparée à la chirurgie traditionnelle de façon randomisée chez des sujets à haut risque. Les premiers résultats devraient être connus en fin d'année 2010 et sont très attendus.
Considérations anatomiques de la zone annulaire et implications sur la structure de la valve
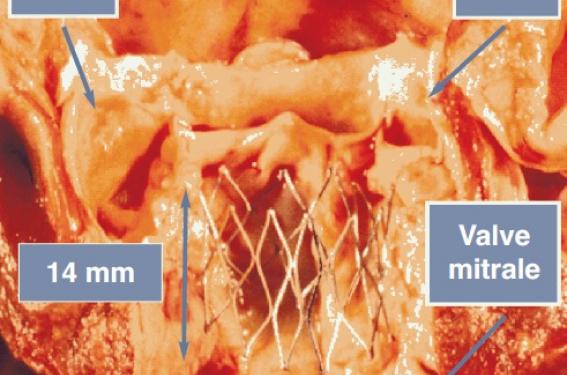
Sur la figure 1, on peut apprécier la zone anatomique correspondant à l’anneau de la valve aortique native (étude postmortem) et son environnement. Il est clair qu’il convient de minimiser toute protrusion de la prothèse à implanter hors des limites de l'anneau aortique, au-dessus comme en dessous.
Figure 1. Positionnement de la valve par rapport aux différentes structures anatomiques de proximité.
Au-dessus de l'anneau et a proximité immédiate se situent les ostia coronaires
Plusieurs études montrent que la distance moyenne entre l'anneau aortique et la naissance des coronaires est en moyenne de 14 à 18 mm, l’artère coronaire gauche étant généralement plus basse que la droite. Dans le cas de la prothèse Edwards SAPIEN XT™ de 23 mm de diamètre, la hauteur de son stent en cobalt-chrome est de 14,2 mm. Comme son placement se fait en règle à mi-hauteur du plan de l’anneau, on a par design une protrusion aortique de 7 mm en moyenne, tout à fait cohérente avec les nécessités anatomiques d'une implantation sous-coronaire. Une évaluation de cette distance est nécessaire avant implantation. Elle est facilement obtenue par échographie trans-œsophagienne ou scanner, et dans le cas d'une implantation coronaire anormalement basse, à moins de 8 mm, ceci peut conduire à renoncer à l'implantation. Il faut néanmoins prendre aussi en considération la profondeur des sinus et la longueur des feuillets natifs. Le risque d'occlusion des coronaires par les feuillets natifs calcifiés peut aussi être évalué au cours de la prédilatation aortique au ballonnet, notamment en réalisant de façon simultanée une aortographie. Le déplacement des structures valvulaires et des nodules calcaires peut aisément être contrôlé et le risque d'obstruction coronaire évalué.
C'est en effet le déplacement des feuillets valvulaires vers le tronc commun de la coronaire gauche qui constitue le risque principal, et non pas le stent lui-même dont la structure grillagée reste perméable au flux sanguin en cas de contact avec les orifices coronaires.
Respecter le faisceau de His et la mitrale
Du côté ventriculaire, il y a deux structures anatomiques à respecter, le septum interventriculaire qui contient les structures du faisceau de conduction et plus particulièrement la branche gauche du faisceau de His qui se situe sur la face gauche du septum à proximité immédiate de la valvule aortique non coronaire et la valve mitrale, notamment son feuillet antérieur.
Un excès de pression exercé par la prothèse sur la partie haute du septum interventriculaire peut ainsi bloquer le système de conduction intracardiaque et provoquer des troubles de conduction graves tels qu'un bloc auriculoventriculaire complet nécessitant l'implantation d'un pacemaker. Au même niveau se situe l'insertion du feuillet antérieur de la valve mitrale et l'on peut imaginer les conséquences néfastes d'un contact permanent du stent métallique avec ce feuillet après plusieurs millions de battements cardiaques.
Il est donc nécessaire que la protrusion intraventriculaire de la prothèse ne dépasse pas quelques millimètres ce qui est le cas après implantation de la valve Edwards SAPIEN XT™. À cet égard, la précision de l'implantation et donc la stabilité de la prothèse lors de l'implantation sont cruciales, ce qu'offre ce nouveau modèle de valve.
Avec la valve Edwards SAPIEN XT™ la protrusion intraventriculaire moyenne est de l'ordre de 7 mm, non différente de ce qui était observé avec le modèle précédent Edwards SAPIEN™ qui s'associait à un taux d'implantation de pacemaker particulièrement bas, de 1,5 à 7 % suivant les études, confirmant l'absence d'écrasement des structures interventriculaires dans la grande majorité des cas.
Ces résultats peuvent se comparer très favorablement avec ceux de la CoreValve® où existent d'importantes variations de la profondeur d’implantation, jusqu'à 15 mm dans l'étude de Piazza publiée dans le JACC en juin 2008 ceci malgré les possibilités techniques annoncées de repositionnement. Il n’est de ce fait pas surprenant que les taux d'implantation de pacemaker puissent atteindre avec ce modèle 30 à 50 % suivant les séries.
Pression annulaire et force radiale
Il est clair qu’implanter une valve percutanée à l’intérieur d’une valve native fortement sténosée et calcifiée, doit passer par une prédilatation au ballonnet de la valve native. La valve malade reste bien entendu en place, la force de compression des structures natives sur l'armature du stent est élevée et il est donc important que le stent soit capable de résister à cette compression ce qui se traduit par la nécessité d'une « force radiale » élevée. Le stent doit réaliser une ouverture aortique suffisante pour assurer un flux sanguin normal et il doit s'expandre de façon circulaire pour assurer une excellente coaptation des feuillets valvulaires de la prothèse, ceci malgré la distribution irrégulière et éventuellement asymétrique des dépôts calcaires parfois volumineux. En cas d'expansion incomplète ou d'asymétrie d'ouverture du stent, la distorsion des valvules s'accompagnerait d'une dégénération prématurée des valves, comme ceci a été déjà démontré. Il est donc primordial de s’assurer que la valve implantée ait assez de force radiale pour contrecarrer la force de compression des structures valvulaires.
Lorsque l'on considère les différents modèles de valve d'Edwards (Cribier-Edwards™, Edwards SAPIEN™ et Edwards SAPIEN XT™), ils ont tous comme caractéristique une hauteur limitée permettant une implantation strictement annulaire, en cela similaire aux valves chirurgicales, et permettant de rester à distance des structures de voisinage. De ce fait, les feuillets de la bioprothèse sont inévitablement intra-annulaires rendant fondamentale l'expansion circulaire du stent sur toute sa hauteur pour assurer la coaptation optimale des feuillets.
À l’opposé, l'autre modèle de valve, la CoreValve®, dont le stent de 55 mm de longueur est autoexpansible, en nitinol, avec une force radiale moindre, il est plus sujet à la déformation au site d'implantation intra-annulaire. Les feuillets valvulaires sont de ce fait implantés plus haut au sein du stent, et se projettent après implantation en position sus-annulaire.
Néanmoins, force est de constater que le stent étant une structure unique, il est physiquement impossible d’isoler complètement les effets de la compression du stent au niveau annulaire, et sa déformation éventuelle sur le reste du stent. Une étude publiée dans JACC en 20091 montre clairement que seuls 50 % des implants CoreValve® s'expandent de façon circulaire (coefficient d’excentricité † 10 %) au niveau de la coaptation des feuillets. Ceci contraste avec la circularité obtenue dans plus de 85 % des cas avec la valve Edwards SAPIEN™, comme le montre un article récent publié dans l’Euro Heart Journal 2. Les résultats préliminaires d'une étude similaire de l'équipe de Rouen indiquent un coefficient de circularité supérieur à 92 % (figure 2).
Les résultats cliniques de telles différences devraient apparaître dans les prochaines années, mais il s'agit certainement d'un paramètre très important pour la durabilité de ces prothèses.
Figure 2. Déploiement parfaitement symétrique de la valve.
Les feuillets de la bioprothèse
Les feuillets valvulaires sont dans tous les cas d'origine biologique, et la répartition des structures valvulaires est indiquée dans le tableau.
* Pourcentages de l’étude de marché MRG, European heart valve market 2008.
La valve Edwards SAPIEN XT™ est faite de péricarde bovin, très largement utilisé en pratique chirurgicale et dont les performances à très long terme ne cessent de s'améliorer, tandis que la CoreValve® (Medtronic) est constituée de péricarde porcin. Ce dernier tissu n'étant pas utilisé en pratique chirurgicale, son comportement dans le temps reste à évaluer sur les modèles actuellement utilisés.
La géométrie de découpe des feuillets péricardiques influence la durabilité. De la forme des feuillets dépend la répartition du stress exercé lors des mouvements d'ouverture et de fermeture de la valve.
La valve d'Edwards SAPIEN XT™ utilise une géométrie unique, conçue à partir de logiciels d’analyse d’éléments finis (Finite Element Analysis). Ses caractéristiques physiques sont similaires à celles de la valve chirurgicale PERIMOUNT™, notablement de la Magna, dont la durabilité a été largement démontrée sur d'importantes séries chirurgicales.
Enfin, le risque de calcification des feuillets valvulaire des valves biologiques est un phénomène connu et redouté, associé au processus de dégénérescence et de resténose valvulaire. Il est de ce fait remarquable que les valves SAPIEN™ et SAPIEN XT™ soient les seules actuellement disponibles traitées par un processus anticalcification, comme le sont les bioprothèses chirurgicales de la série PERIMOUNT ™ Magna et Magna Ease.
Conclusion
En regardant devant nous, on peut dors et déjà s'attendre à une forte expansion des indications allant de paire avec une amélioration constante des techniques et des matériels utilisés qui ne peuvent qu'améliorer les résultats. Il est pour l'instant nécessaire de comprendre les variables prédictives de résultats optimisés tant sur le court que le long terme et d'orienter le choix des prothèses en conséquence.
NDLR : Dans un esprit d’équité, la rédaction de Cath’Lab informe ses lecteurs qu’un article est programmé pour le numéro 11 sur la CoreValve® dans cette même rubrique « Focus/Nouvelle technique ».
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


