Polémique
Publié le 31 aoû 2008Lecture 9 min
La thromboaspiration : premier temps de toute angioplastie primaire en phase aiguë d’infarctus ?
P. MEYER, S. BOSLE, P. DURAND, C.-J. MARIOTTINI, R. SCHMITT, Institut Arnault Tzanck, Saint-Laurent-du-Var
Si l’angioplastie primaire a largement démontré son efficacité en phase aiguë d’infarctus, la recanalisation de l’artère occluse ne profite pas également à tous les patients. Si certains patients présentent tous les critères en faveur d’une reperfusion rapide et efficace, pour d’autres, la réouverture du tronc épicardique ne permet pas une reperfusion effective du myocarde (no-reflow).
En s’opposant à un des mécanismes du no-reflow, la thromboaspiration apparaît comme une arme thérapeutique particulièrement séduisante.
La publication récente des résultats de l’étude TAPAS offre à ses défenseurs des arguments enfin scientifiques. Doit-on pour autant la généraliser à tous les infarctus ?
Le no-reflow : un phénomène multifactoriel
L’absence de revascularisation efficace, décrite sous le terme de no-reflow phenomenon, est de mauvais pronostic en laissant peu d’espoir de récupération myocardique.
Les causes de ce verrou circulatoire sont complexes et multifactorielles :
En premier lieu, il témoigne d’une nécrose généralement étendue et déjà bien avancée au moment où la recanalisation de la lésion coupable intervient. Les dégâts sont installés : les lits vasculaires sont obstrués par des microagrégats fibrinoplaquettaires formés in situ, souvent au contact d’embolies de matériel athéromateux par vidange du noyau lipidique lors de la rupture de plaque. La vasoconstriction induite par la libération de médiateurs comme le thromboxane A2, l’endothéline… ainsi que l’œdème et la nécrose des cellules endothéliales, aggravent l’obstruction du lit vasculaire. La souffrance ischémique des cellules myocardiques, leur contracture, la rupture des membranes mitochondriales et cytoplasmiques, l’inflammation du tissu interstitiel majorent la compression des capillaires et s’opposent à toute revascularisation effective du muscle cardiaque.
À ces facteurs s’ajoutent l’effet iatrogène d’une revascularisation brutale qui accélère la constitution de la nécrose irréversible du myocarde encore potentiellement viable, et l’inondation massive du territoire vasculaire par les embolies de matériel fibrinocruorique et athéromateux lors du rétablissement du flux et de la compression de la lésion thrombogène par le ballon et le stent.
L’utilisation des systèmes de thromboaspiration vise à limiter ce facteur embolique qui n’est certes qu’un des composants du noreflow phenomenon, mais, peu ou prou, constamment présent chez tous les patients et partiellement évitable par une technique simple(1).
Techniques de thromboaspiration
Parmi les différents dispositifs existants, le cathéter Export® XT (Medtronic, Minneapolis, États-Unis) est actuellement le plus utilisé et le mieux évalué par les études. C’est un microcathéter ayant deux lumières :
- l’une, de type monorail permet de le faire coulisser sur le guide 0,014 ;
- l’autre, plus large est coaxiale ; elle se termine par une extrémité distale biseautée, de façon à faciliter le franchissement des lésions et à bénéficier d’une large bouche d’aspiration des débris qui sont récupérés en faisant le vide dans une seringue raccordée à l’autre extrémité du cathéter.
Deux tailles sont disponibles, compatibles avec l’utilisation d’un cathéter guide 6 ou 7F, en fonction de la taille du vaisseau et de la quantité de matériel athérothrombotique à aspirer.
La première étape consiste à passer le guide 0.014 à travers l’occlusion artérielle, puis à enfiler le cathéter d’aspiration sur le guide pour l’acheminer vers la lésion.
La mise en aspiration se fait dès la pénétration du cathéter d’aspiration dans le vaisseau occlus, pour éliminer le sang mélangé au matériel thrombotique stagnant dans le cul-de-sac en amont de la lésion thrombogène, puis celle-ci est franchie en aspiration, permettant le plus souvent de réaliser une véritable athérectomie du matériel encore contenu dans le noyau lipidique de la plaque rompue ; le cathéter est ensuite poussé jusqu’en distalité pour aspirer sang et débris dans le lit d’aval.
Plusieurs passages sont effectués, entrecoupés de contrôles angiographiques et d’injections locales de drogues jusqu’à obtention d’une détersion optimale de la lésion et aspiration de l’ensemble des caillots visibles – en pratique jusqu’à ce que le sang ramené et filtré ne contienne plus de macrodétritus visibles.
Cette large lumière coaxiale permet également de mieux visualiser le lit d’aval, par injection distale du produit de contraste après aspiration. Cette fonctionnalité est particulièrement intéressante lorsque le vaisseau n’est toujours pas opacifiable après thromboaspiration, pour départager une dissection occlusive de plaque d’un thrombus persistant occlusif ou d’un no-reflow. La visualisation du lit d’aval est alors essentielle pour arrêter la stratégie à adopter, s’assurer de la position du guide dans l’artère la plus importante et choisir un stent de la longueur adéquate (on pourra alors injecter en même temps par le cathéter guide et par l’extrémité distale du cathéter d’aspiration pour bien analyser la lésion à traiter).
Cette lumière coaxiale est également utile pour injecter des dérivés nitrés, de l’adénosine, ou toute autre drogue permettant de déverrouiller le lit d’aval et d’améliorer l’épargne myocardique lors de la recanalisation (cas clinique n° 1).
Le cathéter Export® XT peut également être utilisé pour récupérer des caillots embolisés dans le lit d’aval (cas clinique n° 2).
Les systèmes d’aspiration ont-ils prouvé leur utilité ?
Les résultats des études les plus anciennes sont discordants du fait de la diversité des matériaux testés et d’une grande variabilité des critères d’inclusion(2-4). Néanmoins, quelques publications récentes confirment l’intérêt d’utiliser un système d’aspiration simple par microcathéter tout en soulignant les limites de son efficacité. Les critères primaires principaux adoptés dans ces études évaluent la qualité de la revascularisation myocardique obtenue : score Blush, TIMI frame count, résolution du segment ST et, pour les plus récentes, appréciation de la perfusion tissulaire par temps précoce de l’IRM cardiaque et de la masse nécrosée par rehaussement tardif.
En 2005, F. Burzotta et al. Montraient dans l’étude REMEDIA la faisabilité et l’efficacité de la thromboaspiration par le système Diver CE (Invatec, Brescia, Italie) sur une série de 100 patients randomisés en phase aiguë d’infarctus avant l’angiographie(7) ; 46 % des patients ayant bénéficié de la thromboaspiration réunissaient les critères angiographiques (Blush III) et électrocardiographiques (résolution du ST > 70 %) de reperfusion optimale alors que seulement 24,5 % des patients dilatés sans thromboaspiration préalable y parvenaient (p = 0,025).
En 2006, l’étude DEAR-MI démontrait l’efficacité du cathéter Pronto™ (Vasc.solutions, Minneapolis, Minnesota) sur 148 patients randomisés, bénéficiant ou non d’une thromboaspiration avant angioplastie primaire. Hormis les critères primaires (score de Blush III : 88 % vs 44 % ; p < 0,001) et diminution du sus-décalage du segment ST > 70 % (68 % vs 50 % ; p < 0,05), favorables à l’utilisation d’un système d’aspiration, on constatait également une moindre fréquence de no-reflow (3 % vs 15 % ; p < 0,05), et d’embolies périphériques (5 % vs 19 % ; p < 0,05), ainsi qu’un pic de CKMB significativement plus faible. L’examen macroscopique retrouvait du matériel athérothrombotique dans 95 % des cas, mais les patients étaient randomisés après angiographie et devaient avoir un score thrombus élevé pour être inclus(6).
Tone Svilaas a publié récemment les résultats de l’étude TAPAS, beaucoup plus importante, puisqu’elle a inclus 1 071 patients victimes d’un infarctus, randomisés avant angiographie, entre angioplastie primaire conventionnelle ou précédée d’une thromboaspiration par cathéter Export® XT(7).
Le critère principal était la constatation d’un score de Blush 0 ou I signant l’inefficacité de la reperfusion myocardique. Cette étude importante illustre bien les avantages de l’utilisation systématique du cathéter d’aspiration sur tout infarctus, sans tenir compte de la présomption de la présence d’un caillot sur des aspects angiographiques. L’analyse histologique des prélèvements retrouve du matériel athérothrombotique dans 73 % des cas. Une reperfusion myocardique médiocre, voire inexistante, était plus rarement observée dans le groupe thromboaspiration (17 % de Blush 0-I vs 26 % dans le groupe référence ; p < 0,001). Une résolution complète du sus-décalage ST était plus fréquente dans le groupe thromboaspiration (56 % vs 44 % ; p < 0,001).
Cette étude démontre à nouveau que la mortalité des patients est significativement liée à la qualité de la reperfusion myocardique : les patients qui ont le meilleur pronostic sont ceux qui ont la meilleure résolution du ST et le meilleur score de Blush post-recanalisation, indépendamment de la méthode utilisée pour obtenir ce résultat.
L’étude TAPAS montre bien une tendance à une réduction de la mortalité parmi les patients qui ont bénéficié de la thrombo-aspiration (2,1 % vs 4 % dans le groupe référence ; p = 0,07), mais elle ne parvient pas à démontrer une différence significative à 30 jours. Une puissance insuffisante en est probablement l’explication. Cependant, à 1 an, il apparaît une diminution significative des décès d’origine cardiaque en faveur de la thromboaspiration (3,6 % contre 6,7 % dans le groupe référence ; p = 0,02), mais avec un nombre de perdus de vue prêtant à discussion.
L’étude TAPAS montre une amélioration de la reperfusion mais aussi une réduction significative des décès d’origine cardiaque à 1 an dans le groupe thromboaspiration.
Les résultats des études récemment présentées oralement au TCT 2007 et à l’AHA 2008, vont dans le même sens que ceux de TAPAS. Dans l’étude EXPORT, B. Chevalier rapporte une amélioration significative de la qualité de la reperfusion tissulaire après utilisation systématique du cathéter Export® XT de Medtronic et G. Sardella publie des résultats similaires dans un travail italien EXPIRA utilisant le même matériel.
La thromboaspiration doit-elle être systématique ?
L’utilisation systématique d’un cathéter de thromboaspiration avant toute autre mesure de recanalisation mécanique est facile, sûre et rapide à mettre en œuvre.
À défaut de démontrer une diminution de la mortalité, toutes les études récentes sont concordantes pour conclure que l’aspiration systématique avant angioplastie améliore la qualité de la reperfusion et diminue la taille de la nécrose.
Le bénéfice clinique est cependant très variable d’un patient à l’autre : majeur si la lésion coupable comporte d’abondantes quantités de matériel mobilisable, modéré chez de nombreux patients dont la composante embolique ne joue qu’un rôle secondaire dans la genèse du verrou circulatoire et dont les lésions myocardiques et microvasculaires, déjà irrémédiablement installées, priment. Ces patients pourraient tirer d’avantage de bénéfices d’autres méthodes de sauvetage myocardique (minimalist immediate mechanical intervention [MIMI], postconditionnement, etc.) dont la mise en œuvre est difficilement compatible avec l’utilisation d’un cathéter d’aspiration(8).
Conclusion
Il est toutefois impossible de prédire sur des critères cliniques ou angiographiques quelle est la méthode d’épargne myocardique la plus appropriée à chaque patient, et c’est une des limitations potentielles à l’utilisation systématique de la thromboaspiration qui limite le recours à d’autres techniques.
Cas clinique 1
1- Mr L., 53 ans, a un infarctus antérieur. Après passage du cathéter Export® XT, le vaisseau reste occlus. L’injection distale montre un vaisseau spastique.
2- L’injection de dérivés nitrés et d’adénosine déverrouille le lit d’aval. La lésion coupable est une dissection occlusive de plaque, nécessitant l’injection synchrone par le cathéter guide et par la lumière de l’Export pour bien en préciser la morphologie et choisir un stent adapté (Biotronik PRO-kinetic 3,5 x 22 mm).
3- Résultat final après stenting. Les suites sont simples avec une faible élévation des CPK.
Cas clinique 2
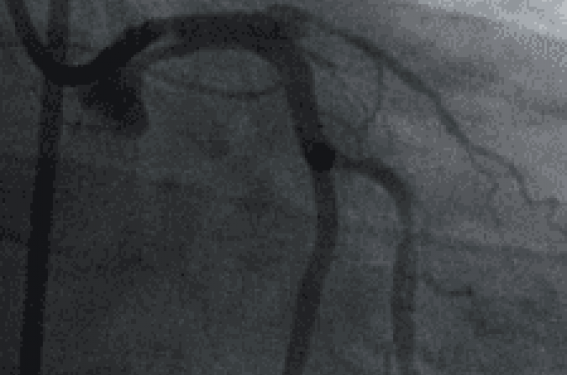
Mr A. présente une nécrose postérieure de classe Killip I à H4 avec une thrombose TIMI 0 de la droite au genu superius.
La réouverture du vaisseau est obtenue par passage du guide et permet de récupérer un flux TIMI II : elle révèle un volumineux thrombus flottant poststénotique.
La lésion s’avère infranchissable au cathéter Export® XT. L’aspiration au contact ne ramène rien. Une prédilatation par ballon 2,5 x 15 Medtronic Sprinter recanalise le vaisseau avec embolie du caillot sur la croix du coeur.
Temps tardif : staining sur le caillot (flèche).
Le thrombus est récupéré par le cathéter Export®XT avec succès.
Enfin, la lésion thrombogène est stentée (Medtronic Driver® 3,5 x 30). Les suites sont simples et le ST normalisé dès la sortie de salle.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


