Focus
Publié le 31 mai 2012Lecture 6 min
L’ECMO : un outil indispensable en salle de cathétérisme
L. BELLE, L. MANGIN, H. MADIOT*, Centre Hospitalier d’Annecy * H. Madiot : Infirmière de recherche clinique en cardiologie interventionnelle au CH d’Annecy
Une console d’ECMO (Extra-Corporeal Membran Oxygenation) et des infirmières/infirmiers de salle de cathétérisme entraînés au débullage des circuits sont indispensables dans toute salle de cardiologie interventionnelle pour réagir dans les meilleurs délais face à une complication grave, même à proximité d’un service de chirurgie cardiaque. L’implantation percutanée des canules d’ECMO est à la portée de tout cardiologue interventionnel.
Observation
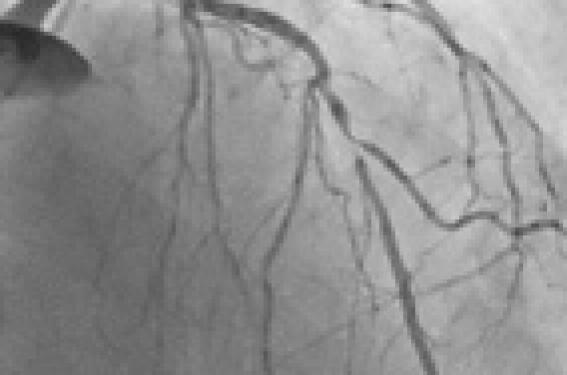
Il s’agit d’un patient de 65 ans, coronarographié par voie radiale pour un syndrome coronaire aigu (SCA) sans sus-décalage du segment ST. L’angiographie coronaire montre une sténose irrégulière de 70 % de l’IVA au niveau de l’émergence de la première diagonale (figure 1). Il n’existe pas de trouble de la contractilité du ventricule gauche (VG) et la fraction d’éjection (FEVG) est de 60 %.
On réalise dans la foulée une angioplastie coronaire après avoir protégé l’artère diagonale avec un second guide d’angioplastie. On implante d’emblée un stent dans l’IVA, couvrant la branche secondaire. Le résultat est angiographiquement satisfaisant sur l’IVA mais on constate une occlusion de l’artère diagonale associée à une douleur thoracique et un sus-décalage du segment ST sur les dérivations latérales (figure 2).
Afin d’ouvrir cette artère, on tente alors de franchir la maille du stent. Son cathétérisme se révèle laborieux, nécessitant l’utilisation de plusieurs guides d’angioplastie. Au bout de 30 minutes, on assiste à une thrombose aiguë sub-occlusive du tronc commun gauche (TCG) avec un flux TIMI 1 dans l’ensemble de la coronaire gauche (figure 3).
L’hémodynamique du patient se détériore immédiatement et il est décidé alors d’implanter une ECMO (Extra-Corporeal Membran Oxygenation) par voie fémorale. Deux guides de 0,035’’ sont introduits respectivement dans l’artère et la veine fémorale droite alors que le pouls fémoral est encore perçu.
L’état du patient se dégrade : il présente un arrêt cardiaque nécessitant des manœuvres de réanimation cardiopulmonaire (RCP). Les canules d’ECMO sont introduites sous massage cardiaque externe et le circuit de circulation extracorporelle est debullé par deux infirmières de salle de cathétérisme.
L’ECMO est mise en route 10 min après le début de la RCP. Sous ECMO, nous contrôlons la coronaire gauche qui est complètement occluse. Sous traitement antiagrégant maximal et sur un cœur quasi arrêté (onde de pression plate sous ECMO), nous réalisons une thromboaspiration pour restaurer un flux TIMI 3 dans toutes les branches de la coronaire gauche, sans thrombus résiduel (figure 4).
Après 60 min sous abciximab sans dégradation du flux, le VG reprend une fonction systolique assez satisfaisante, générant une onde de pression modulée. L’abciximab est poursuivi pendant 12 heures. L’évolution est par la suite favorable sur le plan hémodynamique. Les vasopresseurs sont sevrés progressivement, l’ECMO est explantée à la 24e heure par l’équipe de chirurgie cardiaque et le patient est extubé 2 jours après.
Le pic de troponine est à 40 ng/l, l’ECG montre l’apparition d’une onde Q et l’échocardiographie montre une akinésie antérolatérale limitée avec une FEVG à 50 %.
La coronarographie de contrôle réalisée 8 jours après cet épisode documente une régression complète du thrombus avec la persistance d’un bon résultat du stent implanté sur l’IVA moyenne et l’occlusion de la première artère diagonale. La ventriculographie montre une akinésie de la partie moyenne de la paroi antérieure du VG, sur le territoire de l’artère diagonale, et une FEVG à 50 %.
Dans le déroulement de cette procédure, nous avons la conviction que l’implantation rapide de l’ECMO a été déterminante.
Figure 1. Sténose de l’IVA et de la diagonale, avant dilatation.
Figure 2. Stent implanté dans l’IVA. Occlusion de l’artère diagonale.
Figure 3. Thrombose du tronc coronaire gauche avec un flux TIMI 1 sur l’ensemble de l’artère coronaire gauche.
Figure 4. Fin de procédure, après thromboaspiration, sous abciximab et ECMO.
L’expérience du CH d’Annecy
Notre activité de cardiologie interventionnelle (1 050 angioplasties coronaires en 2011) a débuté en 2002, dans un hôpital sans chirurgie cardiaque. En 2006, pour sécuriser notre activité, une console d’ECMO a été mise à la disposition de notre établissement par le CHU de Grenoble, l’hôpital de référence en chirurgie cardiaque, situé à 100 km de notre centre. L’ensemble de l’équipe s’est investie dans la mise en place de ce dispositif : implantation des canules (21 F pour la veine et 14 ou 17 F pour l’artère) pour les cardiologues interventionnels et débullage du circuit par les infirmières/infirmiers du « cath-lab ».
Entre 2006 et 2010, nous avons implanté une ECMO chez 51 patients(1). Pour trois patients il s’agissait d’un choc cardiogénique sévère ou d’un arrêt cardiaque en salle de cathétérisme (2 complications et un infarctus massif adressé pour une angioplastie primaire). Dans les autres cas, il s’agissait d’arrêts cardiaques réfractaires (implantation sous massage) ou de chocs cardiogéniques sévères (précédés ou non d’arrêt cardiaque) survenant en dehors de toute intervention (figure 5).
L’ECMO a été implantée dans le « cath-lab » chez 32 patients sur 51 (patients « transportables » ou avec une indication d’ECMO retenue avant l’arrivée à l’hôpital par les médecins du SMUR). Pour 2 patients, nous avons implanté l’ECMO dans un hôpital voisin non interventionnel. Dans un cas, nous avons implanté l’ECMO au domicile d’un jeune patient en arrêt cardiaque réfractaire, jugé non transportable. Nous ne sommes pas parvenu à implanter l’ECMO chez 1 patient sur 27 en choc cardiogénique sévère et chez 6 patients sur 24 en arrêt cardiaque réfractaire.
Le taux de mortalité hospitalière est très différent selon les circonstances cliniques : 96 % chez les patients implantés en arrêt cardiaque réfractaires et 52 % pour les patients implantés en choc cardiogénique sévère (figure 6). Les 14 patients sortis vivants de l’hôpital le sont toujours après un suivi moyen de 17 mois (IQR : 13-26).
Durant le développement de notre expertise, nous avons tenté d’améliorer nos résultats. Nous avons ainsi la conviction que nous avons parfois trop attendu pour poser l’indication d’ECMO et il semble préférable d’implanter ce dispositif avant la survenue de l’arrêt cardiaque. En cas de doute, nous proposons d’installer un désilet de 4 F dans l’artère fémorale et un désilet de 5 F dans la veine fémorale pendant que le pouls est encore perceptible et dans la perspective d’une décompensation rapide, imposant une implantation immédiate de l’ECMO (la différence de désilet minimise les risques de confusion). La ponction des vaisseaux peut être grandement facilitée par l’échographie et l’installation en salle de cathétérisme permet de localiser les guides et les canules en radioscopie. Un support visuel a été réalisé pour aider l’infirmière/infirmier de salle au débullage du circuit.
Les nombreuses complications hémorragiques nous ont amené à diminuer les doses d’anticoagulants et à limiter l’utilisation des inhibiteurs des glycoprotéines IIb/IIIa. Les accès veineux profonds doivent être réalisés avec précaution en privilégiant la voie fémorale. La planche à masser semble augmenter la fréquence des hémothorax et son évaluation dans les arrêts cardiaques réfractaires est en cours. Une reperfusion du membre cathétérisé par la canule artérielle est devenue systématique avec une ponction antérograde de l’artère fémorale superficielle (figure 7).
L’utilisation de canules armées diminue le risque de plicature de celles-ci.
Les indications d’un système Impella sont restreintes et lorsque la contre-pulsion aortique est insuffisante, l’ECMO semble le dispositif le plus indiqué.
Figure 5. Indications d’implantation d’une ECMO.
Figure 6. Survie hospitalière en fonction du tableau clinique initial.
Figure 7. Reperfusion « distale » du membre inferieur cathétérisé.
Conclusion
Un service de chirurgie cardiaque s’est installé dans notre établissement en janvier 2011. Nous restons cependant convaincus que nous devons garder notre expertise et une certaine autonomie dans l’implantation des ECMO en salle de cathétérisme cardiaque, principalement pour garantir une rapidité d’implantation, en toute circonstance.
Cette rapidité d’implantation est un facteur déterminant de succès.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


