Mise au point
Publié le 15 juin 2018Lecture 12 min
Fermeture par voie percutanée des fuites paraprothétiques valvulaires - Focus sur le traitement des fuites paraprothétiques mitrales
Benoît GÉRARDIN et coll.*, Hôpital Marie Lannelongue, Le Plessis Robinson
Les fuites paraprothétiques valvulaires cardiaques (FPP) sont assez fréquentes (2 à 18 % suivant les sources), le plus souvent asymptomatiquesé Toutefois, elles sont parfois responsables de symptômes invalidants à type d’hémolyse et/ou d’insuffisance cardiaque rebelles au traitements médicamenteuxé Il est alors classiquement proposé une reprise chirurgicale qui est grevée d’un risque opératoire aggravée.
Dès 1992, James Lock (Boston, Etats-Unis) propose la fermeture par voie percutanée de ces fuites(1). Pendant des années cette technique est restée confidentielle, mais depuis 2010 elle connaît un regain d’intérêt en raison de la diversification du matériel d’occlusion cardiovasculaire et l’apparition de l’échocardiographie transœsophagienne 3D (ETO 3D).
Nous aborderons ici le traitement percutané des fuites paraprothétiques mitrales, plus complexes à fermer par voie percutanée et avec des résultats cliniques actuellement moins bons que pour la fermeture percutanée des FPP aortiques(2).
Aprés la présentation d’un cas clinique de fermeture de fuite périprothétique (FFPP) mitrale par voie percutanée, nous évoquerons une série de points clés pour la mise en œuvre de ces procédures. Nous partagerons l’expérience francophone multicentrique présentée annuellement depuis 3 ans à l ’occasion des Journées de Marie Lannelongue consacrées aux procédures inhabituelles en cardiologie interventionnelle.
Cas clinique
Madame A., 60 ans, souffrait d’un rétrécissement mitral rhumatismal. Elle a subi 3 chirurgies cardiaques, initialement une commissurotomie mitrale, puis un remplacement valvulaire mitral (RVM) par bioprothèse valvulaire et enfin, en 1991, un RVM avec la valve mécanique St Jude 27 à double ailette.
En 2016, une insuffisance cardiaque (NYHA II) survient malgré le traitement médical renforcé sur une insuffisance mitrale périprothétique de grade 3 recouvrant 1/8 de circonférence, située à 6 heures en vue chirurgicale. Après évaluation médicochirurgicale, l’indication de fermeture percutanée est retenue.
1re FFPP
Elle est réalisée le 28 mars 2017, par voie fémorale droite et ponction transseptale. Successivement, 3 prothèses St Jude sont placées : un Amplatzer™ (CIV musculaire de 8 mm), un Vascular plug 2 de 8 mm et enfin un Vascular plug 4 de 8 mm. Mais chacune de ces prothèses provoque, avant largage, un blocage de l’ailette si bien qu’aucune n’est laissée en place. Il est décidé d’interrompre la procédure et de la reprendre avec des prothèses Amplatzer™ AVP III (Abbott) (figure 1).
Figure 1. Mme Aé FFPP 1 : ailette de la prothèse St Jude bloquée par la prothèse AmplatzerTM Muscular VSD Occluder ; il en sera de même avec un AVP II et un AVP4 ; la procédure est abandonnée.
2e FFPP
Un mois plus tard (25/04/2017), par le même abord, la mise en place d’une prothèse AVP III (10 x 5 mm) sans gêne au mouvement des ailettes est réalisée avec succès mais il persiste une fuite résiduelle de grade 2. Au décours, la patiente dit malgré tout être très améliorée.
Un an plus tard, la dyspnée s’aggrave de nouveau, qui sans être aussi importante qu’auparavant, est invalidante. L’ETO constate le bon positionnement du plug AVP III et une fuite grade 3 adjacente à 8 h en vue chirurgicale (figure 2A).
Figure 2. A : Mme A. FFPP 3 : la fuite est située juste à côté de la prothèse AVP III (10 x 5 mm) implantée 1 an auparavant. B : Fuite résiduelle minime après implantation d’une nouvelle prothèse AVP III (10 x 5 mm).
3e FFPP
Le 22 mai 2018, une 3e FFPP est réalisée, toujours par voie veineuse fémorale droite et abord trans-transseptal, en utilisant un cathéter orientable. Une seconde prothèse AVP III (10 x 5 mm) est mise en place et permet une bonne occlusion avec une minime fuite résiduelle (figure 2B) ; les suites sont simples à l’exception de la survenue à J3 d’une tachycardie supraventriculaire qui sera réduite par un choc électrique externe après imprégnation en cordarone.
Les points clés
Discussion avec le chirurgien
Majoritairement, ce type de patients nous est confié par les chirurgiens en raison du risque chirurgical accru et de la possibilité de récidive de fuite périprothétique postchirurgicale. Quand le patient est adressé directement, après l’échocardiographie transthoracique (ETT) et transœsophagienne (ETO), la situation est analysée avec le chirurgien. Si les défects sont multiples, une voie transapicale pourra être discutée, et en cas d’échec de la procédure de fermeture par voie percutanée, la cure chirurgicale pourra être finalement retenue.
Malgré un Euroscore 2 bas (3 %), la patiente présentée ici nous aété adressée pour tenter d’éviter une chirurgie quadridux. A noter que l’Euroscore 2 intègre la chirurgie redux, mais pas les reprises chirurgicales au-delà.
L’imagerie de la fuite
Le scanner et l’IRM sont en cours d’évaluation pour analyser les FPP, mais en pratique ce sont l’ETT et surtout l’ETO qui sont opérationnelles.
L’ETT peut omettre ou sous-estimer une fuite excentrée. L’ETO redresse alors le diagnostic. En particulier, devant une anémie hémolytique inexpliquée chez un porteur de valve cardiaque, elle peut permettre de retrouver une petite fuite excentrée de haute vélocité expliquant la symptomatologie.
Surtout, l’ETO permet de préciser l’anatomie de la fuite ou des fuites et de préparer la procédure et d’en évaluer les chances de succès : sont notés la forme, la taille, l’orientation et la localisation de chacune des fuites en particulier par rapport aux ailettes pour les valves mécaniques (figure 3).
Figure 3. Différentes formes de fuites périprothétiques mitrales.
Dans le registre prospectif multicentrique des fermetures de fuites périprothétiques (registre FFPP) que nous conduisons depuis 2017, chaque fuite est décrite et dessinée sur un schéma ; suivant le consensus international, la localisation de chaque fuite est décrite par sa position horaire sur la vue chirurgicale c’est-à-dire une vue auriculaire avec l’aorte à midi (figure 4).
Figure 4. Localisation horaire des fuites mitrales.
Fabrice Bauer (Rouen) propose un score échographique pronostique de succès de fermeture des FPP qui semble pertinent. Il va être inclus dans le registre prospectif (figure 5).
Figure 5. Proposition de classification pronostique (Dr Bauer, Rouen). Plus le score est bas, plus la chance de réussite est élevée. De plus, une FFPP sur prothèse mécanique est plus délicate que sur une bioprothèse.
Pour notre patiente, à la veille de sa 3e procédure, la fuite grade 3 est unique et située à 7-8 heures à côté de l’AVP III placé 1 an auparavant et s’étend sur 1/8 de circonférence (figure 6).
Figure 6. Mme A. FFPP 3 : schématisation de la fuite dans la fuite dans le registre FFPP.
L’environnement médical et médicamenteux
Les FFPP mitrales sont pratiquées en règle sous anesthésie générale en raison de l’ETO perprocédure.
Une antibioprophylaxie classique est administrée (céfuroxime 1,5 g IV ; en cas d’allergie aux pénicillines, vancomycine 1 g IV).
Une héparine non fractionnée titrée sur l’ACT (objectif 250 à 350 s) est administrée dès la ponction transseptale afin d’éviter le caillotage dans les cathéters au contact des guides et prothèses.
Ces procédures étant le plus souvent longues, les constantes radiologiques sont réglées de façon optimale (enregistrement de boucles de scopie à 7,5 images/s, graphie é 15 images/s, utilisés uniquement lors du placement de la prothèse et du radiocinéma de valve avant largage, collimation, etc.).
La voie d’abord
Les FFPP mitrales peuvent être abordées par voie rétrograde, antérograde ou par voie cardiaque apicale. Le choix est orienté par l’imagerie préopératoire.
• La voie antérograde par l’oreillette gauche après ponction transseptale est l’abord préférentiel et convient pour toutes les localisations. Toutefois, les fuites septales (1 h – 5 h) et inférieures (6 h) peuvent être plus difficiles d’accès par cette approche.
• L’abord rétrograde percutané par le ventricule gauche est intéressant, voire pour certains à considérer en priorité, pour les fuites inférieures (6 h) ; dans notre expérience, une FFPP qui n’avait pas pu être menée à bien par voie antérograde, a été couronnée de succès par cet abord rétrograde. La présence d’une valve mécanique aortique ne plaide pas pour cet abord, mais des cas cliniques rapportent des succès de FFPP mitrales après franchissement sans dommage d’une valve mécanique aortique à double ailettes (figure 7).
• L’abord mixte rétrograde – antérograde dit en « téléphérique » : la capture du guide de franchissement de la fuite par un lasso permet d’obtenir un support plus important pour le passage du cathéter au travers de la fuite.
• Enfin, quand, les fuites sont multiples, la voie ventriculaire apicale peut être une bonne solution. Toutefois, cette dernière est plus invasive, et l’utilisation de gros cathéters orientables par voie percutanée concurrence cette voie d’abord dans cette indication. Pour la majorité des équipes, la voie apicale n’est à retenir qu’en cas d’échec des autres abords.
Pour notre patiente, avec une fuite située é 6 heures, nous avons opté pour un abord antérograde.
Figure 7. Le passage par un cathéter au travers d’une prothèse à ailettes permet de franchir la FPP mitrale par voie rétrograde avec un guide Terumo 0,035 qui sera récupéré au lasso dans l’oreillette gauche. Dès lors, l’implantation d’une prothèse par voie antérograde est réalisée avec succès (C. Dauphin, Clermont Ferrand).
Le matériel d’accès
Il dépend de la voie d’abord, de la taille et de la forme de la (des) fuite(s), et de la (des) prothèse(s) prévue(s) pour occlure la fuite.
• Pour la voie antérograde : après avoir pratiqué le transseptal et placé l’extrémité de l’introducteur (8,5 F, 65 cm) dans l’oreillette gauche, les introducteurs 6 F de 80 cm à 110 cm s’avèrent parfaitement opérants pour un certain nombre de fuites. En cas d’échec avec cette première méthode, les cathéters orientables peuvent être indispensables.
Nous utilisons les cathéters orientables Agilis™ 8,5 F (Abbott) et à quelques reprises le Flex-Cath Advance Steerable Sheath 12 F (Medtronic)é La société Occlutech fournit avec le kit d’implantation de ses prothèses, des cathéters orientables 12 et 14 F (Occlutech® Steerable Guiding Sheath).
• Pour la voie rétrograde, il faut disposer d’introducteurs longs (110 cm) en 5, 6 et 7 F ; nous utilisons les introducteurs Destination® (Terumo) et Flexor® (Cook Medical).
• Pour la voie apicale chirurgicale des introducteurs courts, suffisent. Leur diamètre sera adapté au matériel à implanter.
Le matériel de franchissement
En règle, glissés dans l’introducteur, ce sont des sondes coronaires 4 F qui permettent de diriger un guide 0,035’’ stiff droit (Terumo) dans la fuite. La fuite franchie, l’extrémité de la sonde 4 F est glissée dans le ventricule gauche (ou dans l’oreillette gauche pour la voie rétrograde) où le guide Terumo est remplacé par un guide d’échange stiff 0,035’’.
Après avoir réintroduit le dilatateur dans l’introducteur, l’extrémité de ce dernier, généralement de calibre 6 F, peut alors être poussé dans le ventricule gauche (ou l’oreillette gauche pour la voie rétrograde). Si seule une sonde 4 F franchit la fuite, il est possible d’implanter un AVP4 si l’anatomie de la fuite s’y prête (figure 8).
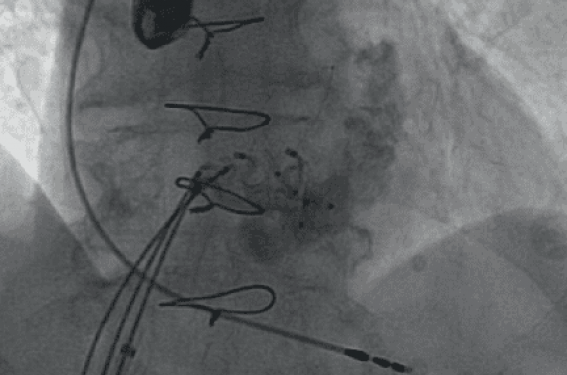
Figure 8. Mme A. FFPP 3. Accès et franchissement.
L’implantation simultanée de plusieurs prothèses peut être effectuée de la manière suivante : introduction de plusieurs guides au travers du premier cathéter ayant franchi la FPP, puis par des manœuvres d’échange au travers d’un gros introducteur fémoral veineux « classique », on place l’extrémité de plusieurs introducteurs dans le ventricule gauche : ainsi un désilet 18 F admet 3 gaines 6 F.
L’alternative consiste à placer l’extrémité d’un introducteur long de gros calibre dans l’oreillette droite, dans lequel peuvent être glissés plusieurs introducteurs de plus faibles calibres (figure 9).
Figure 9. Trois introducteurs 6 F placés dans une FPP étendue permettant de positionner simultanément avec succès 3 prothèses Amplatzer™ muscular VSD (M. Nejjari, Saint-Denis).
Les prothèses
L’objectif est d’implanter une prothèse totalement occlusive ne gênant pas le fonctionnement de la valve.
Toutes les prothèses utilisées sont en nitinol qui permet d’assurer la mémoire de forme. Beaucoup d’entre elles contiennent en plus des patchs de tissus (polyéthylène chez Occlutech et polyester chez Abbott).
La société Occlutech a développé des prothèses dédiées (mais non remboursées) avec en particulier des formes rectangulaires censées bien s’adapter aux défects en croissant de lune.
La société Amplatzer, rachetée successivement par St Jude et dernièrement Abbott offre tout un catalogue de prothèses d’occlusion cardiaque et vasculaire de formes très différentes, mais aucune prothèse dédiée.
Il n’y a aucune série comparative prospective ayant évalué les prothèses. Dans le registre espagnol, un des critères de succès était l’utilisation de l’AVP III (non remboursé).
En fait, aucune prothèse n’est universelle et permet de boucher toutes les FPP. Le choix se fait au cas par cas, en fonction des observations de l’ETO, mais au total l’analyse reste très semi-quantitative pour ne pas dire approximative (figure 10).
Figure 10. Mme A. FFP 3 : mise en place et largage de la prothèse.
Les complications
Elles sont peu fréquentes surtout compte tenu de la fragilité de ces patients. Une compilation récente des principales études(3) rapporte, FFPP mitrales et aortiques confondues, un taux de complication de l’ordre de 5 % et une mortalité de 2 %. Le registre anglo-irlandais est moins optimiste avec une mortalité hospitalière de 3,9 %(4). Toutefois, ces séries sont rétrospectives et peuvent omettre certaines complications.
En sus des complications communes à tous les cathétérismes (hématome fémoral en particulier), les complications spécifiques perprocédures sont la migration des prothèses – qui peuvent le plus souvent être récupérées au lasso –, et le blocage de l’élément mobile – bille pour les valves de Starr, ailettes pour les autres – de la valve mécanique par la prothése d’occlusion. Ainsi, certaines fuites très proches de l’anneau avec un trajet se dirigeant vers la partie médiane du ventricule gauche peuvent être pratiquement impossibles à traiter. Si une première prothèse essayée bloque l’ailette, il faut tenter un autre modèle : dans le cas de notre patiente, les prothèses de CIA et de CIV bloquaient l’ailette lors de la première tentative, alors que les prothèses AVP III implantées successivement lors des 2e et 3e procédures ont permis finalement l’occlusion quasi complète de la fuite sans blocage d’ailette.
Si le blocage d’ailette survient après le largage de la prothèse, il est possible d’attraper au lasso son extrémité auriculaire droite, soit pour la tracter suffisamment pour débloquer l’ailette, soit pour l’extraire complètement (figure 11).
Figure 11. Ailette supérieure d’une prothèse Duromedics bloquée après largage d’un AVP III et d’un AVP 4. La traction au lasso de l’AVP III permet de libérer l’ailette.
La complication postprocédure la plus redoutable est l’hémolyse aiguë à laquelle peut s’ajouter une défaillance rénale initiant une spirale de complications. Cette hémolyse est favorisée par la persistance d’une fuite résiduelle de haute vélocité avec un trajet excentré. L’analyse intermédiaire de l’étude prospective FFPP révèle aussi l’hémolyse préexistante comme facteur de risque (mais la FFPP permet aussi de traiter les hémolyses !).
Le succés
Chacune des étapes de la procédure peut être responsable d’un échec : les plus classiques sont l’échec de franchissement de la fuite par le guide, le cathéter ou l’introducteur, et la gêne au fonctionnement de la prothèse valvulaire par la prothèse implantée. Il est indispensable de distinguer le succès technique et le succès clinique.
Le succès technique est défini comme le succès d’implantation d’une ou plusieurs prothèses, associé à une diminution de fuite d’au moins 1 grade ; le succès clinique est défini comme une diminution, voire une disparition des symptômes.
Dans la compilation des principales études(3), le succès technique est compris entre 77 et 86 % et le succès clinique entre 67 et 77 %, ces taux de succès étant plus faibles pour les FFPP mitrales que pour les FFPP aortiques(2). Ces chiffres sont possiblement optimistes en raison du caractère rétrospectif des séries.
Conclusion
L’amélioration de l’imagerie offerte par l’ETO, la multiplicité des prothèses et les premiers résultats obtenus permettent de proposer la FFPP comme alternative à la chirurgie pour les patients symptomatiques non contrôlées par le traitement médical.
Toutefois, il s’agit d’une procédure souvent complexe, nécessitant parfois beaucoup de matériel. Les prothèses implantées sont toutes off label à l’exception de la PLD Occlutech®. La diversité anatomique des fuites impose un choix de prothèse adapté à chaque situation, mais aucune ne remplit réellement le cahier des charges.
La technique se doit de progresser, les résultats doivent être mieux évalués et nous encourageons toutes les équipes pratiquant ces procédures à rejoindre le Registre Prospectif FFPP et à partager leur expérience à l’occasion de la journée de Marie Lannelongue consacrée aux procédures inhabituelles en cardiologie interventionnelle.
* Sé HASCOËT, Mé KLOECKNER, Mé-Aé ISORNI, Jé GUIHAIRE, Pé BRENOT, Hôpital Marie Lannelongue, Le Plessis Robinson
Pour en savoir plus
• Registre FFPP. Florence Lecerf.flecerf@hml.fr
• 4e journée de Marie Lannelongue consacrée aux procédures inhabituelles en cardiologie interventionnelle : le 29 mars 2019. Véronique Audras. vaudras@hml.fr
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


