Focus-Nouvelle technique
Publié le 25 oct 2021Lecture 8 min
Fermeture percutanée des CIA sinus venosus - Une technique innovante et prometteuse
Clément BATTEUX et coll.*, Hôpital Marie Lannelongue, Groupe Hospitalier Paris Saint-Joseph, Le Plessis- Robinson
APPAC 2021
Une patiente de 73 ans consulte pour une communication interatriale (CIA) type sinus venosus. Compte tenu d’une dyspnée significative, d’un bon état général et d’une forme anatomique favorable, une correction par voie percutanée a été réalisée. Cette procédure est de développement récent. Nous décrivons à travers cette observation, la préparation de la procédure à l’aide des outils de simulation numérique et sur modèle 3D imprimé, le choix du matériel et la réalisation de cette procédure guidée par l’imagerie multi-modalités.
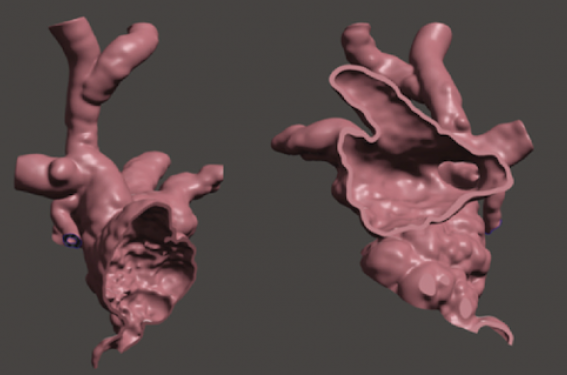
La communication interatriale type sinus venosus (CIA SV) est une cardiopathie congénitale relativement rare, appartenant à la famille des communications interatriales (1/1 500 naissances). Cette malformation se distingue des CIA ostium secundum par son mécanisme embryologique résultant de l’accolement de la veine cave supérieure (VCS) et de la veine pulmonaire supérieure droite (VPSD) et l’apoptose de la paroi. Cela conduit à un défect haut placé, au pied de la VCS, et à un retour veineux pulmonaire anormal (RVPA) connecté à la VCS (figure 1). Sans prise en charge, l’évolution naturelle est celle des shunts gauche-droite avec notamment le risque inconstant mais grave de développement d’une hypertension artérielle pulmonaire ainsi que d’arythmies supra-ventriculaires.
Le traitement de cette malformation a longtemps été exclusivement chirurgical, nécessitant une sternotomie, une circulation extracorporelle pour une tunnelisation du RVPA à l’oreillette gauche (OG) associée à un patch d’élargissement de la VCS ou à sa reconnexion sur l’oreillette droite (OD) par l’intermédiaire d’un tube. Cette chirurgie est efficace mais des complications sont décrites comme la dysfonction sinusale, l’occlusion de la VCS ou du chenal du RVPA. Depuis 2013, un traitement percutané de cette malformation s’est développé, notamment à l’initiative de l’équipe de l’Evelina hospital à Londres(1,2). Les résultats préliminaires sont encourageants. La procédure consiste à déployer un stent couvert dans la VCS afin d’exclure le défect en redirigeant le flux veineux pulmonaire anormal vers l’OG à travers le défect.
Nous avons réalisé la première procédure en France à l’hôpital Marie Lannelongue en mai 2020, suivi par 8 autres cas depuis dans notre centre et à Toulouse(3). Nous décrivons à travers une observation, la préparation de la procédure à l’aide des outils de simulation numérique et sur modèle 3D imprimé, le choix du matériel et la réalisation de cette procédure guidée par l’imagerie de fusion multimodalités(4).
OBSERVATION CLINIQUE
Mme M. âgée de 73 ans est adressée pour une CIA sinus venosus de découverte récente au décours d’une ablation électrophysiologique d’un flutter. Elle se plaint d’une dyspnée persistante invalidante d’aggravation récente malgré un état général préservé.
À l’échocardiographie, du fait de la CIA SV, on observe un shunt gauche-droite significatif avec dilatation des cavités droites (surface de l’OD à 34 cm²). On note une hypertension pulmonaire modérée avec pression artérielle pulmonaire systolique à 45 mmHg.
En staff médicochirurgical, compte tenu de l’âge et en accord avec les recommandations ESC 2020, une abstention chirurgicale est retenue et la faisabilité d’une procédeure percutanée est encouragée.
Étude de la faisabilité d’une fermeture percutanée de la CIA SV
Les données du scanner sont reconstruites en 3D permettant une analyse anatomique et une simulation virtuelle de la procédure (figure 2). Chez cette patiente, on observe que la CIA SV est assez large. Le RVPA est composé de 2 veines segmentaires supérieures droites confluentes en bouquet et abouchées à la base de la VCS à proximité de la CIA. La simulation de la mise en place d’un stent dans la VCS permet la redirection du RVPA vers l’OG à travers la CIA sans obstruction des veines pulmonaires. L’anatomie semble favorable.
En complément une impression 3D est réalisée (Dr V. Ciobotaru, 3D Heart Modeling). Ce modèle 3D (impression polyjet, preset vasculaire, dureté de 40 shore) est connecté à un circuit d’ECMO sur un un banc d’essai permettant une simulation de la procédure en salle hybride de recherche (hôpital Marie Lannelongue ; figure 3).
On confirme sur cette simulation de la mise en place du stent, une anatomie favorable dans ce cas de figure (figure 4). Une fermeture percutanée est retenue après une explication minutieuse à la patiente, à sa famille et à son cardiologue référent.
Principe de la procédure
La procédure consiste à placer un stent couvert dans la veine cave supérieure au pied du tronc veineux innominé. L’objectif du stenting couvert est triple :
– drainage du retour veineux cave supérieur à l’oreillette droite,
– tunnélisation du RVPA à l’OG,
– la couverture du stent assure la continence et la correction du shunt.
La procédure est réalisée sous anesthésie générale avec guidage par échographie transœsophagienne. La fusion d’images temps-réel entre l’échocardiographie et la fluoroscopie (logiciel EchoNavigator, Philips) est utilisée.
Un recalage de la reconstruction 3D à partir du scanner est aussi réalisé avec la fluoroscopie (Logiciel VesselNavigator, Philips). Sur cette reconstruction 3D ont été positionnées les zones cibles d’intérêt pour le deploiement du stent (figure 5).
La procédure débute par un triple accès veineux : fémoral droit et gauche et jugulaire droit. La première étape consiste à créer un rail fémorojugulaire, à l’aide d’un guide rigide qui permettra d’acheminer le stent serti manuellement sur un ballon dans la zone d’intérêt et de le déployer. Un abord transseptal additionnel par voie veineuse fémorale gauche est réalisé pour monitorer et protéger le RVPA en passant par l’OG (figure 6).
Un test au ballon est réalisé au diamètre cible du stent pour confirmer l’absence de compression du RVPA et confirmer la faisabilité de la procédure. Au décours de l’inflation du ballon, la pression dans le RVPA ainsi que le flux de la veine pulmonaire en ETO et en angiographie sont contrôlés.
Par la suite, un stent spécialement manufacturé CP10Z (NuMed Inc.) de 80 mm de long est manuellement serti sur un ballon BIB de 80 mm de long et déployé sur la zone cible en 2 temps (figure 7). Après avoir testé sa stabilité et son bon positionnement, la partie inférieure est évasée à l’aide d’un ballon Coda® (Cook Medical) pour assurer l’étanchéité.
L’absence de shunt résiduel est vérifiée par le guidage échocardiographique. La bonne perméabilité du RVPA, redirigé à l’OG, est vérifiée (figure 8).
Figure 8. Fusion entre l’échographie 2D et la fluoroscopie montrant une bonne perméabilité du RVPA vers l’OG (à gauche). En fusion avec le Doppler couleur, on visualise un bon écoulement du RVPA à l’OG (à droite).
Évolution
Les suites après la procédure ont été simples permettant une sortie le lendemain. Un traitement anticoagulant préexistant a été poursuivi. Une amélioration de la dyspnée rapide et spectaculaire a été rapportée par la patiente dès les premiers jours. Un scanner de contrôle réalisé la première semaine montre un bon positionnement du stent et une bonne tunnelisation du RVPA à l’OG (figure 9).
DISCUSSION
Cette observation illustre l’efficience et la faisabilité de la fermeture percutanée de la CIA sinus venosus lorsque l’anatomie est favorable. Le traitement de référence de la CIA sinus venosus est la chirurgie sous circulation extracorporelle.
Lorsque ce défect est diagnostiqué relativement tardivement à l’âge adulte, l’abstention thérapeutique est parfois retenue, en particulier selon les comorbidités, comme indiqué dans les recommandations ESC 2020.
Publiée pour la première fois en 2013, la technique de correction percutanée des CIA sinus venosus est en pleine expansion(1, 2). Réalisée dans plusieurs pays dans des centres experts en cardiopathie congénitale, la méthode, son efficacité et sa sécurité sont appuyées par une étude pilote multicentrique à laquelle nous avons contribué(5).
L’apport de l’imagerie tridimensionnelle et des outils de simulation- guidage peropératoire multimodalités sont d’une aide essentielle pour la compréhension anatomique et la vérification de l’éligibilité d’un patient, pour la planification préopératoire du matériel dédié et pour le guidage de la procédure.
Les deux risques majeurs décrits et rencontrés au cours de cette procédure sont l’instabilité voire l’embolisation du stent, et la sténose voire l’occlusion d’une veine pulmonaire anormale après déploiement. Ces deux complications entraînent la nécessité d’un recours chirurgical du fait du caractère non recapturable du stent déployé.
Pour éviter l’instabilité du stent déployé, le choix des dimensions de ce dernier doit être parfaitement adapté à la morphologie de la VCS. La longueur du stent couvert doit être assez importante pour couvrir le bord supérieur du RVPA le plus haut jusqu’au bord inférieur de la CIA, en intégrant les propriétés mécaniques de raccourcissement du stent. Des stents allant jsuqu’à 100 mm sont actuellement en cours de fabrication par l’industrie pour répondre à ce besoin. Des stents autoexpansibles ont été tentés initialement par les équipes pionnières mais se sont avérés instables.
Le risque de sténose ou l’occlusion d’une veine pulmonaire anormale survient lorsque le stent couvert obstrue la tunnelisation du RVPA à l’OG. Cette complication peut être rencontrée lors d’une expansion trop importante du stent à proximité du RVPA, et est souvent favorisée par une mauvaise sélection des patients candidats à la fermeture percutanée. Il faut donc au préalable en particulier apprécier le nombre et la hauteur d’abouchement des veines segmentaires anormales.
Chez les patients à risque, cette complication peut être évitée par la réalisation d’un abord transseptal permettant d’accéder au RVPA depuis l’OG et de le protéger par l’inflation d’un ballon de protection gonflé à son ostium. Le stent vient alors se mouler sur ce ballon de protection lors de son déploiement.
PERSPECTIVES
Actuellement, la procédure nécessite beaucoup de préparation et reste relativement longue dans son déroulement.
Une meilleure compréhension des formes à risque ou non pourra sans doute permettre de simplifier la procédure éventuellement en s’affranchissant de l’abord transseptal lorsque l’anatomie est très favorable.
La collaboration avec l’industrie est essentielle pour standardiser la production de stents de longueur et largeur adaptées et de dispositifs de déploiement adéquats, validés par les autorités de tutelle.
Cette procédure est actuellement réservée aux patients adultes chez lesquels le stent implanté sera de diamètre définitif.
* V. CIOBOTARUa,b, N. COMBESa,c, L. MOISSONd, C. KARSENTYe, P. BRENOTa, S. HASCOËTa
a. Hôpital Marie Lannelongue, Groupe Hospitalier Paris Saint-Joseph, Le Plessis- Robinson ;
b. Clinique Les Franciscaines, Nîmes ;
c. Clinique Pasteur, Toulouse
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


