Complication
Publié le 15 mar 2019Lecture 10 min
Fuite tricuspidienne importante après implantation de sonde ventriculaire
Séverine PHILIBERT, Hôpital Saint-Joseph, Paris ; Jean-Christophe EICHER, Gabriel LAURENT, CHU de Dijon
Les dispositifs électroniques cardiaques implantables (DECI) ont amélioré la qualité de vie et réduit la morbi-mortalité de millions de patients. Ils sont disponibles depuis les années 1950 et ce qui n'a pas changé, c'est la présence d'au moins une sonde placée dans le ventricule droit (dans la grande majorité des cas), pouvant parfois avoir des conséquences néfastes sur la valve tricuspide (VT) qu'elle traverse. L’insuffisance tricuspide (IT) post-DECI est connue, mais sa fréquence et son impact clinique n'ont jamais été bien établis. Des études de petite taille avec un court délai de suivi retrouvent une incidence allant de 7 à 39 %(1-6).
Mécanismes d’une IT post-implantation de sonde VD
Deux mécanismes peuvent provoquer une IT : les phénomènes mécaniques, par traumatisme ou par restriction d’un feuillet liée à la sonde, et la désynchronisation induite par la stimulation ventriculaire droite (VD).
Causes mécaniques
• Phénomènes précoces. Lors de l’implantation de la sonde, des lésions des feuillets de la VT peuvent se produire, par perforation, lacération, avulsion et section du tissu papillaire, des muscles ou des cordages tendineux(7-9). Les facteurs techniques favorisants perprocédure sont :
– le type de fixation (barbillons ou vis), la sonde pouvant se bloquer dans les cordages ;
– la technique de positionnement de la sonde dans le VD qui peut produire des lésions directes de la valve : la technique en prolapsing peut réduire le risque de perforation et de déchirure par rapport aux techniques du direct-crossing ou drop-down plus traumatiques (figure 1)(10) ;
– le nombre, le diamètre mais aussi la position des sondes passant à travers la VT.
Le mécanisme probablement le plus fréquent n’est pas lésionnel mais mécanique par restriction d’un feuillet, la présence de la sonde gênant sa fermeture. Bien que la mobilité soit normale à l’ouverture de la valve, il existe un conflit entre la sonde et les feuillets, gênant sa coaptation complète, le feuillet septal étant le plus souvent affecté(11).
Figure 1. Les différentes techniques pour positionner la sonde VD.
• Phénomènes tardifs : l’interaction à long terme entre le corps de la sonde et les cordages peut générer une réponse inflammatoire et fibreuse du fait de la présence de ce corps étranger. Il se crée parfois une encapsulation de la sonde avec perte de mobilité des feuillets valvulaires (fuite restrictive) ou perte de coaptation(12-14). Une prolifération importante de fibrose avec adhérences entre la surface de la sonde et l’endocarde peut se produire tout au long de son parcours(15). La position apicale de l’électrode distale semble être associée à une augmentation du risque d’attachement au feuillet postérieur par rapport à la position septale(16). La présence de matériel dans le système circulatoire associée aux dommages sus-cités au niveau de la VT prédispose à la survenue d’une endocardite et/ou de thrombose, pouvant également conduire à un dysfonctionnement de la VT(17). L’infection du DECI nécessite presque toujours l’extraction des sondes. Cette intervention doit être réalisée rapidement car les patients qui subissent l’ablation d’un dispositif infecté pendant l’hospitalisation sont deux fois moins susceptibles de décéder (20 % de mortalité à 1 an) comparés à ceux qui ne subissent pas l’ablation du dispositif (38 %)(18). Les taux de morbidité et de mortalité liés à l’infection d’un DECI augmentent considérablement lorsque la VT est impliquée.
Désynchronisation en lien avec la stimulation VD
La désynchronisation interventriculaire induite par la stimulation VD exclusive peut être une cause de fuitemitrale(19). Il n’a pas été prouvé que le même mécanisme existe pour la VT. Mais en altérant la fonction VG et en induisant une insuffisance mitrale (IM), l’élévation des pressions de remplissage gauche puis de la pression artérielle pulmonaire peut induire une IT secondaire, fonctionnelle(20). Cette hypothèse est étayée par l’étude canadienne de Sadreddini et al., qui a montré qu’une majoration des IT apparaissait chez les patients implantés d’un stimulateur double chambre et pas ceux implantés d’un CRT-P(21). Une série israélienne de petite taille montre que l’IT est plus importante en cas de stimulation VD(22).
Diagnostic d’IT en lien avec un DECI
C’est l’échographie cardiaque 2D, 3D voire 4D qui est l’examen de référence. La présence des sondes crée des artéfacts importants et une atténuation du signal en raison de leur impédance acoustique et de leur réflectivité toutes deux élevées, ce qui peut entraîner une sous-estimation de l’IT.
Ces artéfacts sont un peu moins gênants en ETO. Lorsque l’IT est causée par une altération asymétrique de la mobilité des feuillets (comme c’est parfois le cas d’une IM), le jet régurgitant est davantage excentrique entraînant une perte du signal au Doppler couleur (effet Coanda) et donc une sous-estimation de la régurgitation. Il est donc important d’enregistrer un éventuel reflux dans les veines sus-hépatiques (VSH), car les flux Doppler (spectraux et colorimétriques) ne sont pas affectés par les artéfacts des sondes. L’inversion du flux holosystolique dans les VSH est en faveur d’une IT sévère, alors qu’un débit systolique antérograde normal exclut une IT modérée ou sévère, à condition que l’oreillette droite ne soit pas dilatée(23). L’évaluation au Doppler de la VSH est essentielle chez les porteurs d’un DECI car la prévalence et la gravité des IT induites par la sonde VD est susceptible d’être sousestimée par une évaluation échographique de routine.
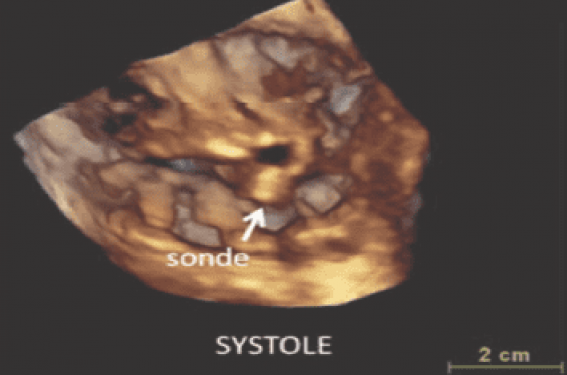
L’échocardiographie 3D offre une meilleure définition spatiale de l’interaction entre la sonde et la valve ou l’appareil sous-valvulaire. Elle permet de mieux identifier les causes de la fuite (figure 2). Bien que l’ETO 2D offre une meilleure résolution spatiale et une meilleure qualité d’image, elle présente les mêmes défauts que l’ETT 2D dans la mesure où aucune imagerie 2D ne peut afficher les 3 feuillets de la VT sur une seule image. Enfin, certains auteurs ont proposé de réaliser une échographie intracardiaque (ICE) pour un guidage peropératoire en temps réel du positionnement des sondes afin de réduire au mieux les effets sur le fonctionnement de la VT(24).
Figure 2. A : sonde VD plaquée contre le septum interventriculaire, gênant la fermeture de la valve septale ; B : dilatation des veines sus-hépatiques ; C : à gauche : sonde gênant la fermeture de la valve septale ; à droite : Doppler couleur montrant une insuffisance tricuspide sévère ; D : échocardiographie 3D montrant le défaut de fermeture du feuillet postérieur. OD : oreillette droite ; VD : ventricule droit ; VG : ventricule gauche.
Prise en charge thérapeutique chirurgicale
Le traitement chirurgical d’une IT sévère induite par une sonde VD comprend :
– l’annuloplastie par suture de De Vega ;
– l’annuloplastie annulaire ;
– le remplacement valvulaire, avec ou sans retrait de la ou des sondes.
Pour effectuer une réparation de la valve avec préservation de la sonde, celle-ci doit d’abord être libérée de ses adhérences avec les feuillets valvulaires. La sonde peut alors être repositionnée en la fixant à un endroit adjacent à l’anneau tricuspide, entre deux feuillets, avec fermeture de la fente par suture des deux valves adjacentes (figure 3). Une suture de type De Vega ou une annuloplastie peuvent être réalisées si l’anneau est dilaté.
Figure 3. Étapes de la réparation chirurgicale. 1 : Mobilisation de la sonde et des feuillets de la valve tricuspide. 2 : Sonde repositionnée dans la fente entre le feuillet septal et inférieur, avec suture des feuillets au-dessus de la sonde rendant la valve bicuspide. 3 : Sonde repositionnée avec fente de fermeture et annuloplastie tricuspide.
Raman et al. ont pratiqué avec succès, chez plus de 42 patients atteints d’insuffisance cardiaque, une réparation de la valve tricuspide tout en conservant la sonde de défibrillation qui a été repositionnée auniveau du feuillet septal et postérieur de la VT avec création d’une fente et implantation d’un anneau tricuspide(25).
La préservation de la sonde pendant le remplacement valvulaire nécessite son déplacement vers l’anneau tricuspide natif ou la valve de remplacement(26). Le risque principal est ici d’endommager la sonde, raison pour laquelle une extraction est souvent préférée. Si l’IT sévère persiste, il convient alors d’envisager une réparation ou un remplacement valvulaire (si nécessaire), puis une réimplantation de la sonde (figure 4)(27).
Figure 4. Algorithme décisionnel devant une IT sévère en lien avec un DECI. IT : insuffisance tricuspide ; DECI : dispositif électronique cardiaque implantable ; VSH : veines sus-hépatiques ; ETT : échographie transthoracique ; ETO : échographie transœsophagienne ; RVT : remplacement valvulaire tricuspide ; CRT-P : stimulateur resynchronisateur ; TMO : traitement médical optimal.
Une procédure combinée est également possible avec une libération percutanée de la sonde VD puis son retrait par extraction directe au niveau de la veine sous-clavière (VSC) ou de la veine cave supérieure (VCS), suivie d’un remplacement valvulaire. Le repositionnement d’une sonde VD à travers un anneau d’annuloplastie ou une valve bioprothétique est ensuite possible. Toutefois, il est important d’envisager d’autres alternatives comme la mise en place d’une sonde épicardique, d’une stimulation ventriculaire gauche via le sinus coronaire, d’une stimulation hissienne ou la mise en place d’un stimulateur sans sonde.
Pour savoir si l’extraction de la sonde sans réparation valvulaire est suffisante, il faut avant tout connaître les caractéristiques de l’IT en échocardiographie : sa sévérité, le degré de dilatation annulaire, l’étendue des adhérences entre la sonde et les feuillets valvulaires, la nature de l’interaction entre la sonde et la valve. Si la sonde a été implantée récemment, le risque de dommages au niveau des feuillets est minime et une intervention chirurgicale peut le plus souvent être évitée.
Indications de repositionnement ou d’extraction d’une sonde VD
En cas d’IT symptomatique sévère, cette procédure se justifie s’il existe des preuves échographiques 3D convaincantes impliquant la sonde VD dans le mécanisme de la fuite. L’objectif de l’ETT est de différencier une IT fonctionnelle (qui ne sera pas améliorée par l’extraction de la sonde), d’une IT mécanique liée à la sonde (parfois les deux mécanismes sont impliqués). En présence d’une IT fonctionnelle sévère et d’une hypertension artérielle pulmonaire (HTAP) postcapillaire, il est préférable d’éviter une extraction de sonde ou la réalisation d’une chirurgie valvulaire. Il est donc important de toujours optimiser la prise en charge médicale de l’HTAP qui peut exacerber l’IT avant de prendre toute décision sur une prise en charge invasive.
Idéalement, en première intention une tentative de repositionnement de la sonde VD dans une commissure peut être réalisée avant d’envisager son extraction, plus à risque. Mediratta et al. ont constaté que l’emplacement de la sonde VD dans une position commissurale était associée à une IT moins sévère. Dans ce cas, la position de la sonde doit être confirmée en peropératoire par une ETT 3D. L’autre option, plus invasive, est l’extraction de la sonde. Actuellement, il n’existe aucune donnée prospective permettant de définir des indications d’extraction en raison d’une IT isolée (absence d’endocardite ou d’infection de matériel). En revanche, il est reconnu qu’une extraction de sonde peut se justifier en cas d’infection, de problèmes d’abord vasculaires (avec nécessité de changer de sonde par exemple), de douleurs chroniques sévères au niveau de la loge, ou de la nécessité d’une radiothérapie sur le site de passage de la sonde(28).
Alternative aux sondes endocardiques transvalvulaires
Pour éviter le passage à travers la VT, des alternatives sont envisageables :
• La stimulation du ventricule gauche via le sinus coronaire, en général réservée aux techniques de resynchronisation.
• La stimulation épicardique, limitée par son caractère invasif chirurgical et par les risques d’élévation de seuils. Elle est souvent la solution en cas d’infection chez des patients dépendants de la stimulation.
• Le stimulateur sans sonde. Le stimulateur Micra™ (Medtronic), est efficacement implanté dans 99,6 % des cas, avec un faible taux de complications majeures (1,51 %) dans les 30 jours après implantation, sans complication valvulaire répertoriée à ce jour(29).
• La stimulation du faisceau de His, connue depuis 50 ans. Elle permet de conférer une séquence d’activation plus physiologique et de minimiser les effets délétères de la stimulation VD. Parce que le faisceau de His pénètre dans le septum membraneux du côté atrial au niveau de l’insertion de la VT, sa stimulation peut être réalisée sans affecter la fermeture et/ou la fonction de la valve. Au cours des 20 dernières années, plusieurs études ont montré qu’elle pouvait être réalisée en toute sécurité. Celle-ci génère des complexes QRS plus fins que la stimulation biventriculaire ou même parfois de la conduction native, et peut entraîner une amélioration de la fraction du ventriculaire gauche (FEVG) et de la qualité de vie tout en réduisant le nombre des hospitalisations pour insuffisance cardiaque(30-32).
Conclusion
L’IT est une complication souvent négligée après l’implantation d’un DECI. Si son incidence est mal connue, elle est le plus souvent minime et/ou asymptomatique. En revanche, une IT massive associée à une aggravation des symptômes d’insuffisance cardiaque ne doit pas être méconnue.
L’échocardiographie 3D est un élément clé du diagnostic, et permet de préciser la gravité et la responsabilité d’une ou plusieurs sondes ventriculaires droites dans le mécanisme de la fuite.
Si la responsabilité de la sonde est avérée, une intervention corrective peut être envisagée après optimisation du traitement médical, idéalement avant l'apparition d'une dilatation annulaire ou d'une IT sévère. Il s’agit d’extraire le matériel voire de reconstruire chirurgicalement la valve ou de la remplacer, mais actuellement il n’y pas de recommandations sur lesquelles s’appuyer. Les stimulateurs sans sonde ont leur place dans ce contexte, surtout après extraction du matériel endovasculaire et chirurgie valvulaire correctrice.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


